Corin基因通过NF-κB信号通路对心肌细胞增殖凋亡的机制研究
2018-11-09李岩松姜衡费民忠夏静雯魏永
李岩松,姜衡,费民忠,夏静雯,魏永
氧化应激是机体产生的氧化与抗氧化不平衡状态,大量氧自由的产生可造成组织炎症反应和氧化应激损伤,是一个引起心血管疾病功能异常、心肌细胞凋亡或损伤的重要因素,与心肌梗死、心力衰竭等多种心血管疾病存在密切联系[1-3]。在心血管疾病发生发展中心肌细胞凋亡贯穿整个过程,因此寻找降低心肌细胞凋亡的途径及研究其机制尤为重要。目前已发现多个降低心肌细胞凋亡的分子靶点,如miR-24、miR-221等[4,5],但仍需发现更多的分子靶点。心房利钠肽(ANP)属于利钠肽家族,由心房的心肌细胞产生、储存和分泌,参与心血管系统的生理及病理过程,可保护心血管系统[6,7]。Corin是一种新发现的Ⅱ型跨膜丝氨酸蛋白酶,主要表达在心脏,可将利钠肽(NP)前体转化为有生物学活性的NP,从而发挥改善心功能作用[8]。近几年研究发现Corin基因活性降低可能与高血压、心脏病、心力衰竭等心血管疾病发生有关[9,10]。本研究中我们主要研究Corin对过氧化氢(H2O2)诱导的心肌细胞生物特性及调控机制。
1 资料与方法
1.1 细胞分组及处理H9c2细胞购自美国ATCC。H9c2细胞在DMEM培养基(含有10%小牛血清、青霉素和链霉素各100 U/ml)中,于5%体积分数CO2及95%饱和湿度的恒温培养箱中37℃培养,细胞达80%以上生长密度时,胰蛋白消化后传代。将H9c2细胞分为空白对照组(Control组)、pcDNA3.1组、过氧化氢(H2O2)组、pcDNA3.1-C o r i n组。空白对照组细胞无特殊处理,pcDNA3.1组加入pcDNA3.1载体,H2O2组使用150 μmol/L的H2O2处理空白细胞6 h,pcDNA3.1-Corin组参照脂质体LipofectamineTM2000转染pcDNA3.1-Corin后再用150 μmol/L的H2O2处理细胞6 h。6 h后换为含有血清的培养基继续培养,用于实验研究。
1.2 主要试剂和仪器DMEM培养基及青链霉素均购自美国Gibco;胎牛血清、LipofectamineTM2000均购自美国Invitorgen公司;CCK8试剂、BAY 11-7082均购自美国Sigma公司;Annexin V-FITC/PI细胞凋亡试剂盒、流式细胞仪均购自美国BD公司;ki67、p53、NF-κB IκBα抗体均购自美国SantaCrus公司;酶标仪购自美国Biotek公司。
1.3 蛋白质印迹加入适量的蛋白质裂解液于转染24 h的各组细胞中,细胞置于冰上充分裂解反应30 min收集蛋白,BCA测定总蛋白浓度,每泳道中加入100 ℃变性蛋白50 μg进行电泳分离,电泳后通过电转移至PVDF膜,转好的PVDF膜置于50 g/L的脱脂奶粉封闭液中封闭2 h,洗膜,4℃孵育适当稀释比例的ki67、p53、NF-κB IκBα和内参GAPDH抗体过夜,洗膜后加入稀释好的HRP标记的羊抗兔抗体,孵育2 h,洗膜后ECL试剂显色,置于暗室中显影定影。
1.4 细胞活力检测细胞活力检测通过细胞计数试剂盒(CCK8)法。每孔5000个细胞将H9c2细胞接种于96孔板,置于培养箱中培养12 h以上,观察细胞是否贴壁,在贴壁均匀的96孔板中,参照1.3分组用pcDNA3.1组、H2O2组、pcDNA3.1-Corin处理细胞,每组设置5个复孔,24 h后加入CCK8试剂10 μl在每个细胞孔中,酶标仪测定各组各个孔的吸光度值(OD值)(波长为490 nm)。以OD值反映细胞活力,可间接反映出细胞的增殖能力,实验重复3次。
1.5 细胞凋亡检测细胞凋亡检测采用Annexin V-FITC/PI凋亡检测试剂盒。处理后的细胞使用预冷的磷酸盐缓冲液洗涤2次,binding buffer重悬细胞,洗涤细胞后加入胰蛋白酶消化细胞,离心后收集1~5×105个细胞,细胞中分别加入AnnexinV-FITC(250 μg/ml)和PI(250 μg/ml)5 μl,避光条件室温反应5~15 min,1 h内上机,流式细胞仪检测凋亡率。实验重复3次。
1.6 抑制NF-κB信号通路对心肌细胞增殖凋亡的影响BAY 11-7082作为NF-κB信号通路抑制剂,细胞通过pcDNA3.1-Corin和pcDNA3.1-Corin+BAY 11-7082(10 μmol/L) 处理(pcDNA3.1-Corin+BAY 11-7082组)。参照上述方法检测各组细胞活力和凋亡情况。
1.8 统计学方法所有实验数据采用SPSS 21.0软件进行分析,计量资料用平均数±标准差(±s)表示,多组差异比较采用单因素方差分析,两两比较采用SNK-q检验,以P<0.05为差异有统计学意义。
2 结果
2.1 pcDNA3.1-Corin转染H9c2细胞的效果Western blotting检测的pcDNA3.1-Corin转染H9c2细胞的效果如图1和表1所示,pcDNA3.1组Corin的表达与对照组差异无统计学意义(P>0.05),H2O2组Corin的表达显著低于对照组(P<0.05),低于pcDNA3.1-Corin组(P<0.05)。
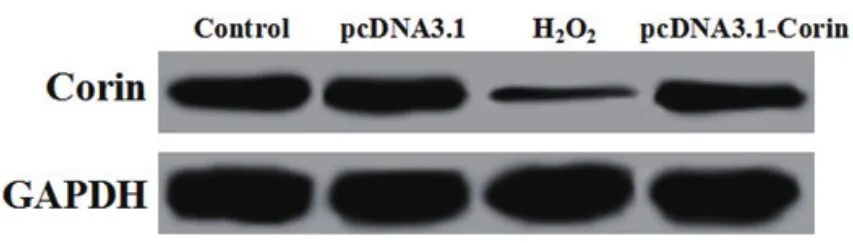
图1 pcDNA3.1-Corin转染H9c2细胞的效果(Control:对照组;pcDNA3.1:pcDNA3.1载体;H2O2:过氧化氢;GAPDH:甘油醛-3-磷酸脱氢酶)
2.2 过表达Corin对H2O2诱导的H9c2细胞活力及凋亡的影响通过脂质体LipofectamineTM2000转染pcDNA3.1-Corin后再用H2O2处理H9c2细胞,检测的细胞活力及凋亡结果如图2和表2所示,与pcDNA3.1组比较,H2O2组细胞活力显著降低(P<0.05),凋亡率显著升高(P<0.05);与H2O2组比较,pcDNA3.1-Corin组细胞活力显著升高(P<0.05),凋亡率显著降低(P<0.05)。
2.3 过表达Corin对H2O2诱导的H9c2细胞增殖凋亡蛋白及NF-κB信号通路的影响各组细胞中增殖凋亡相关蛋白ki67、p53及细胞核转录因子-κB(nuclear factor-κB,NF-κB)信号通路NF-κB 和IκBα的蛋白表达结果如图3和表3所示,与pcDNA3.1组比较,H2O2组ki67和IκBα的表达均显著降低(P<0.05),p53和NF-κB的表达均显著升高(P<0.05);与H2O2组比较,pcDNA3.1-Corin组ki67和IκBα的表达均显著升高(P<0.05),p53和NF-κB的表达均显著降低(P<0.05)。
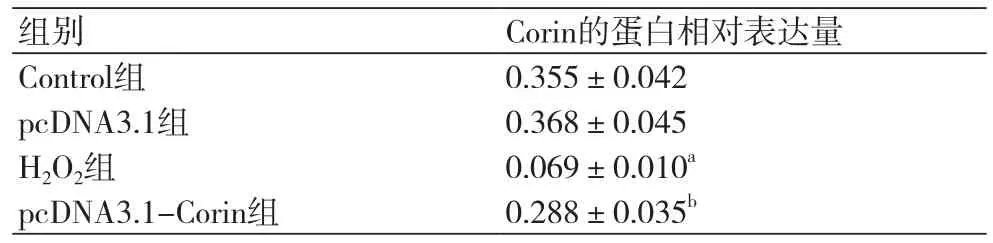
表1 pcDNA3.1-Corin转染H9c2细胞后各组细胞中Corin的蛋白相对表达量
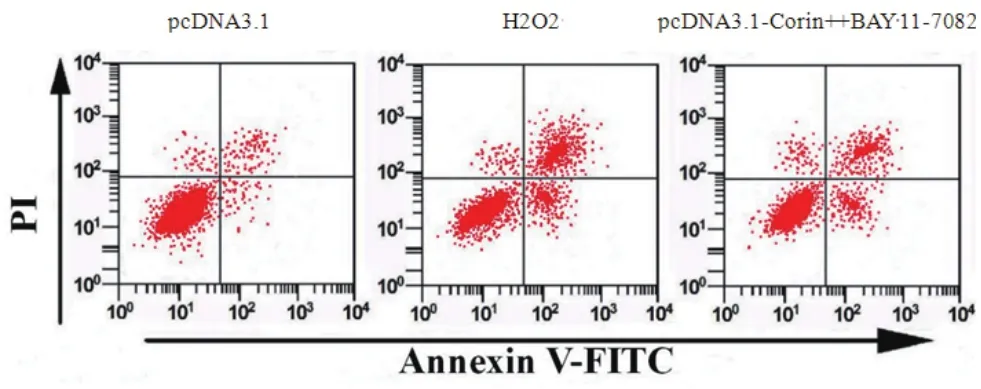
图2 过表达Corin对H2O2诱导的H9c2细胞凋亡的影响(pcDNA3.1:pcDNA3.1载体;H2O2:过氧化氢;PI:碘化丙啶;Annexin V-FITC:膜联蛋白 V-FITC)

表2 过表达Corin对H2O2诱导的H9c2细胞活力及凋亡的影响
2.4 过表达Corin通过NF-κB信号通路对H2O2诱导的H9c2细胞活力及凋亡的影响BAY 11-7082作为NF-κB信号通路抑制剂,通过过表达Corin及BAY 11-7082共同处理H9c2细胞,细胞活力及凋亡检测结果如图4和表4所示,与pcDNA3.1-Corin组比较,pcDNA3.1-Corin+BAY 11-7082组细胞活力显著升高(P<0.05),凋亡率显著降低(P<0.05)。
2.5 过表达Corin抑制NF-κB信号通路后增殖凋亡蛋白及通路蛋白表达两组细胞中ki67、p53、NF-κB 和IκBα的蛋白表达结果如图5和表5所示,与pcDNA3.1-Corin 组比较,pcDNA3.1-Corin+BAY 11-7082 组ki67和IκBα的表达均显著升高(P<0.05),p53和NF-κB的表达均显著降低(P<0.05)。

表3 过表达Corin对H2O2诱导的H9c2细胞增殖凋亡蛋白及NF-κB信号通路的影响
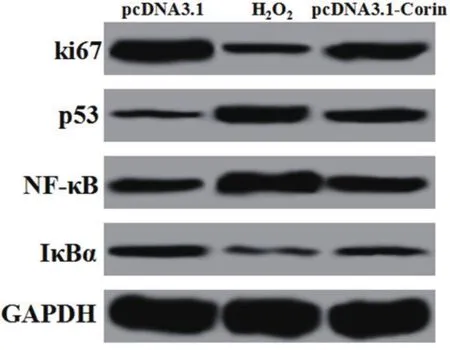
图3 过表达Corin对H2O2诱导的H9c2细胞增殖凋亡蛋白及NF-κB信号通路的影响(pcDNA3.1:pcDNA3.1载体;H2O2:过氧化氢;NF-κB:细胞核转录因子-κB;IκBα:NF-κB抑制蛋白;GAPDH:甘油醛-3-磷酸脱氢酶)
3 讨论
目前越来越多的研究显示氧自由基参与心脏重塑、心衰等心血管疾病的病理进程,但活性氧在这些疾病中的影响及调控作用还未明确[11,12]。大量研究显示,活性氧可由心肌细胞、中性粒细胞等的活化产生,机体过量的活性氧生成可引起组织细胞发生损伤,还可导致细胞内DNA断裂,染色体发生畸变,最终引起细胞死亡[13]。H2O2为活性氧的一种,目前大量研究采用H2O2作为模拟神经细胞、心肌细胞等发生氧化损伤的模型[14,15]。在本研究也使用H2O2建立心肌氧化应激模型。Corin是一种主要表达于心脏的Ⅱ型跨膜丝氨酸蛋白酶,通过将ANP活化而对心脏和血压功能进行调节,有研究显示,Corin基因发生变异和缺失可导致心力衰竭、心肌肥厚等多种心血管疾病发生发展[16,17]。如在高糖诱导的H9c2细胞中Corin的表达降低,抑制Corin的表达后心肌细胞增殖明显降低,且抑制了内皮细胞的损伤修复[18]。此外,流行病学的研究显示Corin浓度与心肌梗死、心衰等心血管疾病呈现出相关性[19],这提示Corin在心血管疾病中的重要作用。但Corin基因对H2O2诱导的H9c2细胞增殖凋亡及机制研究的尚未清楚。
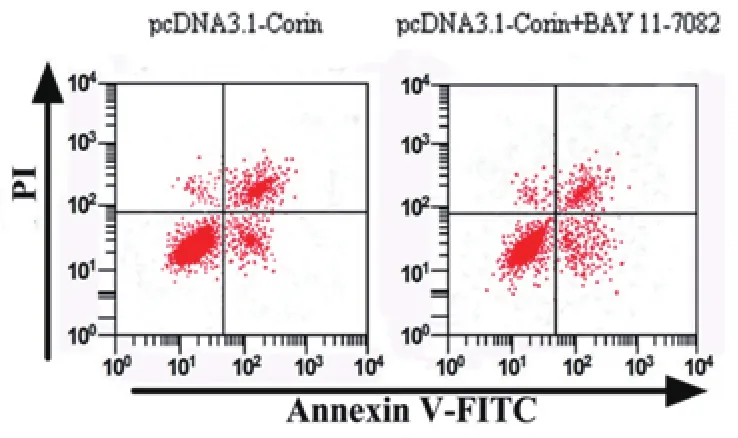
图4 过表达Corin通过NF-κB信号通路对H2O2诱导的H9c2细胞凋亡的影响
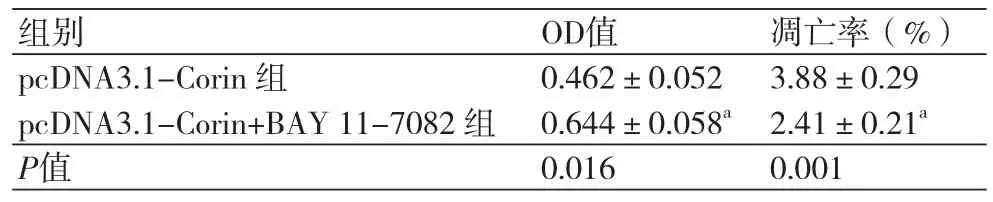
表4 过表达Corin通过NF-κB信号通路对H2O2诱导的H9c2细胞活力及凋亡的影响
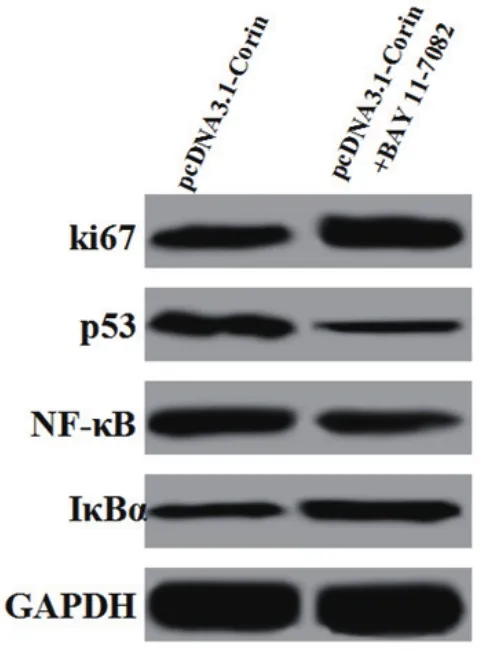
图5 过表达Corin抑制NF-κB信号通路后增殖凋亡蛋白及通路蛋白表达
鉴于前人研究的Corin基因的低表达可对心肌细胞造成损伤,本研究旨在过表达Corin对H2O2诱导的H9c2细胞的影响。将H2O2刺激及H2O2刺激和过表达Corin处理细胞,可发现H2O2刺激可降低细胞内Corin的表达,过表达Corin后Corin的表达明显升高。细胞活力及凋亡检测发现H2O2刺激可明显降低H9c2细胞活力,诱导细胞凋亡,而过表达Corin后细胞活力明显升高,凋亡率降低。这提示过表达Corin对心肌细胞损伤起保护作用。NF-κB是重要的一类核转录因子,是信号传导途径中的枢纽,参与肿瘤、免疫、炎症等的发生发展及调控细胞的增殖、凋亡等过程中基因的表达,其家族成员可与其抑制蛋白IκBs以同源或异源二聚体形式形成复合物,在细胞质中以非活性形式存在,在受到活化因素的刺激后IκBs发生磷酸化,从而引起NF-κB的激活[20-22]。目前多项研究表明NF-κB信号在多种心血管疾病中被激活,如心肌梗死、心室重构等,而抑制NF-κB信号通路可提高心肌细胞活力和降低细胞的凋亡[23,24]。Ki67是一种细胞增殖抗原,可以作为一个细胞增殖活性检测的重要指标,目前在包括心肌细胞等的研究中广泛应用[25]。p53是一个凋亡促进基因,研究显示,在心肌缺血再灌注损伤、心肌梗死等心血管损伤疾病中p53表达升高,且可诱导心肌细胞的凋亡。本研究检测到H2O2刺激可明显上调p53和NF-κB表达,下调ki67和IκBα表达,过表达Corin后p53和NF-κB表达降低,ki67和IκBα表达升高,加入NF-κB信号通路抑制剂后对p53、NF-κB、ki67和IκBα表达影响更明显,且加入NF-κB信号通路抑制剂可明显提高心肌细胞活力和降低细胞凋亡。这提示H2O2刺激可激活NF-κB信号通路,通过下调ki67和上调p53对心肌细胞造成损伤,而过表达Corin可通过抑制NF-κB信号通路降低这一效应。
综上所述,过表达Corin可通过抑制NF-κB信号通路提高心肌细胞活力及降低细胞凋亡。对细胞活力及凋亡的影响方式是上调ki67表达和下调p53表达。该研究为Corin在心血管疾病中的作用研究奠定了一定的基础,可能为心血管疾病的分子靶向治疗提供了一定的理论基础。
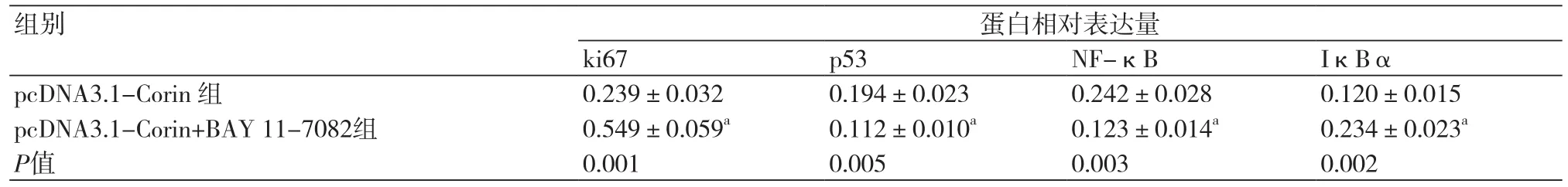
表5 两组细胞中ki67、p53、NF-κB 和IκBα的蛋白相对表达量
