高血压合并冠心病患者PCI后外周血TLR2、TLR4、TNF-α、IL-1β的表达及意义
2018-11-09汪琦崔传义李屏胡娜喻小琛
汪琦,崔传义,李屏,胡娜,喻小琛
高血压是人类最常见的慢性病之一。据统计,世界25岁以上人口中有40%患有高血压[1,2],中国2015年高血压患病率高达27.9%。高血压同时是冠状动脉粥样硬化性心脏病(冠心病)最主要的危险因素,高血压患者罹患冠心病的风险比非高血压患者高出4倍。高血压可加速冠状动脉粥样硬化过程,由于冠状动脉在高血压的长期刺激下内皮和基底膜出现损伤,血管内膜平滑肌细胞、胶原弹力纤维增生,进而造成官腔狭窄、闭塞[3]。研究发现[4,5],体内炎症因子水平异常与冠心病的发生有着直接关系。Toll样受体(TLRs)是重要的模式识别受体,可特异识别病原体,激发早期免疫反应。TLRs活化后,可引起细胞分泌多种免疫相关细胞因子,其中肿瘤坏死因子-α(TNF-α)、白介素-1β(IL-1β)为早期炎症反应最主要的促炎因子,在冠心病炎症反应中发挥重要作用。经皮冠状动脉介入术(PCI)是目前临床治疗冠心病最常用的手段[6]。本研究就高血压合并冠心病患者在PCI后外周血中TLR2、TLR4、TNF-α和IL-1β的水平变化进行观察,并探究其临床意义。
1 资料与方法
1.1 研究对象与分组连续入选2016年3月~2017年8月于孝感市中心医院心血管内科行PCI治疗的90例冠心病患者,其中男性59例,女性31例,年龄35~80(60.85±13.2)岁,包括50例高血压合并冠心病患者(高血压合并冠心病组)和40例单纯冠心病患者(单纯冠心病组)。冠心病诊断标准:根据冠状动脉造影结果,心脏外膜下至少1支血管直径狭窄≥50%[7]。高血压诊断标准参考《中国高血压基层管理指南(2014年修订版)》[8],静息状态下收缩压≥140 mmHg和(或)舒张压≥90 mmHg(1 mmHg=0.133kPa)。所选病例均排除脑血管疾病、血液系统疾病、急性感染、严重肝肾疾病等。另选择同期于本院体检年龄相仿的40例身体健康者作为对照组,其中男性25例,女性15例,年龄36~80(61.7±13.4)岁。所有受试者均签署知情同意书,本研究经医院伦理委员会审核批准。
1.2 方法
1.2.1 治疗方法按照医学伦理原则,冠心病患者均给予阿司匹林、β受体阻滞剂、硝酸酯类药物等治疗,在PCI前1 d均给予100 mg/d阿司匹林(规格:0.3 g,批准文号:国药准字H13022944,河北常山生化药业股份有限公司)和75 mg/d氯吡格雷(规格:75 mg,批准文号:国药准字H20123116,乐普药业股份有限公司)。利用Judkins法进行冠脉造影。按照冠状动脉造影结果,行选择性PCI。PCI前后高血压合并冠心病患者均给予常规降压治疗。
1.2.2 资料收集与血液采集包括性别、年龄、身高、体重、吸烟史、饮酒史、职业、高血压年限、既往是否用药等。受试者在PCI治疗前和治疗后7 d空腹采集6 ml肘静脉血液,离心后取上清,于-80℃冰箱中保存备用。
1.2.3 外周血TLR2和TLR4 mRNA水平检测利用Trizol法提取RNA,电泳检测完整性,紫外分光光度计检测纯度及浓度。取1.0 μg总RNA用反转录试剂盒(宝生物工程大连有限公司)逆转录成cDNA。取5 μl cDNA为模板,加入10 μl 2×SYBR Green qPCR Super Mix、0.5 μl TLR2(或TLR4)上下游引物,接着加入4 μl ddH2O至总体积为20 μl,在实时荧光定量PCR仪(美国Beckman Couhe公司)上扩增。反应条件:95℃预变性30 s;95℃ 5 s,60℃ 35 s,扩增40个循环。选择β-actin为内参基因,实验进行3次生物学重复。采用2-ΔΔCT法分析RT-qPCR结果,ΔCT=(CT目的基因 - CTβ-actin)±SD,ΔΔCT =(ΔCT目的基因 - ΔCTβ-actin)±SD。
1.2.4 外周血TNF-α和IL-1β蛋白表达水平检测
用ELISA试剂盒(上海酶联生物科技有限公司)测定患者血清中TNF-α和IL-1β蛋白表达水平。向反应板各孔中加入100 μl待测样品,混匀,37℃孵育2 h;反应板洗涤、吸干后,加入100 μl一抗稀释液,混匀,37℃孵育1 h;反应板洗涤、吸干后,加入100 μl酶标抗体稀释液,混匀,37℃孵育30 min;反应板洗涤、吸干后,加入100 μl终止液,混匀,在30 min内用酶标仪(北京伯辉生物科技有限公司)测定450 nm处吸光度。
1.3 统计学分析所有数据均采用SPSS 20.0统计学软件分析,计量资料采用均数±标准差(±s)表示,多组间比较采用单因素方差分析,两两比较采用t检验,计数资料采用例数(构成比)表示,组间比较采用χ2检验;利用Pearson进行相关性分析。P<0.05为差异有统计学意义。
2 结果
2.1 三组基线资料比较三组受试者的性别、年龄之间的差异无统计学意义(P>0.05);单纯冠心病组、高血压合并冠心病组的体质指数均显著高于对照组,高血压合并冠心病组有吸烟史的人数、有饮酒史的人数均显著高于对照组,高血压合并冠心病组的收缩压、舒张压均显著高于对照组和单纯冠心病组(P均<0.05)(表1)。
2.2 PCI前后外周血TLR2和TLR4 mRNA水平变化PCI前,单纯冠心病组、高血压合并冠心病组外周血TLR2和TLR4 mRNA水平均显著高于对照组,高血压合并冠心病组外周血TLR2和TLR4 mRNA水平均显著高于单纯冠心病组(P均<0.05);PCI后,高血压合并冠心病组外周血TLR2 mRNA水平仍显著高于对照组(P<0.05)。单纯冠心病组PCI后外周血TLR2、TLR4 mRNA水平与PCI前之间的差异不具有统计学意义(P>0.05);高血压合并冠心病组PCI后外周血TLR2和TLR4 mRNA水平显著低于PCI前(P<0.05)(表2)。
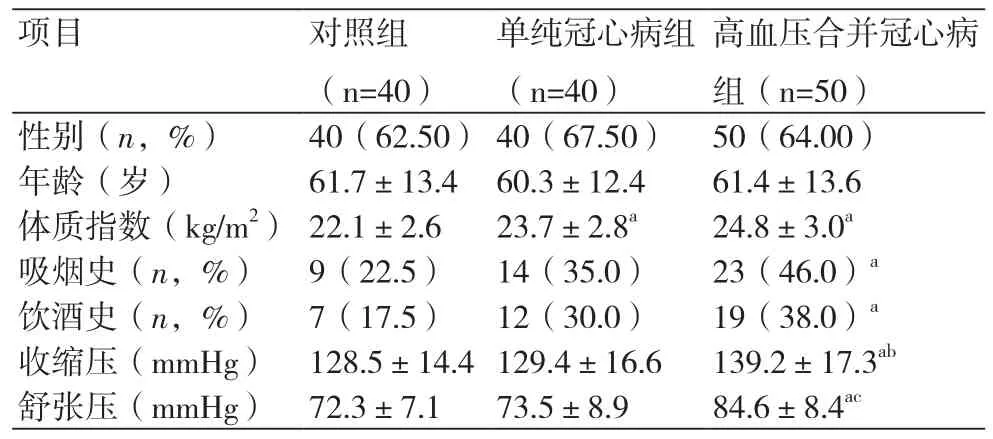
表1 三组基线资料比较
2.3 PCI前后外周血TNF-α和IL-1β蛋白水平变化PCI前,单纯冠心病组、高血压合并冠心病组外周血TNF-α和IL-1β蛋白水平均显著高于对照组,高血压合并冠心病组外周血TNF-α和IL-1β蛋白水平均显著高于单纯冠心病组(P均<0.05);PCI后,单纯冠心病组、高血压合并冠心病组外周血TNF-α和IL-1β蛋白水平显著降低(P<0.05),但仍高于对照组(P<0.05)(表3)。
2.4 外周血TLR2、TLR4、TNF-α和IL-1β表达的相关性PCI前后,外周血TLR2、TLR4、TNF-α和IL-1β表达水平均显著呈正相关关系(P均<0.05)(表4~5)。
表2 PCI前后外周血TLR2和TLR4 mRNA水平变化(±s)

表2 PCI前后外周血TLR2和TLR4 mRNA水平变化(±s)
注:与同组术前比较,aP<0.05;与对照组比较,bP<0.05;与单纯冠心病组比较,cP<0.05
组别 对照组(n=40) 单纯冠心病组(n=40) 高血压合并冠心病组(n=50)术前 术后 术前 术后 术前 术后TLR2 4.85±1.34 4.82±1.26 5.58±1.58b 5.14±1.46 6.27±1.66bc 5.46±1.63ab TLR4 5.07±1.42 5.10±1.45 6.14±1.81b 5.47±1.56 6.93±1.86bc 5.68±1.64a
表3 PCI前后外周血TNF-α和IL-1β蛋白水平变化( ±s,ng/L)

表3 PCI前后外周血TNF-α和IL-1β蛋白水平变化( ±s,ng/L)
注:IL-1β:白介素-1β;与同组术前比较,aP<0.05;与对照组比较,bP<0.05;与单纯冠心病组比较,cP<0.05
组别 对照组(n=40) 单纯冠心病组(n=40) 高血压合并冠心病组(n=50)术前 术后 术前 术后 术前 术后TNF-α 18.21±1.27 18.55±1.32 52.34±14.86b 28.58±4.29ab 61.25±18.34bc 30.49±5.62ab IL-1β 12.74±1.05 12.68±0.96 23.52±6.85b 20.17±5.27ab 26.98±7.50bc 21.25±6.28ab
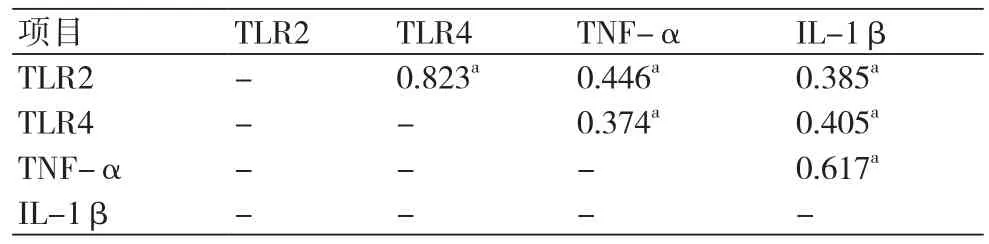
表4 PCI前外周血TLR2、TLR4、TNF-α和IL-1β表达的相关系数
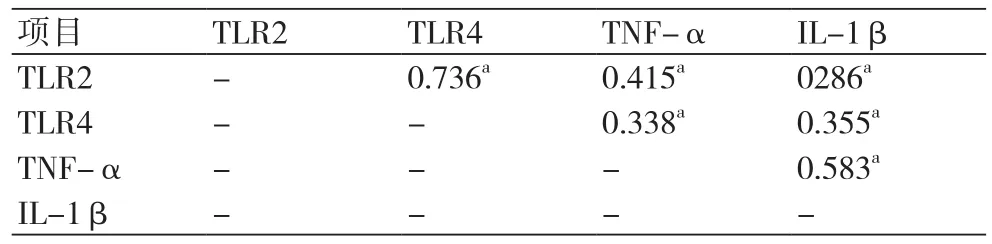
表5 PCI后外周血TLR2、TLR4、TNF-α和IL-1β表达的相关系数
3 讨论
高血压是各种心脑血管疾病的重要危险因素,也是心血管疾病相关死亡的主要原因[9]。冠心病是指由冠状动脉粥样硬化造成的血管管腔狭窄、阻塞或(和)冠状动脉痉挛使心肌缺血缺氧而导致的心脏病[10]。有关研究发现[11-13],高血压患者由于心脏长期处于高负荷状态,导致发生冠心病的风险明显增加,冠心病患者若合并高血压可导致冠状动脉粥样硬化过程加速,高血压引起的微血管病变导致冠状动脉储备量降低,进而加剧大冠状动脉血管狭窄,最终造成心肌缺血。PCI是通过心导管技术使狭窄的冠状动脉管腔重新开放,从而达到改善心肌血流灌注的目的,是目前心内科广泛使用的治疗手段,但对于冠心病患者尤其是合并高血压的患者有很大的复发风险[14]。因此,探究高血压合并冠心病的发病机制,对患者的临床针对性治疗至关重要。
本研究发现,PCI治疗前高血压合并冠心病组外周血TLR2、TLR4 mRNA水平均显著高于对照组和单纯冠心病组,说明冠心病患者外周血TLR2、TLR4 mRNA的表达显著上调,出现血管炎症反应,而高血压可进一步加剧该过程。而PCI治疗后,高血压合并冠心病组外周血TLR2、TLR4 mRNA水平均显著降低,但TLR2 mRNA水平仍显著高于对照组,说明PCI治疗可明显缓解冠心病患者血管炎症反应。其中TLRs最早在果蝇体内发现,作为一种模式识别受体,既能调节先天性免疫又能调节获得性免疫,发挥着抵抗微生物感染与识别内源性配体的功能[15]。TLR2、TLR4在高血压和冠心病的发病过程中起着关键作用,主要在单核细胞、淋巴细胞、肥大细胞、骨髓树突状细胞等免疫细胞上表达,启动高血压引起的血管内皮损伤处和冠状动脉粥样硬化斑块处的炎症反应。TLR2、TLR4与自身配体结合后形成二聚体,进而招募接头蛋白,启动下游一系列炎症反应。免疫细胞合成TLR2、TLR4后,经信号转导,可激活核因子-κB(NF-κB)进入细胞核内,诱导细胞产生炎性因子如TNF-α、IL-1β等[16,17]。
本研究结果还显示,PCI治疗前高血压合并冠心病组外周血TNF-α、IL-1β蛋白水平均显著高于对照组和单纯冠心病组,说明冠心病患者外周血TNF-α、IL-1β蛋白表达显著上调,进一步体现出冠心病患者出现血管炎症反应,而高血压对该过程起着促进作用。PCI后,单纯冠心病组、高血压合并冠心病组外周血TNF-α和IL-1β蛋白水平显著降低,但仍高于对照组,说明PCI治疗对冠心病患者血管炎症反应起着明显的缓解作用,但不能完全消除,患者有复发的风险。TNF-α是生物体内重要的多向性细胞炎性因子,与冠心病的多种临床症状有着直接的关系。TNF-α可促进高血压患者体内肌动蛋白、肌球蛋白的合成,并能使其分解速率降低,引起心肌细胞总量减少、左心肌肥厚等心肌功能异常,最终造成冠心病的发生[6,18]。IL-1β主要由巨噬细胞合成并分泌,其能够诱导心肌细胞结构和功能发生变化,使心肌纤维化过程加速,同时促进心肌细胞合成一氧化氮(NO)酶,而NO酶的高水平可使β肾上腺素对心肌细胞的正向效应显著减弱,导致心肌组织因缺氧而受损[19,20]。
综上所述,本研究发现PCI前冠心病患者外周血TLR2、TLR4、TNF-α和IL-1β表达量较身体健康者显著增加,在合并高血压患者的外周血中增加量更大,PCI后降低,说明冠心病的发生与TLR信号通路活化密切相关,而高血压对该过程起着促进作用。然而高血压合并冠心病发病因素很多,其机制需进一步的探究。
