单质粒哺乳动物单杂交系统的构建及功能评价
2018-11-06林木贵程亚丽林梅西
陈 凡,林木贵,程亚丽,林梅西
(1. 福州大学材料科学与工程学院,福建 福州 350116; 2. 福建省闽中有机食品有限公司,福建 莆田 351100; 3. 闽南师范大学生物科学与技术学院,福建 漳州 363000)
0 引言
核受体超家族是一类配体依赖性转录因子,它在生物体内广泛分布,是多细胞生物体内含量最丰富的几大类转录因子超家族成员之一[1-3]. 核受体可以识别并结合特定的应答元件,最终实现对靶基因的转录调控. 在体内,其活性可被相应的配体小分子调节,进而参与调控细胞内几乎所有的生物学过程. 故核受体自身或受其调控基因的异常表达就成为了引发肿瘤在内等多种疾病的重要因素之一[4-7].
为了快速评价核受体的功能并进行潜在配体的筛选,哺乳动物单杂交系统(也称GAL4嵌合受体检测)被成功构建并取得快速发展,作为细胞层面的转录激活测定系统,它已广泛应用于核受体激动剂/拮抗剂的检测与分析研究中[8-12]. 该技术将核受体的配体结合域(LBD)连接于酵母GAL4转录因子的DNA结合域(DBD)之后,形成GAL4-NR-LBD融合蛋白表达序列. 再将融合蛋白表达质粒与含有GAL4特异性响应元件的报告基因质粒共同转染细胞,最终通过对报告蛋白(多为荧光素酶)活性的测定,表征融合蛋白的激活程度. 为了排除无关因素的干扰,降低实验误差,常用的单杂交质粒系统中往往还携带有组成型表达的报告蛋白序列作为内参,减少细胞数量、细胞健康程度、转染效率和非特异性细胞反应的影响,使主报告基因的结果归一化 . 因此该技术具有速度快、成本低和实验数据完全量化的特点,对结果的分析和比较极为有利.
但该系统在使用中并非全然无虞,传统单杂交系统需要向供试细胞株转染至少两种质粒(分别表达融合蛋白和报告蛋白). 一方面,质粒的提取和保存过程容易因质粒质量差异(如断裂和内毒素残留等)带来实验误差. 另一方面,双质粒共转细胞时也可能存在转染和表达效率差异,必须通过转染条件的优化予以弥补. 相比单质粒转染,双质粒共转系统无疑具有更多的不确定性,最终对实验结果的重现性产生一定影响. 因此,本研究通过克隆pG5luc载体中的Gal4结合位点及下游萤火虫荧光素酶基因,并将其插入pBind载体内,实现两种质粒的功能融合. 而后利用HEK 293T细胞,以RXRα等6种核受体为基础对融合质粒进行功能测试和评价.
1 材料与方法
1.1 菌种与细胞株
感受态细胞Trans5α(E.coliDH5α)购于北京全式金生物技术有限公司,载体与片段酶切连接后按说明书所述步骤进行转化. 人胚肾细胞HEK 293T购于中国科学院典型培养物保藏委员会细胞库,细胞培养使用添加10%(体积分数)胎牛血清的DMEM培养液进行.
1.2 工具酶与试剂
FastPfu Fly DNA聚合酶,FlyCutBglII、BamHI、SalI、NotI限制性内切酶,T4 DNA连接酶,均购于北京全式金生物技术有限公司; pBind、pG5luc质粒、双荧光素酶报告基因检测试剂盒购于Promega公司; TurboFect转染试剂购于Thermo Fisher公司; UNIQ-500无内毒素质粒大量提取试剂盒、SanPrep柱式质粒DNA小量抽提试剂盒及4S Red Plus核酸染色剂购于生工生物工程(上海)股份有限公司; DMEM培养液、胎牛血清均为HyCloneTM品牌. 引物合成和质粒测序委托生工生物工程(上海)股份有限公司进行. 核受体cDNA文库、各类激动剂/拮抗剂由厦门大学药学院张晓坤教授课题组馈赠.
1.3 单杂交质粒系统的构建
通过如表1所示不同的引物组合(引物中的BamHI酶切位点以下划线形式标出),将pG5luc载体(见图1(a))中的GAL4结合序列(简称“G”)、萤火虫荧光素酶基因(简称“F”)连同位于二者上下游的两个调控序列(上游调控序列,简称“U”; 下游调控序列,简称“S”)分别扩增,形成不同长度的调控与功能序列组合,以BamHI酶切后连接至pBind载体(见图1(b))中的BglII酶切位点处(BamHI与BglII为同尾酶). 为便于活性比较,转化后仅筛选连接后正向引物靠近pBR3322位点而反向引物靠近CMV启动子位点的转化子做进一步测序及后续研究.

表1 质粒改造使用的引物及序列表
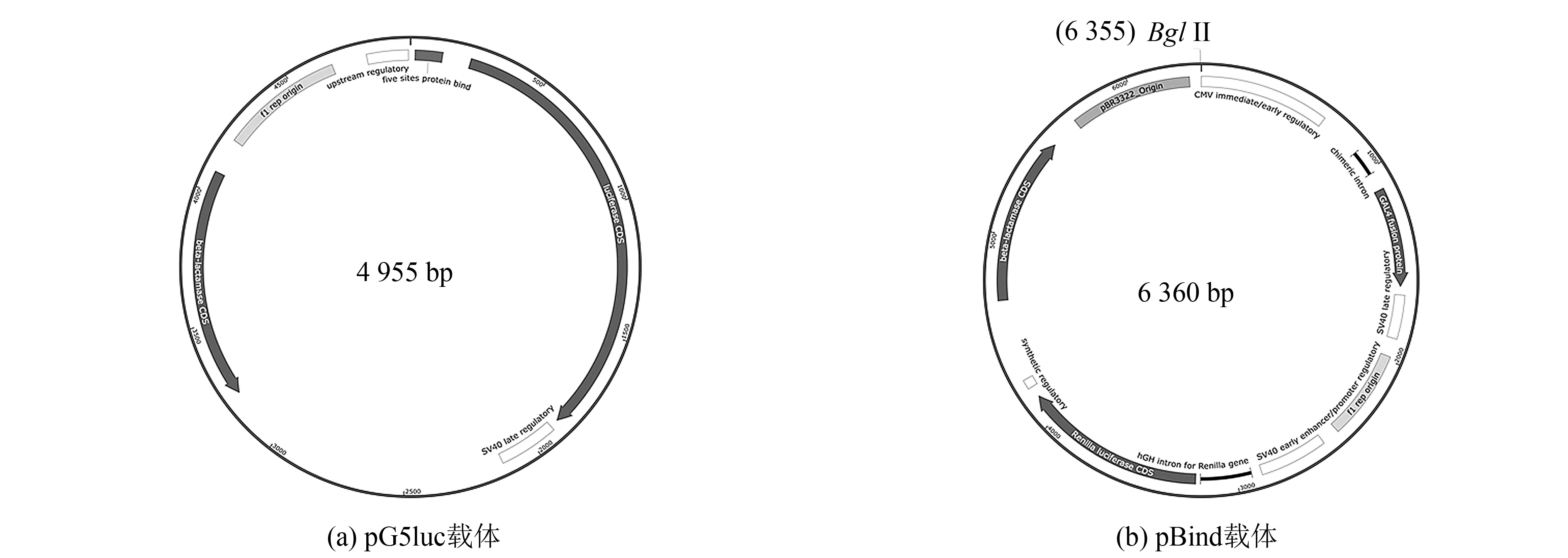
图1 载体结构示意图Fig.1 Schematic representation of vectors
1.4 融合蛋白表达质粒的构建
根据NCBI的检索信息,设计引物从cDNA文库中分别扩增RARα-LBD(E186-N416)、RXRα-LBD(T223-T462)、ERα-LBD(L310-H547)、GRα-LBD(T531-K777)、PPARγ-LBD(A237-L504)、Nur77-LBD(P361-F598)和LXRα-LBD(G167-V400)的DNA序列,经SalI和NotI双酶切后连接至载体的多克隆位点,经测序确认无误后予以保存以供后续转染检测.
1.5 细胞转染
为尽量减少细胞聚集生长对实验结果的影响,研究使用48孔板作为报告基因实验载体. 实验前每孔接种量约为1.2×105个细胞,培养约24 h,待细胞融合度达到60%~70%后, 使用转染试剂并按说明书要求进行转染操作. 鉴于研究中各核受体LBD区长度差别不大,对构建后质粒的总长度影响较小,故确定双质粒单杂交体系转染量为每孔80 ng[13](pBind-NR-LBD: 40 ng,pG5luc: 40 ng),单质粒体系每孔转染量为100 ng.
1.6 荧光素酶活性检测
于细胞转染24 h后更换培养液,并根据实验需要添加核受体对应的激动剂(ATRA: 0.1 μmol·L-1,ROS: 10 μmol·L-1,T09: 1 μmol·L-1,PPT: 10 μmol·L-1,DEX: 1 μmol·L-1,CD3254: 0.1 μmol·L-1)及拮抗剂(UVI3003: 0.5 μmol·L-1)后继续培养18 h,最终裂解细胞,并使用多功能酶标仪(TECAN Infinite©M200 Pro)及双荧光素酶检测试剂盒测定报告基因读数.
1.7 不同单杂交体系的变异系数(CV)比较
分别在同一天(重复6次操作)和连续6周(每周复苏、培养细胞后检测一次)进行双质粒和单质粒系统下Nur77-LBD的活性检测. 模拟多次实验操作的结果,对每组每次实验结果的CV值进行统计分析,比较两种单杂交系统在实验精密度和重现性上的区别.
1.8 统计学处理
所有数据使用Minitab v17.0软件进行方差分析和多重比较. 各图中无共享字符的两组均表示差异具有统计学意义(P<0.05).
2 实验结果与分析
2.1 功能融合质粒的构建与基本功能测试
分别使用pG5luc-U-F/pG5luc-S-R、pG5luc-U-F/pG5luc-F-R、pG5luc-G-F/pG5luc-S-R、pG5luc-G-F/pG5luc-F-R等4对引物组合对pG5luc载体序列进行扩增,通过酶切连接后获得pBind-UGFS(8 667 bp,简称“UGFS”)、pBind-UGF(8 404 bp,简称“UGF”)、pBind-GFS(8 506 bp,简称“GFS”)及pBind-GF(8 243 bp,简称“GF”)等4种功能融合质粒,随后进行测序验证. 在插入序列完全正确的情况下,将核受体RXRα的LBD表达序列克隆到质粒的MCS位点,并对4种融合质粒的荧光素酶本底信号进行初步评价,结果如图2所示. 由图2可知,与非融合质粒组合(pBind-RXRα-LBD + pG5luc)相比,除GFS-RXRα-LBD外,其余3种质粒本底值均较非融合质粒组更低. GFS-RXRα-LBD由于不携带上游调控序列,因此难免受上游潜在启动子序列的影响,出现荧光素酶活性“泄露”现象,带来较高的本底数值.
基于RXRα-LBD的不同类型质粒激活倍数(激活后的读数/质粒本底读数)检测,结果如图3所示. 由图3中数据可知,UGFS-RXRα-LBD的激活效果与“pBind-RXRα-LBD + pG5luc”组合的效果最为接近(约为两质粒组合的80%),与“UGF”、“GFS”及“GF”3种质粒的激活倍数存在显著区别. 究其原因,“UGF”质粒由于去除了下游调控序列,可能降低了荧光素酶mRNA的稳定性,此情况下,即使该质粒本底激活较低,也无法得到较高的激活倍数. 对“GFS”质粒而言,由于去除了上游调控序列,导致荧光素酶本底活性较高,故最终也无法观察到理想的激活倍数. 而“GF”质粒虽然去除了全部的调控序列,表现出较低的本底值,但和“UGF”序列类似, 由于没有下游调控序列的存在,导致其mRNA稳定性较低,最终激活程度只能维持在较低水平. 当向检测体系中同时添加激动剂和拮抗剂时,各质粒系统下的荧光素酶活性均显著降低,其下调程度约为60%~80%. 总体而言,质粒系统激活倍数越低,则对拮抗剂的影响越为敏感.
综合分析图2、3的结果,可以认为UGFS系统是传统双质粒系统较好的替代者,其针对激动剂和拮抗剂的响应与双质粒系统最为接近. 故课题组选用UGFS系统作为后续研究的基础.

图2 不同类型质粒的本底荧光素酶活性比较(n=4)Fig.2 Basal luciferase activity of different plasmid systems (n=4)

图3 基于RXRα-LBD的不同类型质粒荧光素酶活性比较(n=4)Fig.3 Comparison of luciferase activity induced by different plasmid systems based on RXRα-LBD (n=4)
2.2 不同核受体在UGFS系统下的激活效果
为验证UGFS质粒是否适用于RXRα以外其它核受体的单杂交检测,课题组进一步构建了UGFS-ERα-LBD、UGFS-GRα-LBD、UGFS-RARα-LBD、UGFS-PPARγ-LBD和UGFS-LXRα-LBD等携带5种不同核受体LBD序列的质粒,与UGFS-RXRα-LBD一同进行了转染及相关检测,检测结果如图4所示. 根据核受体的类型不同, 6种LBD的激活倍数在8~36之间,Z因子均大于0.6,已经能够满足常规检测的需要,可以用于筛选特定核受体的激动剂或拮抗剂.
2.3 UGFS系统实验精密度测试
在细胞转染时,单独转染一种质粒理论上比同时转染两种质粒更容易得到精确而稳定的结果. 为了验证单独转染UGFS质粒是否在实验精密度和重复性上优于传统“pBind + pG5luc”体系,课题组构建了pBind-Nur77-LBD与UGFS-Nur77-LBD质粒. 由于Nur77-LBD具有自激活的特性,可以在不加入任何配体的情况下自行发挥活性[13],故其活性的产生仅与细胞状态和转染效率有关,排除了配体浓度的影响,适合进行实验精密度测试,这一环节的实验结果如图5所示. 相对传统体系而言,UGFS系统由于减少了所需转染的质粒种类,更能够取得精确且重复性强的数据. 此外,不论何种重复方式,UGFS质粒的CV值均保持在低而稳定的水平,和双质粒体系相比,单质粒转染能够明显提高实验精度,有助于获得更为可靠的实验数据.

图4 UGFS系统下不同核受体的激活效果比较(n=4)Fig.4 Comparison of activation effect between different nuclear receptors under UGFS system (n=4)

图5 不同质粒体系在实验中的精密度比较(n=6)Fig.5 CV comparison of different plasmid systems (n=6)
3 讨论
哺乳动物单杂交技术是核受体激动剂/拮抗剂筛选的重要手段,由于利用了存在于酵母菌内,而非哺乳动物细胞内的GAL4转录因子调控体系,充分保证了作为报告蛋白的荧光素酶分子只能在外源嵌合受体的作用下得到表达,有效排除了细胞内源受体或其它相关物质的干扰,因此具有较高的信噪比和理想的实验重现性.
本研究在pBind载体的基础上通过融入pG5luc载体的部分序列建立了pBind-UGFS哺乳动物单杂交质粒系统,使用该质粒转染HEK 293T细胞后,经检验所得数据与双质粒系统较为接近,其激活效率可达双质粒系统的80%以上(不同核受体种类略有区别),且经鉴定单质粒系统的实验数据重现性明显优于双质粒系统. 但值得注意的是:
1) 本研究所建立的UGFS质粒系统在转染量为100 ng/孔(48孔板)时,转染量及信号强度达最佳平衡,再行提高转染量并不能显著提高数据质量,且可能因为转染试剂的细胞毒性影响最终结果的稳定[14]. 因此,若实际操作中采用相同条件,则可直接参考本研究的结果; 若实验条件不同,由于质粒的转染受转染试剂、细胞种类及培养条件(培养液种类、细胞数量、培养时间等)的影响较大,则建议重新摸索最佳转染量,以求获得更为稳定可靠的结论.
2) 本研究所用的pBind载体自身长度为6 360 bp,添加UGFS序列后,质粒全长8 657 bp,若再将其它核受体的LBD区插入该载体,则质粒全长可上升至9 500 bp左右,其转染效率可能显著降低[15-16]. 实际实验过程中,pBind-UGFS质粒虽然能够保证核受体LBD与荧光素酶基因达到最佳的“1/1”比例转染[17],但仍可能因为转染效率的下降,导致整体检测灵敏度降低,最终影响所得结果. 因此,针对pBind-UGFS质粒骨架的进一步优化,去除检测的非必需序列仍是亟待解决的问题. 此外,随着近年来新的荧光素酶蛋白不断被发现[18-21],将萤火虫荧光素酶或pBind载体中的海肾荧光素酶(参比基因)替换为序列更短、化学发光活性更高的荧光素酶系统,也是有效减少质粒大小、提高转染效率和检测灵敏度的有效手段,值得进一步深入研究.
致谢: 诚挚感谢闽中有机食品有限公司博士后工作站提供经费和其它支持!
