C臂CT结合X线透视引导下经皮椎体成形术治疗疼痛性上胸椎转移癌
2018-11-06倪才方刘梦瑶李青松
施 斐,倪才方,陈 珑*,刘梦瑶,2,李青松
(1.苏州大学附属第一医院介入科,江苏 苏州 215006;2.苏州大学医学部,江苏 苏州 215006)
经皮椎体成形术(percutaneous vertebroplasty, PVP)主要用于治疗骨质疏松性椎体压缩骨折及疼痛性椎体转移癌,创伤小,并发症少,能快速加固病变椎体并缓解患者疼痛,多用于治疗腰椎及中、下胸椎病变[1-3]。PVP术中最常用的影像学定位及监控方法为X线透视。上胸椎(T1~T4)受胸骨、肱骨头及肩胛骨等结构的遮挡,且周围解剖结构复杂,PVP手术风险相对较大,临床应用受到一定限制[4-6]。C臂CT是基于旋转平板DSA的新型三维重建技术,可提高受检组织的密度分辨率,弥补常规X线透视密度分辨率差的缺点[7-8];将C臂CT与X线透视相结合,可弥补传统CT时间分辨率低、无法动态监控手术过程的不足,近年来逐渐应用于骨关节疾病的介入治疗中[9-11]。本研究分析18例接受C臂CT结合常规X线透视引导下PVP治疗的疼痛性上胸椎转移癌患者的资料,探讨此法治疗疼痛性上胸椎转移癌的安全性、可行性及疗效。
1 资料与方法
1.1一般资料 收集2011年11月—2017年10月于我院接受C臂CT结合常规X线透视引导下PVP治疗的18例(19个椎体)疼痛性上胸椎转移癌患者,男8例,女10例,年龄32~84岁,平均(58.6±13.2)岁;原发病变为肺癌8例,肝癌3例,食管癌、胰腺癌各2例,胃癌、乳腺癌及宫颈癌各1例。所有患者病变椎体处疼痛持续时间均超过1个月,且经包括双磷酸盐骨保护剂、静脉注射阿片类止痛药物在内的保守治疗无效。患者PVP治疗前均经骨外科、肿瘤科及放疗科在内的相关科室多学科会诊,术前均签署知情同意书。
1.2仪器与方法 采用Toshiba INFX-8000V DSA机。嘱患者俯卧于诊疗床上,胸前垫小棉枕,使双上肢尽量紧贴诊断床,以外展双侧肩胛骨。先行病变椎体的C臂CT旋转扫描,管电压100 kV,管电流 300 mA,FOV 30 cm×30 cm,旋转速度15度/秒,帧频 30幅/秒。扫描结束后以Vitrea后处理工作站对病变椎体行MPR、MIP及三维重建。采用经胸肋关节途径穿刺病变椎体,根据C臂CT扫描获得的三维图像,确定皮肤穿刺点、进针角度及深度。常规消毒、铺巾,以1%利多卡因5 ml局部麻醉穿刺部位,按拟定穿刺路径,于透视监控下将穿刺针穿刺至椎体后缘,然后重复C臂CT扫描,根据重建图像调整穿刺针位置。确认穿刺针位置及方向正确后,继续在透视监控下穿刺进针,直至穿刺针位于靶椎体前部的1/3处。穿刺针到位后,先行椎体内静脉造影,观察静脉引流情况;然后在透视监控下注入黏稠状态的骨水泥(Corinplast3),当骨水泥接近椎体后缘或术中发现骨水泥渗漏即停止注射(图1)。注射结束后拔出穿刺针,压迫止血。术后再次行C臂CT扫描了解骨水泥于椎体内沉积情况,记录每个病变椎体的透视时间,接受C臂CT扫描次数,骨水泥用量及有无渗漏,记录并发症发生情况。
1.3术后随访 嘱患者于PVP术前、术后1天、1周、1个月及3个月进行疼痛视觉模拟评分(visual analogue scale, VAS),0分为无痛,10分为最痛。PVP术后3个月的VAS得分较术前降低≥3分为止痛有效。
1.4统计学分析 采用SPSS 17.0统计分析软件。计量资料以±s表示。以可重复检验的方差分析评价患者PVP术前与术后各时间点间VAS评分的差异,两两比较采用LSD法。P<0.05为差异有统计学意义。
2 结果
18例患者共19个病变椎体接受PVP治疗,2个T1,5个T2,3个T3,9个T4,其中1例肺癌患者的2个病变椎体分别为T2和T4。所有患者均完成术后随访,无失访者。
19个病变椎体PVP术中透视时间为10.7~20.1 min,平均(14.76±3.14)min;C臂CT扫描次数为 3~5次,平均(3.32±0.13)次;骨水泥用量为 1.5~4.0 ml,平均(2.66±0.70)ml。共有6个椎体发生无症状的骨水泥渗漏,渗漏率为31.58%(6/19)。无PVP相关并发症发生。
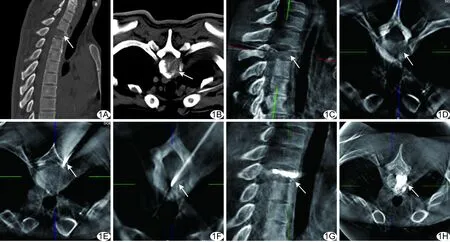
图1 患者男,42岁,肺癌T2椎体转移,接受C臂CT引导下T2椎体成形术 A、B.CT矢状位及轴位图像示T2椎体骨质破坏,椎体压缩变扁(箭); C、D.C臂CT引导下行PVP,于术中C臂CT扫描矢状位及轴位重建图像上定位T2椎体(箭); E、F.穿刺针(箭)达椎体边缘及进入靶椎体后,再次行C臂CT扫描,以确认穿刺针位置; G、H.PVP术后再次复查C臂CT,见骨水泥(箭)沉积良好
术后3个月患者止痛有效率为88.89%(16/18)。接受PVP治疗前及治疗后1天、1周、1个月和3个月,VAS分别为(8.11±0.75)、(2.83±1.25)、(2.55±1.65)、(2.77±1.69)和(3.11±1.81)分,差异有统计学意义(F=45.99,P<0.01);两两比较,PVP术后不同时间点的VAS评分与术前比较差异均有统计学意义(P均<0.05),而术后各时间点间差异均无统计学意义(P均>0.05)。
3 讨论
PVP多用于治疗腰椎及中、下段胸椎骨质疏松性椎体压缩骨折或溶骨性椎体恶性肿瘤[1-3]。上胸椎周围解剖结构复杂,正位X线透视时易受胸骨遮挡,而侧位又受到肩胛骨及肱骨头投影的干扰,难以清晰显示其解剖结构;同时,上胸椎周围毗邻心脏、大血管、食管、气管、肺及胸髓等重要器官,一旦出现穿刺损伤或骨水泥渗漏至椎管压迫胸髓,往往会引起灾难性后果,使PVP治疗上胸椎病变受到一定程度的限制。
目前临床常用的PVP术中影像学引导方法包括常规X线透视和CT引导。X线透视引导的时间分辨率高,可全程实时监控穿刺过程及骨水泥注射,但其密度分辨率低,对周围解剖结构复杂的颈椎、上胸椎等椎体显影不良。CT的密度分辨率高,可清晰显示病变椎体周围解剖结构,但其时间分辨率较低,难以实时监控手术过程,可能增大PVP术中骨水泥渗漏的风险。平板DSA的C臂CT图像后处理功能具有类似CT的密度分辨率,可引导穿刺;当穿刺针顺利穿刺进入靶椎体后,又可利用常规DSA的X线透视功能,实时监控骨水泥在椎体内的弥散及渗漏情况,可较好地弥补常规X线透视及常规CT扫描各自的不足[9-11]。本研究将其用于上胸椎病变介入治疗的定位及监控,本组19个病变椎体全部在C臂CT结合X线透视的引导、监控下完成PVP治疗,无穿刺或有临床症状的骨水泥渗漏相关并发症发生,且术中透视时间为(14.76±3.14)min,与既往研究[1-2]报道相似未明显延长,提示该方法引导下的上胸椎椎体成形术安全、可行。
C臂CT引导上胸椎穿刺一般需行3~5次扫描,本组19个病变椎体平均扫描次数为(3.32±0.13)次。穿刺前先对穿刺靶椎体行C臂CT扫描,根据CT重建图像确认穿刺点、穿刺深度及角度(图1C、1D);按设定穿刺路径穿刺靶椎体,穿刺针抵达椎体后缘骨质后,可再次行C臂CT扫描以判定穿刺针穿刺方向是否正确(图1E),若穿刺针方向正确,可继续根据预定穿刺深度及角度将穿刺针穿刺入椎体内,若穿刺针方向出现偏差,可调整穿刺针方向,再次穿刺;穿刺针进入椎体预定位置后,需再次行C臂CT扫描确认穿刺针位置是否正确(图1F)。在穿刺全程中还可结合常规X线透视,监控穿刺针穿刺方向,尽量降低PVP术中风险。既往研究[12]表明,与传统多排螺旋CT扫描相比,针对颅脑病变行C臂CT扫描并不增加患者的辐射剂量;单个上胸椎的扫描范围小,远小于颅脑扫描范围,因此分析PVP治疗过程中对上胸椎靶椎体行C臂CT扫描并不会大于传统CT扫描的辐射剂量。
行上胸椎PVP时,患者体位也是影响PVP成功与否的因素之一[5]。合适的体位不仅可使患者术中感觉更加舒适,易于配合手术治疗,同时也能更好地显示靶椎体的解剖结构,从而降低手术风险。本研究中,于患者胸部下方加垫小枕,并嘱患者双上肢内旋、紧贴于DSA诊断床,可最大限度将其肩胛骨向两侧展开,从而降低侧位透视时肩胛骨的投影对上胸椎的影响。关于PVP穿刺途径,常规有经椎弓根途径和经肋椎关节途径。上胸椎椎弓根相对细小,经椎弓根途径穿刺易出现穿刺针穿破椎弓根内侧缘,从而引起椎弓根甚至椎管内结构损伤;同时,一旦椎弓根内侧缘骨皮质受到损伤,骨水泥可经破损的椎弓根内侧骨皮质渗漏入椎管内,引起灾难性后果[12-13]。本研究采用经肋椎关节途径穿刺,未出现穿刺相关损伤,亦无骨水泥椎管内渗漏发生。随访结果显示,本组术后3个月的止痛有效率为88.89%(16/18),PVP术后患者VAS评分较术前明显下降,且术后各时间点间的VAS评分无统计学差异,表明PVP在治疗疼痛性上胸椎转移癌时疗效显著且稳定,与PVP在中、下胸椎及腰椎恶性病变治疗中的疗效一致[13-15]。
综上所述,本研究在C臂CT结合X线透视的引导下共对19个疼痛性上胸椎转移癌行PVP治疗,术中未发生手术相关并发症,术后患者疼痛明显缓解,提示C臂CT结合X线透视引导下PVP治疗疼痛性上胸椎转移癌操作安全、方法可行,止痛效果好。
