黄河三角洲自然保护区植被与土壤C、N、P化学计量特征*
2018-11-06刘兴华公彦庆陈为峰黄保华朱荣生
刘兴华, 公彦庆, 陈为峰, 黄保华, 朱荣生
黄河三角洲自然保护区植被与土壤C、N、P化学计量特征*
刘兴华1, 公彦庆2, 陈为峰3**, 黄保华1, 朱荣生1
(1. 山东省农业科学院畜牧兽医研究所 济南 250100; 2. 山东省平邑县环境保护局 临沂 273300; 3. 山东农业大学 泰安 271018)
为阐明黄河三角洲自然保护区生态系统的元素含量水平和化学计量特征并判断该区域植被生长的限制因子, 选择保护区5种典型植物群落翅碱蓬、碱蓬、芦苇、柽柳和白茅为研究对象, 测定植物不同器官和土壤剖面中有机碳、全氮、全磷含量, 分析保护区植物群落与土壤的C、N、P化学计量特征。结果显示: 5种群落中典型植物各器官C和P含量规律大体一致, 除白茅和柽柳外, 均表现为叶>根>茎, 白茅茎的C和P含量高于根。不同植物器官N含量则表现出一致的变化规律, 均为叶>茎>根。各植被类型叶片N∶P值均小于12, 且与根系的N∶P值接近。土壤C、N含量的平均值分别为4.78 g×kg-1、0.32 g×kg-1, 均低于全国水平。P含量的平均值为0.53 g×kg-1, 略低于全国水平。不同土层之间土壤元素含量差异不显著。不同群落土壤C∶N∶P值不同, 同一群落不同土层的土壤C∶N∶P值变异性较小。植物叶片C、N、P含量以及C∶N、C∶P与0~10 cm、10~20 cm、20~40 cm土层土壤C、N含量之间均存在显著的相关关系(<0.05)。以上结果表明, 黄河三角洲自然保护区不同土层土壤C、N、P含量相对稳定, 总体低于全国水平, 土壤N的匮乏引起了C∶N和C∶P值的变化。植物叶片和根系的C∶P值接近, 说明生态系统元素循环相对稳定, 同时叶片N∶P值小于12, 进一步说明土壤中N的匮乏使其成为植物生长的限制因子。
化学计量特征; 养分含量; 植物群落; 土壤; 黄河三角洲
生态化学计量学是物理学、生态学和化学计量学交叉形成的一门学科, 研究生物系统能量平衡和多重化学元素平衡, 为分析植物养分利用的状况以及生态系统物质循环提供重要的手段[1-2], 这一研究领域使生物学科不同层次的研究理论能够有机统一起来[3]。碳(C)、氮(N)、磷(P)是植物生长的主要化学元素, C是构成植物体干物质的最主要元素[4], N、P是各种蛋白质和遗传物质的重要组成元素, C∶N和C∶P反映了植物生长速度[5], 并与植物对土壤N和P的利用效率有关, N∶P可作为对生产力起限制作用的营养元素的指示剂[6]。土壤作为植物生长所需养分的主要来源, 对调节植物生长具有重要作用[7], 植物体根据周围环境的变化, 能够主动调节自身养分需求, 使自身营养元素达到动态平衡。因此, 生态化学计量学的提出为探究植物与土壤之间的C、N、P相关性及植物生长与养分供应的关系提供了有效手段[8]。近年来, 国内外生态化学计量学的研究发展迅速, 相关研究跨越不同时空尺度、涉及不同生态系统类型[1-2]。如中国东部植被叶片中N和P含量与纬度、年均温度间存在显著相关关系, 但与全球尺度比, 我国陆地植物N∶P明显偏低, 说明我国陆地植物相对于其他国家更缺P[9]。通过对内蒙古草原长期检测试验, 从时空尺度充分证明了在应对环境因子变化过程中, 生物体通过调节自身化学计量比达到稳定从而维持生态系统结构和功能的稳定性[10]。国内对这方面的研究较多集中在陆地生态系统, 滨海河口三角洲位于水陆交界处, 土壤养分、水分等相对于陆地具有更大的波动性, 对环境变化更加敏感[11]。受气候变化和人类活动干扰, 其C、N、P化学计量关系的变化, 最终可能会改变生态系统的结构和功能[12-13]。不同物种、生活型间化学计量特征不同, 环境因子影响可能会改变物种的适应机制, 比如, N沉降增加了湖泊的N∶P值, 导致湖泊养分格局发生变化, N沉降量低的区域, 浮游植物生长受氮限制, N沉降高的区域, 则受P的限制[14]。因此, 探讨植物和土壤的化学计量特征, 不仅有助于揭示生态系统不同组分化学计量的趋同与分异, 同时对理解和预测生态系统对全球环境变化的响应具有重要意义[1,15]。
黄河三角洲是世界上暖温带保存最广阔、最完善、最年轻的湿地生态系统, 同时地处海陆变迁最活跃的地带, 是造陆速度最快的河口三角洲[16]。黄河三角洲自然保护区总面积15.3万hm2, 由海到陆依次分布的典型植被主要为翅碱蓬()、碱蓬()、芦苇()、柽柳()、白茅()等群落, 且群落中往往以某一物种占优势, 伴生种分布少, 结构简单[17]。因此, 这些关键的物种与土壤养分化学计量特征可能会影响黄河三角洲自然保护区生态系统的结构、功能与稳定性。目前, 已有众多学者对黄河三角洲典型区域中土壤养分和盐渍化相关的农业及生态系统环境问题做了大量调查研究, 其中包括湿地生态系统的营养元素的地球化学行为[18], 油田地区土壤理化性质[19], 军区生产土壤盐渍化与湿地保护等[20]。但是, 对黄河三角洲自然保护区植被与土壤生态化学计量学特征的研究鲜见报道。黄河三角洲自然保护区土壤受海相沉积和河流冲击的影响会呈现怎样的生态化学计量特征? 植被生长过程中会表现出什么样的特征以适应当地环境? 植被生长过程中受土壤环境的限制因子是什么? 基于上述问题的思考, 本研究对保护区典型植被的根、茎、叶以及土壤不同深度的养分元素含量、元素间化学计量特征进行研究, 以期阐明植被和土壤的生态化学计量特征, 分析保护区植被生长的限制因素, 为正在进行的黄河三角洲自然保护区生态系统的保护和恢复提供借鉴。
1 研究区域概况与研究方法
1.1 研究区域概况
研究区位于黄河三角洲自然保护区内黄河入海口处, 东靠莱州湾, 介于东北亚内陆和江淮平原之间, 118°33′~119°20′E, 37°35′~38°12′N。保护区总面积为15.3万hm2, 属温带大陆性季风气候, 四季分明, 年平均气温11.9 ℃, 年降水量592.2 mm, 多年平均蒸发量为1 944 mm。土壤质地以轻壤土和中壤土为主, 土壤类型以潮土和盐土为主。本试验的研究区域主要以现代海岸线和1976年至今的现代黄河河道为界, 该区域主要优势种有翅碱蓬、碱蓬、芦苇、柽柳、白茅。在黄河堤岸两侧, 芦苇、柽柳、碱蓬和翅碱蓬沿河道向外至高潮线呈带状分布, 各植被带宽度大致为0.3~3.5 km、长度从入海口以上4.0 km沿河道至草场检查站约40 km; 在南部自然保护区, 翅碱蓬、柽柳、芦苇、白茅自黄河堤岸向南呈带条状分布, 各植被带宽度为0.5~5.5 km, 长度为10.0~20.0 km。
1.2 样地选择与试验方法
2013年8月在黄河三角洲自然保护区内现黄河入海口附近区域, 根据植物群落分布和黄河两岸的对称性分布特点, 选择由海向内陆明显的群落系列——翅碱蓬群落、碱蓬群落、芦苇群落、柽柳群落和白茅群落进行GPS定点采样, 具体采样分布及采样点的基本情况如图1和表1所示。
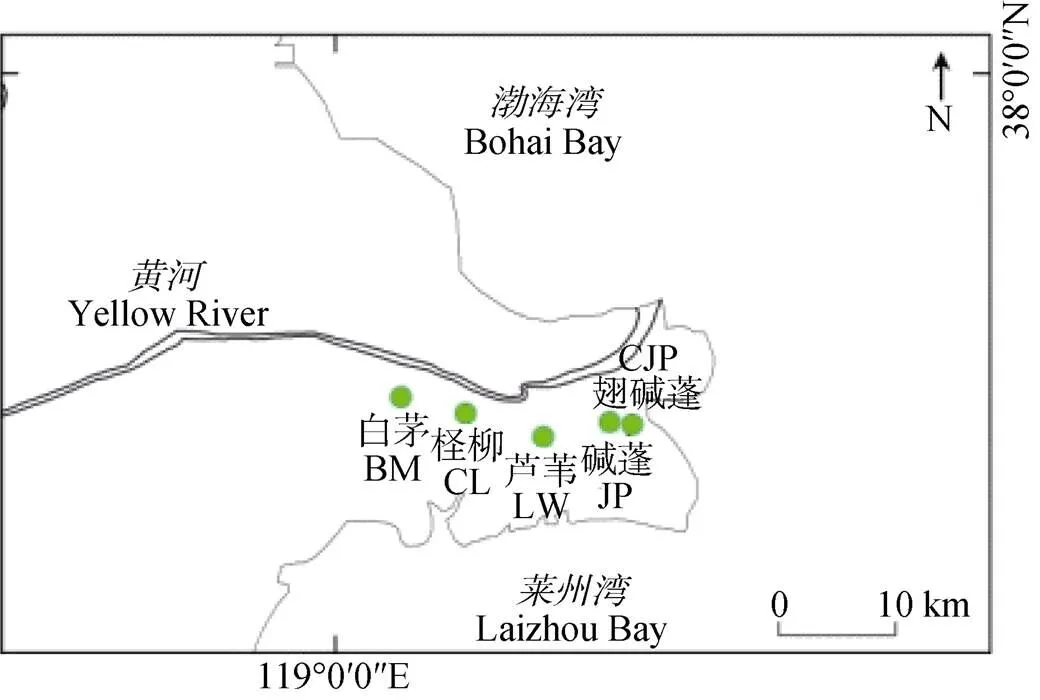
图1 研究区采样点分布图
CJP:, JP:; LW:; CL:; BM:.
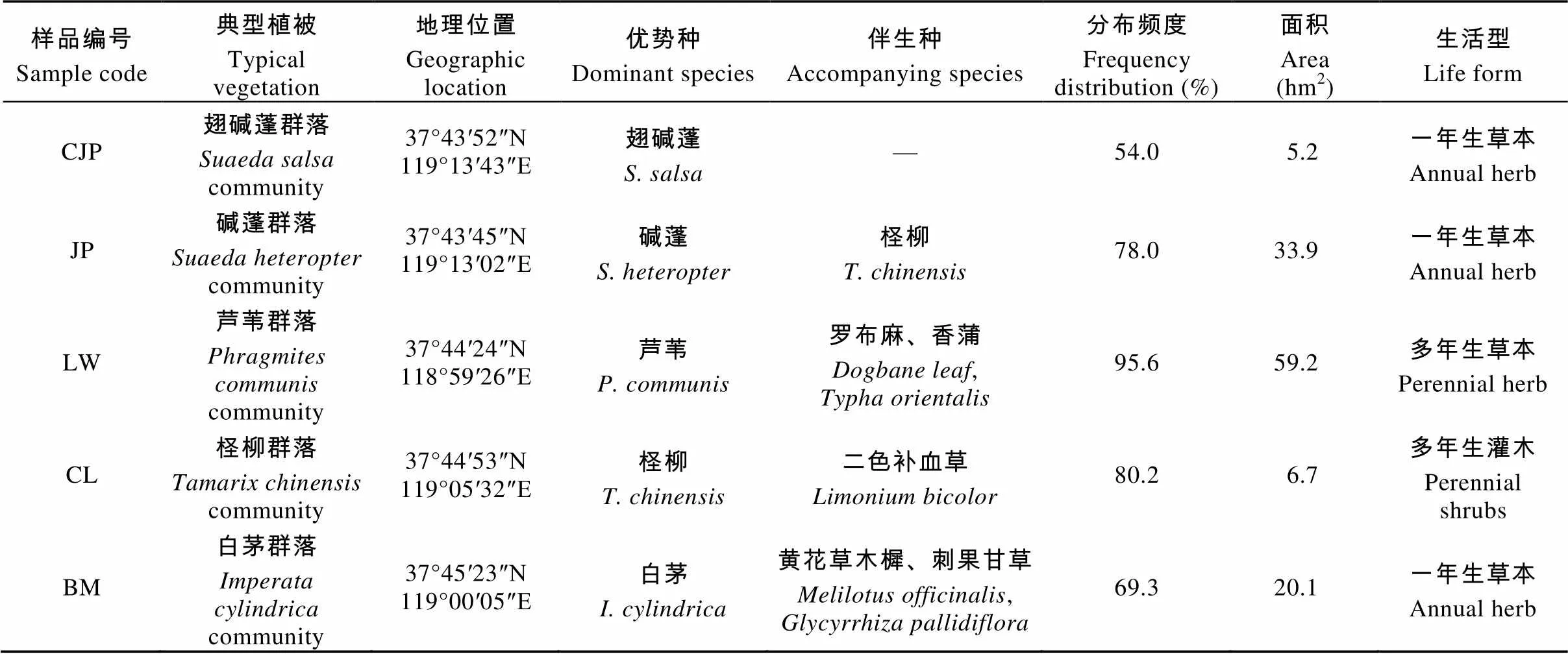
表1 研究区典型植物群落采样点的基本概况
在各群落内选择长势均一的样点, 覆盖度约为80%左右, 每个采样点内选择3个优势种分布均匀的样方, 作为重复, 样方面积1 m×1 m, 翅碱蓬、碱蓬、白茅群落收集样方中所有样品, 对收集到的整株样品分为地上部分和地下部分; 芦苇和柽柳群落由于根系发达, 无法全部收集根系, 故挖取1 m×1 m×1 m区域内的根系。现场清洗收割获得的样品, 分别装入聚乙烯塑料封口袋保存, 带回实验室用自来水清洗后, 蒸馏水清洗2次, 然后105 ℃杀青30 min, 移入80 ℃烘箱中烘干至恒重, 称量获得地上各个构件的生物量。然后粉碎、过0.15 mm筛、装袋, 标号保存备用。
在采集植物的样点用长80 cm、直径10 cm的不锈钢取土器钻取0~60 cm的土壤柱状样品, 并将其分割为4个土层, 分别为0~10 cm、10~20 cm、20~40 cm和40~60 cm, 每个采样点按照S型布点, 四分法取样, 土样装入自封袋, 带回实验室, 放置于阴凉通风处自然晾干, 除去植物根系、碎石等, 分别过2 mm和0.15 mm网筛待测。
土壤总氮、有机碳和植物总氮、碳含量用碳氮元素分析仪(Elementar Vario Micro Cube)测定。土壤和植物总磷含量用浓硫酸-高氯酸消煮-连续流动注射分析仪(AutoAnalyzer Ⅲ)测定。其中, 土壤有机碳含量测定前需要去除无机碳, 即取约1 g样品于玻璃离心管中, 加入5 mL 0.5 mol×L-1的盐酸, 间断性涡旋震荡8 h直至无气泡以充分去除无机碳, 重复2次, 离心倒掉上清液; 再用超纯水离心洗涤多次去除剩余盐酸, 直至洗涤液为中性; 50 ℃烘干后, 待测。各指标在测定时, 均做3次平行, 测量标准偏差均小于0.5%。
1.3 数据处理
用Microsoft Excel、Origin 9.0处理、绘图, 并对植物叶片和土壤元素含量及C、N、P化学计量比之间的相关关系进行分析, 采用Pearson法进行相关关系分析; 用SPSS 13.0统计软件对植物和土壤C、N、P含量及其化学计量比等数据进行单因素方差分析(One-Way ANOVA), 利用LSD检验法检验数据之间的显著性, 并用字母表示, 显著水平为<0.05, 极显著水平为<0.01。
2 结果与分析
2.1 黄河三角洲典型植被群落的生物量
黄河三角洲不同群落植被地上部分生物量(干重)如图2所示, 芦苇群落生物量最高, 达2 744 g×m-2, 其次是白茅群落。翅碱蓬群落地上部生物量最低, 仅为790 g×m-2, 且与柽柳群落地上部分生物量间不存在显著差异, 主要可能由于柽柳群落的优势种柽柳虽是灌木植物, 植株相对高大, 但是其密度远低于翅碱蓬群落。
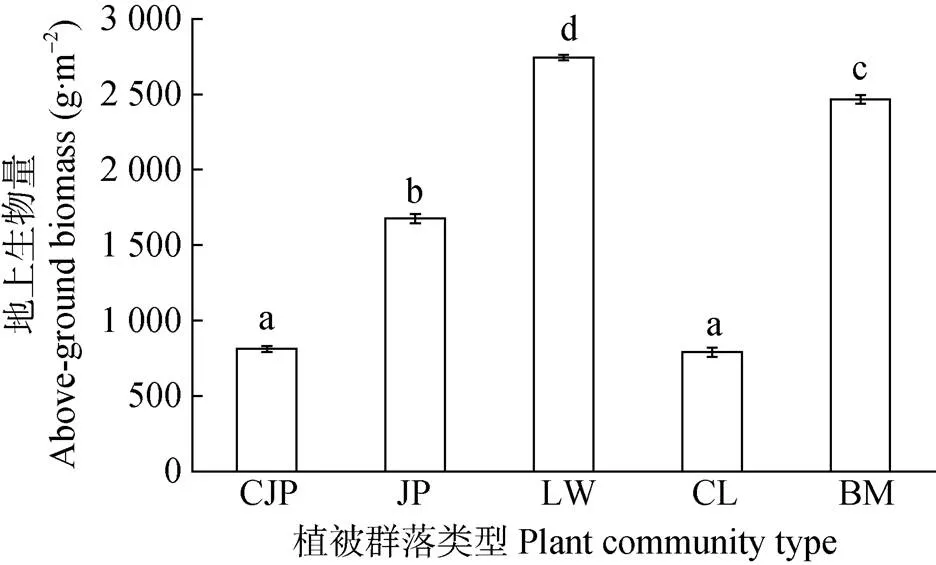
图2 研究区典型植被群落的地上部分生物量
CJP: 翅碱蓬群落; JP: 碱蓬群落; LW: 芦苇群落; CL: 柽柳群落; BM: 白茅群落。图柱上不同小写字母表示不同植被群落间差异显著。CJP:; JP:; LW:; CL:; BM:. Different lowercase letters mean significant differences among different plant communities at 0.05 level.
2.2 典型植被群落优势植物各器官C、N、P元素含量及化学计量特征
不同植物根、茎、叶等器官, 对营养元素的选择吸收与积累强度不同。由图3可知, 研究区不同植物各器官中C和P含量变化规律存在差异, 其中, 翅碱蓬、碱蓬和芦苇均表现为叶>根>茎, 而柽柳和白茅茎的C和P含量高于根。不同植物器官N含量则表现出一致的变化规律, 均为叶>茎>根, 且翅碱蓬、碱蓬、柽柳和白茅根中N的含量显著低于叶和茎, 而芦苇根和茎的N含量显著低于叶。
由海到陆过渡过程中, 除翅碱蓬茎的C含量明显高于碱蓬外, 其他植被群落优势种各器官中C的含量总体呈现增加趋势, 这可能是由于翅碱蓬植株矮小, 茎中也含有大量叶绿素, 可进行光合作用固定CO2, 其C含量与叶片中的C含量无显著差异。随着向内陆延伸, 芦苇、柽柳和白茅的茎和叶片中C含量逐渐增加, 但是根和茎的C含量显著低于叶片; 芦苇、柽柳和白茅的根和叶片中N含量呈降低趋势, 而不同器官中P含量均呈波动趋势。
不同植物各器官的C∶N值变化没有明显的规律性; 翅碱蓬茎的C∶N值显著高于根和叶, 白茅各器官的C∶N值则呈现出与C含量一致的变化趋势, 其他植被茎和叶的C∶N值无显著差异。翅碱蓬和碱蓬茎中的C∶P值高于叶片, 白茅叶片的C∶P值显著高于茎和根, 芦苇和柽柳的根、茎、叶的C∶P值无显著差异。碱蓬和芦苇的茎中N∶P显著高于根和叶片, 且5种植被叶片的N∶P均小于12。
不同植被类型由海到陆过渡过程中不同器官中根和叶片的C∶N值呈现出先增加后降低后又增加的趋势, 茎的C∶N值则表现为先降低后增加的趋势, 叶片中的C∶P值呈逐渐增加的趋势。
2.3 典型植被区土壤C、N、P元素含量及化学计量特征
黄河三角洲不同草本植被类型的土壤有机碳、氮含量表现出一致的变化规律, 即由海到陆呈现出增加的趋势(芦苇地土壤除外), 白茅群落土壤有机碳含量最高, 各层土壤有机碳含量平均值为8.59 g×kg-1, N含量平均值为0.69 g×kg-1, 而灌木柽柳土壤有机碳、氮含量均低于芦苇地。不同植被类型表层土壤有机碳含量最高, 随土层深度增加土壤有机碳含量逐渐降低。各植被土壤表层N含量均高于下层土壤(翅碱蓬除外), 随土层深度变化, 下层土壤N含量变化不显著。不同植被土壤P的含量变幅在0.5~0.75 g×kg-1, 且不同土层之间无显著差异(图4)。
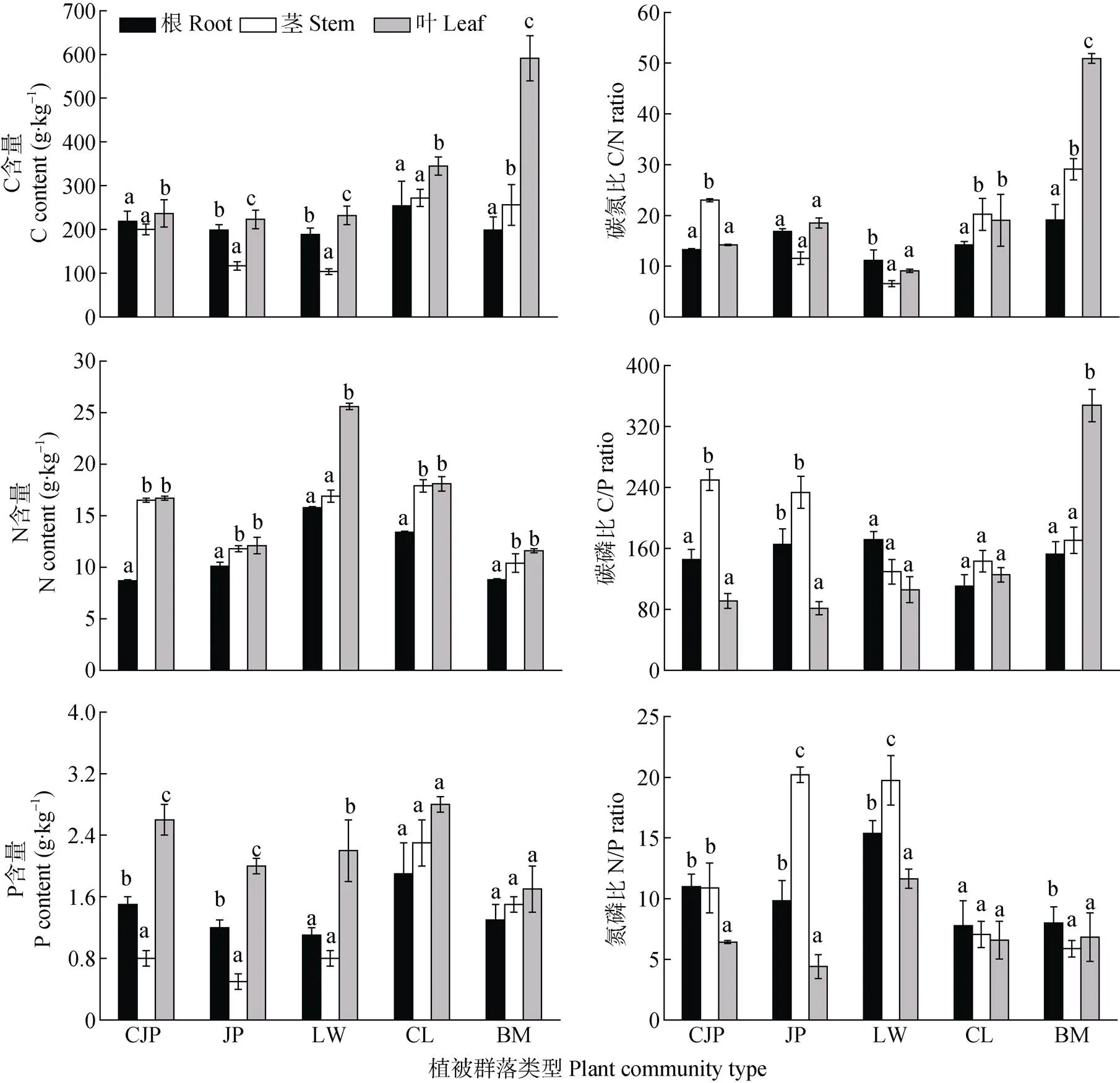
图3 研究区典型植被群落优势种根、茎、叶的C、N、P含量及其化学计量比
CJP: 翅碱蓬群落; JP: 碱蓬群落; LW: 芦苇群落; CL: 柽柳群落; BM: 白茅群落。数据为平均值±标准偏差。同一植被群落不同器官间不同小写字母表示在0.05水平差异显著。CJP:, JP:; LW:; CL:; BM:. Data are mean ± SD. Different lowercase letters within the same plant community mean significant differences among different organs at 0.05 level.
翅碱蓬—碱蓬—芦苇植被过渡过程中土壤C∶N值总体呈降低的变化趋势, 柽柳土壤C∶N值最高, 白茅草甸土壤C∶N值较低。翅碱蓬地表层土壤C∶N值显著高于下层土壤, 碱蓬和柽柳土壤10~20 cm土层的C∶N值显著高于表层, 芦苇和白茅草本植物不同土层土壤C∶N值无显著差异。由海到陆演变过程中土壤C∶P值和N∶P值表现出一致的变化趋势, 即草本植物生长区土壤总体呈现出逐渐增高的趋势, 而柽柳灌木土壤C∶P值和N∶P值低于芦苇地; 翅碱蓬土壤的C∶P值、碱蓬土壤C∶P值和N∶P值表层土壤显著高于下层土壤, 其他植被类型土壤表层土壤与下层土壤C∶P值和N∶P值基本无显著差异(图4)。
2.4 典型植被植物叶片与土壤C、N、P化学计量特征的关系
通过分析植物叶片化学计量学特征与土壤因子的关系, 发现不同土层的土壤C、N、P含量与植物叶片的C、N、P含量及C∶N、C∶P和N∶P的相关关系不同(表2)。总体来讲, 植物叶片C、N、P含量以及C∶N、C∶P与0~10 cm、10~20 cm、20~40 cm土层土壤的C、N含量之间均存在显著的相关关系; 相比叶片C含量及与土壤P含量之间显著的相关性而言, 植物叶片N、P含量及C∶N、C∶P、N∶P与土壤P含量之间基本不存在显著相关关系。其中叶片C含量与40~60 cm土层外的各土层C、N、P含量均呈显著正相关关系(<0.05), 而叶片N、P含量与40~60 cm土层除外各土层C、N含量则呈显著负相关关系(<0.05)。植物叶片的C∶N值与0~10 cm、10~20 cm、20~40 cm土层的土壤C、N含量呈极显著正相关关系(<0.01), 而叶片C∶P值与0~10 cm、10~20 cm土层的土壤C、N含量呈极显著正相关关系(<0.01), 而与20~40 cm和40~60 cm土层土壤C、N含量的相关性减弱。
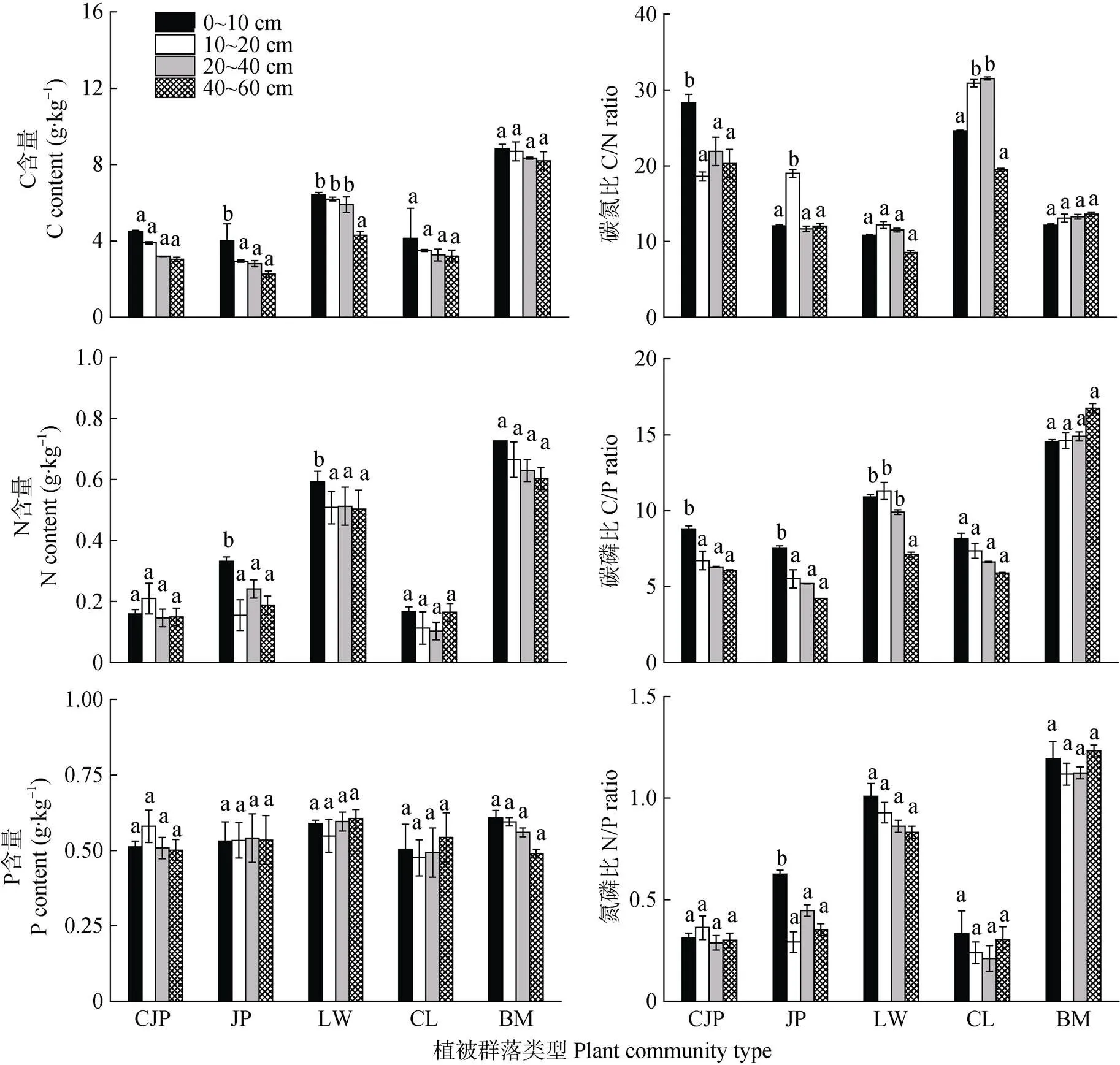
图4 研究区典型植被群落不同土层土壤C、N、P含量及其化学计量比
CJP: 翅碱蓬群落; JP: 碱蓬群落; LW: 芦苇群落; CL: 柽柳群落; BM: 白茅群落。数据为平均值±标准偏差。同一植被群落不同土层间不同小写字母表示在0.05水平差异显著。CJP:; JP:; LW:; CL:; BM:. Data are mean ± SD. Different lowercase letters within the same plant community mean significant differences among different soil layers at 0.05 level.
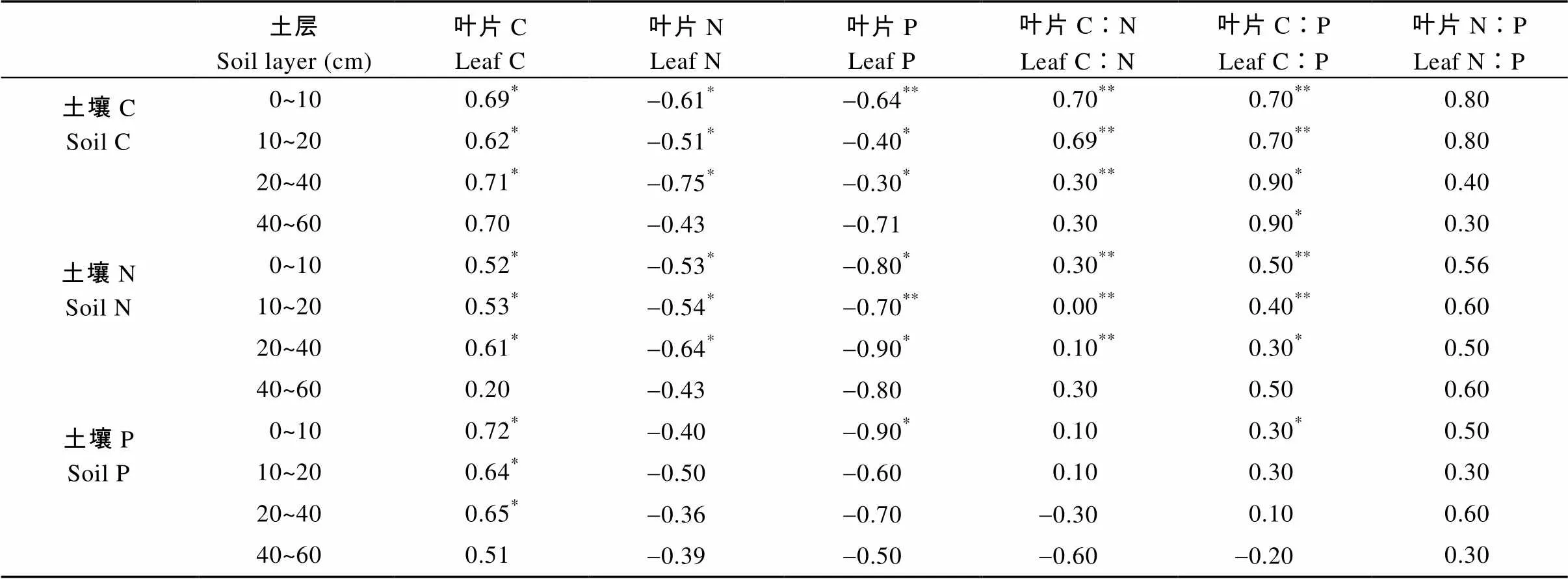
表2 研究区典型植被植物叶片化学计量学特征与不同土层土壤C、N、P含量的相关关系
*和**分别表示显著(<0.05)和极显著相关(<0.01)。* and ** mean significant correlation at 0.05 and 0.01 levels, respectively.
3 讨论
3.1 黄河三角洲自然保护区土壤C、N、P生态化学计量特征
土壤C、N、P元素作为影响作物生长发育所必须的养分元素, 在植物生长过程中发挥着重要的作用,其含量多少及成分组合状况, 均会受到土壤元素含量的影响[21-23]。本研究结果表明黄河三角洲自然保护区土壤C、N、P含量平均值为4.78 g×kg-1、0.32 g×kg-1和0.53 g×kg-1。土壤C、N含量均远低于全国的平均水平(10 g×kg-1和0.65 g×kg-1), 土壤P含量略低于全国平均含量(0.56 g×kg-1)[24]。与农用地和林地不同[21-23], 研究区土壤表层C、N含量与下层差异不大, 主要是由于虽然表层土壤凋落物较多, 土壤微生物活动促进有机质的腐殖化, 但是频繁的潮水影响, 可能会带走大量有机质[25]; 另外, 采样区土壤砂型, 养分元素易随水向下层迁移[26], 故表层土壤C、N含量与下层土壤之间差异较小。
黄河三角洲自然保护区土壤C、N含量与植被生物量变化趋势大体一致, 表明植物凋落物是土壤C、N的重要来源。翅碱蓬、碱蓬、柽柳等植被生物量小, 植被凋落物归还量小, 有机碳、有机氮积累少; 芦苇和白茅生物量相对较大, 凋落物归还量大, 土壤C、N含量较高。土壤有机碳、有机氮含量除受输入土壤的有机质数量影响外, 还取决于其腐殖化系数的大小, 与白茅草甸土壤相比, 芦苇地长年受积水影响, 土壤有机质的腐殖化速度相对缓慢, 故而芦苇地土壤有机碳和有机氮含量低于白茅草甸土壤。此外, 研究区土壤N素的另一个主要来源是大气氮沉降, 主要以硝态氮形态沉降为主[26], 但是研究区土壤常年受潮水影响, 土壤N容易随水迁移[27], 导致该区氮素缺乏。而土壤P主要来源于岩石的风化作用和植物凋落物的分解, 绝大部分不能为植物直接吸收利用, 易被植物吸收利用的速效态磷含量通常很低; 另外P元素不易从表土中向下移动到深层被植物根系吸收, 黄河三角洲滩地盐碱土壤中Ca2+含量高, 土壤中P易沉淀、被吸附, P的有效性低[28-29], 难被植物吸收利用, 故而该研究区不同植被类型土壤P含量差异不大, 且各土层P含量无显著差异。
土壤C∶N∶P是评价土壤养分情况和土壤养分元素总质量的一个重要指标。本研究发现, 翅碱蓬地表层土壤C∶N值显著高于其他土层(<0.05), 这主要由于翅碱蓬地位于潮间带, 虽然受潮水携带的海源有机质输入影响[25], 但是频繁的潮涨潮落加速了N的淋滤作用[26]。而碱蓬地和柽柳地表层土壤C∶N值则显著低于10~20 cm土层, 10~20 cm土层土壤N素的降低是导致C∶N值增大的主要原因。芦苇地和白茅草甸土壤各土层C∶N值不存在显著差异。土壤C∶N∶P值的影响因素较多, 主要受区域成土特征和水热条件的控制, 比如气候、地貌、植被、母岩、年代和土壤微生物等因子和人为活动的影响等。
研究区不同植被类型的土壤C、N、P含量变化不是很大, 使得土壤C∶N∶P的空间变异性较小[30]。而且研究区分布在黄河三角洲自然保护区内, 受人为活动干扰少, 因而土壤C∶N∶P计量特征主要受植被类型的影响。对比前期工作[31]中研究的黄河三角洲未利用地开发过程中植物与土壤碳氮磷化学计量特征, 未利用地开发的过程中, 土壤C∶N和C∶P值范围分别为7.11~20.96和3.16~21.04, N∶P值范围为0.44~1.66。本研究区域土壤C∶N值为9.5~31.2, C∶P值变幅为4.8~17.3, N∶P值为0.2~1.35, 与未利用地开发过程中土壤化学计量特征相比, 保护区C∶N值略高, C∶P值稳定, 而N∶P值较低。主要是由于土地未利用地开发过程中, 土壤受到不同程度人为活动干扰, 以及作物生长过程中周期性的排干、施肥和生长季末作物收获等影响, 增加了土壤元素的输入和有机质的腐殖化过程, 而本研究区域处于黄河三角洲自然保护区内, 人为干扰较少, 而且地势较低, 受积水环境影响, 凋落物腐殖化速度相对缓慢, N素淋洗作用增强, 造成土壤C∶N值较高, N∶P值较低。土壤C∶P值是衡量微生物矿化土壤有机质释放P或从环境中吸收固持P潜力的一种指标, 是土壤矿化能力的标志[32], 较低的土壤C∶P值有利于微生物分解释放养分, 促进土壤中有效磷含量的增加, 有效性提高, 而高C∶P值会导致微生物与植物竞争土壤中的无机磷, 不利于植物生长[33], 本研究中, 土壤C∶P值变幅较小, 说明不同植被生长区P含量相对稳定。C∶P值远低于我国平均值(136)和全球平均值(186)[34], 说明该区域土壤P为净矿化, 土壤P有效性相对较高。
3.2 黄河三角洲自然保护区植物C、N、P生态化学计量特征及N的限制作用
植物与土壤是生态系统生物因子和环境因子的代表, 作为营养元素生物地球化学循环的重要环节, 二者之间存在着必然的联系, 植物叶片C、N、P含量与土壤C、N含量之间存在显著相关关系, 表明植物生长过程中叶片化学计量特征受土壤元素含量的影响。黄河三角洲自然保护区植被中, 除白茅叶片的C含量(591.5 g×kg-1)高于陆生植物叶片C平均含量(464 g×kg-1)外, 其他植被类型C含量均低于全国平均水平, 叶片N含量平均值小于全国平均水平(20.2 g×kg-1)[35], 而P含量普遍高于全国水平(1.5 g×kg-1)[36]。由此可见, 黄河三角洲自然保护区植物叶片具有较低的C、N含量和较高的P含量, 与土壤C、N、P含量的变化是同步的。根系是植物从土壤中直接吸收营养元素的最主要的器官[37], 是土壤-植物之间联系的纽带。根系对土壤变化的反应最敏感, 植物体需要的N、P元素需要根系选择性地从土壤中吸收, 以满足植物体内元素稳定。叶片是植物体营养元素利用的最主要场所, 植物体营养元素通过叶片凋落而流失[38], 所以叶片是植物体营养元素的输出端。叶片和根系作为植物体营养元素的输出和输入端, 为了保持该系统的动态平衡, 二者的营养元素比值应该一致。本研究结果恰好证明了这一点, 研究发现不同植被叶片和根系的N∶P值比较接近, 表明该区植被营养输入与输出的比例一致, 系统稳定。因此, 本文认为叶片和根系的N∶P值比较可以作为植物生长状况的一个评价指标。
黄河三角洲自然保护区植被均具有较低的C∶N和C∶P值, 表明该区域植物体具有较低的C同化能力, 植物的营养利用效率较低[39]。在土壤N含量匮乏, P含量有效性较高的前提下, 植物的主要器官叶片和根系表现出与土壤元素含量一致的趋势, 由此推测植物叶片和根系N含量较低主要是由于土壤供N不足所致。结合前期工作[31], 未利用地开发过程中, 随着氮肥的施用, 植被N∶P值增大, 进一步表明土壤N匮乏是保护区植被生长的限制因子。
植物叶片的N∶P值在许多研究中都被作为判断植物生长限制因子的指标[40], 判断环境对植物生长的养分供应状况和对植物生长速率的影响。当前多数研究采用Koojiman[40]提出的生态系统N∶P阈值, 即当植物叶片N∶P>16, 植物受P限制; N∶P<14, 受N限制; 处于二者之间则共同限制或者都不限制。该结论被广泛地应用于生态系统限制因子的判断。也有研究认为, 生态系统本身的复杂性决定了不能够采用单一的指标判断系统的限制因子, 不同研究区域、生态系统类型以及植被种类的不同, N∶P临界指标会有很大的变化[40]。但是一般可以接受的观点是: 较低的N∶P值反映植物生长受N素含量的限制, 较高的N∶P值反映植物生长受P的限制。问题是当N∶P值升高到什么程度才是P限制, 仍然是难以确定的一个临界值。本研究中, 翅碱蓬、碱蓬、芦苇、柽柳和白茅的叶片N∶P阈值最高为11.9, 均小于14, 根据这一理论判断, 表明研究区植物生长受N限制。
综上研究分析, 研究区土壤化学计量特征和植物生态化学计量特征的结果均显示出黄河三角洲自然保护区植被生长受N素因子的限制, 进一步结合保护区土壤元素含量水平的结果分析, 采样区0~60 cm土层土壤N含量的平均值均小于全国平均值(0.65 g×kg-1), 这与李远等[41]的研究结果相一致。由此可以得出结论, 黄河三角洲自然保护区植被的生长确实受N限制。
4 结论
对黄河三角洲自然保护区内的典型植被及土壤C、N、P含量及C∶N∶P化学计量特征的研究结果显示, 黄河三角洲土壤有机碳、氮含量均低于全国水平, P含量略低于全国平均水平, 且各土层土壤P含量相对稳定, 土壤C∶N∶P化学计量特征显示土壤N的匮乏是C∶N和N∶P值变化的主要原因。5种植物各器官中C和P含量均是叶片最高, 白茅茎的C和P含量高于根, 其他植被均为根含量高于茎。不同植被各器官中N含量均为叶>茎>根。叶片与根系的N∶P值接近, 保护区生态系统元素输入输出相对稳定, 且叶片N∶P值均小于12, 进一步证明N是植物生长的限制因子。综合黄河三角洲自然保护区土壤和植被C、N、P化学计量特征结果表明, N已经成为保护区生态系统植被生长的限制因子, 因此在自然保护区的保护过程中可加强固N植物的保护, 增加土壤中N的含量。
[1] 曾冬萍, 蒋利玲, 曾从盛, 等. 生态化学计量学特征及其应用研究进展[J]. 生态学报, 2013, 33(18): 5484–5492 ZENG D P, JIANG L L, ZENG C S, et al. Reviews on the ecological stoichiometry characteristics and its applications[J]. Acta Ecologica Sinica, 2013, 33(18): 5484–5492
[2] 程滨, 赵永军, 张文广, 等. 生态化学计量学研究进展[J]. 生态学报, 2010, 30(6): 1628–1637 CHENG B, ZHAO Y J, ZHANG W G, et al. The research advances and prospect of ecological stoichiometry[J]. Acta Ecologica Sinica, 2010, 30(6): 1628–1637
[3] 王绍强, 于贵瑞. 生态系统碳氮磷元素的生态化学计量学特征[J]. 生态学报, 2008, 28(8): 3937–3947 WANG S Q, YU G R. Ecological stoichiometry characteristics of ecosystem carbon, nitrogen and phosphorus elements[J]. Acta Ecologica Sinica, 2008, 28(8): 3937–3947
[4] 项文化, 黄志宏, 闫文德, 等. 森林生态系统碳氮循环功能耦合研究综述[J]. 生态学报, 2006, 26(7): 2365–2372 XIANG W H, HUANG Z H, YAN W D, et al. Review on coupling of interactive functions between carbon and nitrogen cycles in forest ecosystems[J]. Acta Ecologica Sinica, 2006, 26(7): 2365–2372
[5] ÅGREN G I. The C∶N∶P stoichiometry of autotrophs- theory and observations[J]. Ecology Letters, 2004, 7(3): 185–191
[6] 刘万德, 苏建荣, 李帅锋, 等. 云南普洱季风常绿阔叶林演替系列植物和土壤C、N、P化学计量特征[J]. 生态学报, 2010, 30(23): 6581–6590 LIU W D, SU J R, LI S F, et al. Stoichiometry study of C, N and P in plant and soil at different successional stages of monsoon evergreen broad-leaved forest in Pu’er, Yunnan Province[J]. Acta Ecologica Sinica, 2010, 30(23): 6581–6590
[7] 杨雪, 李奇, 王绍美, 等. 两种白刺叶片及沙堆土壤化学计量学特征的比较[J]. 中国沙漠, 2011, 31(5): 1156–1161 YANG X, LI Q, WANG S M, et al. Stoichiometric analysis of leaves of two types ofand the sited Nebkhas soil[J]. Journal of Desert Research, 2011, 31(5): 1156–1161
[8] 王维奇, 徐玲琳, 曾从盛, 等. 河口湿地植物活体-枯落物-土壤的碳氮磷生态化学计量特征[J]. 生态学报, 2011, 31(23): 7119–7124 WANG W Q, XU L L, ZENG C S, et al. Carbon, nitrogen and phosphorus ecological stoichiometric ratios among live plant-litter-soil systems in estuarine wetland[J]. Acta Ecologica Sinica, 2011, 31(23): 7119–7124
[9] 任书杰, 于贵瑞, 陶波, 等. 中国东部南北样带654种植物叶片氮和磷的化学计量学特征研究[J]. 环境科学, 2007, 28(12): 2665–2673 REN S J, YU G R, TAO B, et al. Leaf nitrogen and phosphorus stoichiometry across 654 terrestrial plant species in NSTEC[J]. Environmental Science, 2007, 28(12): 2665–2673
[10] YU Q, CHEN Q S, ELSER J J, et al. Linking stoichiometric homoeostasis with ecosystem structure, functioning and stability[J]. Ecology Letters, 2010, 13(11): 1390–1399
[11] DAVIDSON E A, JANSSENS I A. Temperature sensitivity of soil carbon decomposition and feedbacks to climate change[J]. Nature, 2006, 440(7081): 165–173
[12] SARDANS J, RIVAS-UBACH A, PEÑUELAS J. The C∶N∶P stoichiometry of organisms and ecosystems in a changing world: A review and perspectives[J]. Perspectives in Plant Ecology, Evolution and Systematics, 2012, 14(1): 33–47
[13] VAN DE WAAL D B, VERSCHOOR A M, VERSPAGEN J M H, et al. Climate-driven changes in the ecological stoichiometry of aquatic ecosystems[J]. Frontiers in Ecology and the Environment, 2010, 8(3): 145–152
[14] ELSER J J, ANDERSEN T, BARON J S, et al. Shifts in lake N∶P stoichiometry and nutrient limitation driven by atmospheric nitrogen deposition[J]. Science, 2009, 326(5954): 835–837
[15] ELSER J J, FAGAN W F, KERKHOFF A J, et al. Biological stoichiometry of plant production: Metabolism, scaling and ecological response to global change[J]. New Phytologist, 2010, 186(3): 593–608
[16] CUI B S, ZHANG Q J, ZHANG K J, et al. Analyzing trophic transfer of heavy metals for food webs in the newly-formed wetlands of the yellow river delta, China[J]. Environmental Pollution, 2011, 159(5): 1297–1306
[17] 侯学会, 李新华. 黄河三角洲自然保护区1992~2010年土地覆被变化分析[J]. 亚热带植物科学, 2015, 44(4): 309–314 HOU X H, LI X H. Characteristics of land cover change in the Yellow River Estuary Nature Reserve from 1992 to 2010[J]. Subtropical Plant Science, 2015, 44(4): 309–314
[18] 于君宝, 陈小兵, 孙志高, 等. 黄河三角洲新生滨海湿地土壤营养元素空间分布特征[J]. 环境科学学报, 2010, 30(4): 855–861 YU J B, CHEN X B, SUN Z G, et al. The spatial distribution characteristics of soil nutrients in new-born coastal wetland in the Yellow River Delta[J]. Acta Scientiae Circumstantiae, 2010, 30(4): 855–861
[19] 王传远, 杨翠云, 孙志高, 等. 黄河三角洲生态区土壤石油污染及其与理化性质的关系[J]. 水土保持学报, 2010, 24(2): 214–217 WANG C Y, YANG C Y, SUN Z G, et al. Contamination characteristics and its relationship with physico-chemical properties of oil polluted soils in the Yellow River Delta swamp[J]. Journal of Soil and Water Conservation, 2010, 24(2): 214–217
[20] 李庆梅, 侯龙鱼, 刘艳, 等. 黄河三角洲盐碱地不同利用方式土壤理化性质[J]. 中国生态农业学报, 2009, 17(6): 1132–1136 LI Q M, HOU L Y, LIU Y, et al. Properties of saline-alkaline soil under different land use types in Yellow River Delta[J]. Chinese Journal of Eco-Agriculture, 2009, 17(6): 1132–1136
[21] YUSTE J C, BALDOCCHI D D, Gershenson A, et al. Microbial soil respiration and its dependency on carbon inputs, soil temperature and moisture[J]. Global Change Biology, 2007, 13(9): 2018–2035
[22] SCHLESINGER W H, ANDREWS J A. Soil respiration and the global carbon cycle[J]. Biogeochemistry, 2000, 48(1): 7–20
[23] TRESEDER K K, VITOUSEK P M. Effects of soil nutrient availability on investment in acquisition of N and P in Hawaiian rain forests[J]. Ecology, 2001, 82(4): 946–954
[24] 陶冶, 张元明. 古尔班通古特沙漠4种草本植物叶片与土壤的化学计量特征[J]. 应用生态学报, 2015, 26(3): 659–665 TAO Y, ZHANG Y M. Leaf and soil stoichiometry of four herbs in the Gurbantunggut Desert, China[J]. Chinese Journal of Applied Ecology, 2015, 26(3): 659–665
[25] 王丹, 张荣, 熊俊, 等. 互花米草入侵对滨海湿地土壤碳库的贡献——基于稳定同位素的研究[J]. 植物生态学报, 2015, 39(10): 941–949 WANG D, ZHANG R, XIONG J, et al. Contribution of invasive species spartina alterniflora to soil organic carbon pool in coastal wetland: Stable isotope approach[J]. Chinese Journal of Plant Ecology, 2015, 39(10): 941–949
[26] 朱敏, 张振华, 于君宝, 等. 氮沉降对黄河三角洲芦苇湿地土壤呼吸的影响[J]. 植物生态学报, 2013, 37(6): 517–529 ZHU M, ZHANG Z H, YU J B, et al. Effect of nitrogen deposition on soil respiration inwetland in the Yellow River Delta, China[J]. Chinese Journal of Plant Ecology, 2013, 37(6): 517–529
[27] 吴统贵, 陈步峰, 肖以华, 等. 珠江三角洲3种典型森林类型乔木叶片生态化学计量学[J]. 植物生态学报, 2010, 34(1): 58–63 WU T G, CHEN B F, XIAO Y H, et al. Leaf stoichiometry of trees in three forest types in Pearl River Delta, South China[J]. Chinese Journal of Plant Ecology, 2010, 34(1): 58–63
[28] 尹金来, 曹翠玉, 史瑞和. 徐淮地区石灰性土壤磷素固定的研究[J]. 土壤学报, 1989, 26(2): 131–138 YIN J L, CAO C Y, SHI R H. Study on the phosphorus fixation of calcareous soils in Xu-Huai Districts[J]. Acta Pedologica Sinica, 1989, 26(2): 131–138
[29] 张珂, 苏永中, 王婷, 等. 荒漠绿洲区不同种植年限人工梭梭林土壤化学计量特征[J]. 生态学报, 2016, 36(11): 3235–3243 ZHANG K, SU Y Z, WANG T, et al. Soil stoichiometry characteristics ofwith different plantation age in the desert-oasis ecotone, north China[J]. Acta Ecologica Sinica, 2016, 36(11): 3235–3243
[30] 陶冶, 张元明, 周晓兵. 伊犁野果林浅层土壤养分生态化学计量特征及其影响因素[J]. 应用生态学报, 2016, 27(7): 2239–2248 TAO Y, ZHANG Y M, ZHOU X B. Ecological stoichiometry of surface soil nutrient and its influencing factors in the wild fruit forest in Yili region, Xinjiang, China[J]. Chinese Journal of Applied Ecology, 2016, 27(7): 2239–2248
[31] 刘兴华, 陈为峰, 段存国, 等. 黄河三角洲未利用地开发对植物与土壤碳、氮、磷化学计量特征的影响[J]. 水土保持学报, 2013, 27(2): 204–208 LIU X H, CHEN W F, DUAN C G, et al. Effect of exploitation of unutilized land on ecological stoichiometry characteristics of plants and soil carbon, nitrogen and phosphorus in the Yellow River Delta[J]. Journal of Soil and Water Conservation, 2013, 27(2): 204–208
[32] 曾全超, 李鑫, 董扬红, 等. 陕北黄土高原土壤性质及其生态化学计量的纬度变化特征[J]. 自然资源学报, 2015, 30(5): 871–879 ZENG Q C, LI X, DONG Y H, et al. Ecological stoichiometry characteristics and physical-chemical properties of soils at different latitudes on the loess plateau[J]. Journal of Natural Resources, 2015, 30(5): 871–879
[33] 王建林, 钟志明, 王忠红, 等. 青藏高原高寒草原生态系统土壤碳磷比的分布特征[J]. 草业学报, 2014, 23(2): 9–19 WANG J L, ZHONG Z M, WANG Z H, et al. Soil C/P distribution characteristics of alpine steppe ecosystems in the Qinhai-Tibetan Plateau[J]. Acta Prataculturae Sinica, 2014, 23(2): 9–19
[34] FAZHU Z, JIAO S, CHENGJIE R, et al. Land use change influences soil C, N, and P stoichiometry under ‘Ggrain-to- Green Program’ in China[J]. Scientific Reports, 2015, 5: 10195
[35] ELSER J J, DOBBERFUHL D R, MACKAY N A, et al. Organism size, life history, and N∶P stoichiometry: Toward a unified view of cellular and ecosystem processes[J]. BioScience, 1996, 46(9): 674–684
[36] REICH P B, OLEKSYN J. Global patterns of plant leaf N and P in relation to temperature and latitude[J]. Proceedings of the National Academy of Sciences of the United States of America, 2004, 101(30): 11001–11006
[37] 宋香静, 李胜男, 郭嘉, 等. 环境变化对湿地植物根系的影响研究[J]. 水生态学杂志, 2017, 38(2): 1–9 SONG X J, LI S N, GUO J, et al. Response of wetland plant roots to environmental factors: A review[J]. Journal of Hydroecology, 2017, 38(2): 1–9
[38] 曹磊, 宋金明, 李学刚, 等. 黄河三角洲典型潮汐湿地碳、氮、磷生物地球化学特征[J]. 海洋科学, 2015, 39(1): 84–92 CAO L, SONG J M, LI X G, et al. Biogeochemical characteristics of soil C, N, P in the tidal wetlands of the Yellow River Delta[J]. Marine Sciences, 2015, 39(1): 84–92
[39] GÜSEWELL S. N∶P ratios in terrestrial plants: Variation and functional significance[J]. New Phytologist, 2004, 164(2): 243–266
[40] KOOJIMAN S A L M. The stoichiometry of animal energetics[J]. Journal of Theoretical Biology, 1995, 177(2): 139–149
[41] 李远, 章海波, 陈小兵, 等. 黄河三角洲内陆到潮滩土壤中碳、氮元素的梯度分布规律[J]. 地球化学, 2014, 43(4): 338–345LI Y, ZHANG H B, CHEN X B, et al. Gradient distributions of nitrogen and organic carbon in the soils from inland to tidal flat in the Yellow River Delta[J]. Geochimica, 2014, 43(4): 338–345
C, N and P stoichiometry of typical plants and soils in the Yellow River Delta Natural Reserve*
LIU Xinghua1, GONG Yanqing2, CHEN Weifeng3**, HUANG Baohua1, ZHU Rongsheng1
(1. Institute of Animal Science and Veterinary Medicine, Shandong Academy of Agricultural Sciences, Jinan 250100, China; 2. Pingyi Environmental Protection Bureau, Linyi 273300, China; 3. Shandong Agricultural University, Tai’an 271018, China)
The in-depth understanding of stoichiometry of plant and soil is beneficial for discovering convergence and divergence of ecosystem compositions, and forecasting response of ecosystem to environment change. The Yellow River Delta is an active and younger ecosystem, its’ stoichiometry of plant and soil may impact ecosystem structure, function and stability. The aim of this study was to clarify the characteristics of carbon (C), nitrogen (N) and phosphorus (P) contents and stoichiometry of plants and soils in the Natural Reserve of Yellow River Delta. In the study, five vegetation communities from sea to inland were selected, which were,,,andcommunities, to analyze contents of C, N and P of different organs of plants and soils. The results showed that C and P contents of plant leaf were higher than those of root, and those of stem were lowest for all the vegetation communities, exceptandcommunitis. Incommunity, C and P contents were higher in plant stem than in root. N content of leaf was higher than of stem and that of root was lowest for all the vegetation communities. N∶P ratio of leaf was lower than 12 and was not significantly different from that of root in all ecosystems. The average contents of soil organic C, total N and P were respectively4.78 g×kg-1, 0.32 g×kg-1and 0.53 g×kg-1, with all lower than the national average. The differences in contents of soil C, N and P in different soil layers were insignificant. Soil stoichiometry ratio was significantly affected by vegetation type, but the spatial variability was insignificant. There was a significant correlation between contents of leaf organic C, N and P and stoichiometry ratios of C∶N and C∶P and then the contents of soil C and N in the 0-10 cm, 10-20 cm and 20-40 cm soil layers (< 0.05). In conclusion, the results showed that the contents of C, N and P were stable in soil profile and lower than the national level. The low content of N affected the variations of C∶N and C∶P ratios. Consistent with C∶P ratio of plant leaf and root, the cycles of the elements were stable in the ecosystem. Then N∶P ratio of plant leaf was lower than 12.The findings in this study demonstrated that N was the limiting nutrient element in ecosystems of the Yellow River Delta Natural Reserve.
Stoichiometry; Nutrient content; Plant community; Soil; Yellow River Delta
, E-mail: chwf@sdau.edu.cn
Dec. 28, 2017;
May 23, 2018
S153
A
1671-3990(2018)11-1720-10
10.13930/j.cnki.cjea.171214
* 国家自然科学基金项目(31570522)和山东省重点产业项目(2016CYJS5A02,2017CXGC0309)资助
陈为峰, 主要研究方向为土壤生态与环境研究。E-mail: chwf@sdau.edu.cn
刘兴华, 主要研究方向为环境地球化学。E-mail: xhliu@yic.ac.cn
2017-12-28
2018-05-23
* This study was supported by the National Natural Science Foundation (31570522) andthe Key Industrial Project in Shandong Province (2016CYJS5A02,2017CXGC0309).
刘兴华, 公彦庆, 陈为峰, 黄保华, 朱荣生. 黄河三角洲自然保护区植被与土壤C、N、P化学计量特征[J]. 中国生态农业学报, 2018, 26(11): 1720-1729
LIU X H, GONG Y Q, CHEN W F, HUANG B H, ZHU R S. C, N and P stoichiometry of typical plants and soils in the Yellow River Delta Natural Reserve[J]. Chinese Journal of Eco-Agriculture, 2018, 26(11): 1720-1729
