高温环境对SD大鼠散热机制的影响
2018-11-02王炳志刘春花姜劼琳姚凤云
王炳志,郑 蒙,刘春花,姜劼琳,姚凤云
(江西中医药大学基础医学院,江西南昌330004)
在高气温或同时存在高湿度或热辐射的不良气象条件下进行的生产劳动,通称为高温作业[1]。高温作业是一种影响范围很广的职业性有害因素,长期在高温环境下工作会对人体健康造成危害,引起体温、消化系统、心血管系统和中枢神经系统等产生一系列改变[2-4],可因热平衡失调而导致以中枢神经系统损害为主的职业性中暑,如救治不及时,可导致严重的并发症甚至死亡[5]。下丘脑的视前区是机体的体温调节中枢,其中多种神经递质可能参与体温调节功能[6],本试验主要从散热机制方面探讨高温环境对正常大鼠和中枢神经麻醉大鼠相关指标的影响。
1 材料与方法
1.1 材料
1.1.1 实验动物 SPF级SD雄性大鼠,280 g~300 g,购自湖南斯莱克景达实验动物有限公司,许可证号:SCXK(湘)2013—0004。
1.1.2 试剂 三碘甲状腺原氨酸(T3)、甲状腺素(T4)、促甲状腺激素(thyroid stimulating hormone,TSH)、促甲状腺激素释放激素(thyrotropin-releasing hormone,TRH)、肾上腺素(epinephrine,EPI)、乙酰胆碱(acetylcholine,ACH)试剂盒,武汉优尔生科技股份有限公司产品,批号分别为L161107474、L161010395、L161122986、L161125068、L161116874、 L161125069;β2受体抗体(一抗),Abcam公司产品;免疫组化试剂盒(通用),北京鼎国昌盛生物技术有限责任公司生产。
1.1.3 主要仪器 RXZ智能型人工气候箱,宁波江南仪器公司产品; Chromate 4300酶标仪,美国Awareness公司产品;CT14RD低温冷冻离心机,上海天美公司产品;RM2245型切片机,德国徕卡公司产品;Olympus BX6光学显微镜,日本奥林巴斯公司产品。
1.2 方法
1.2.1 动物分组 按体重将实验动物随机分为4组,即常温正常对照组、高温正常对照组、常温中枢麻醉组、高温中枢麻醉组,每组10 只。
1.2.2 饲养环境 ①常温正常对照组和常温中枢麻醉组置于常温(23℃~25℃)空气流通处饲养;②高温正常对照组和高温中枢麻醉组置于人工气候箱中饲养,仪器条件设置为白天温度32 ℃,相对湿度55%;夜晚温度30℃,相对湿度66%;昼夜交替光照,24 h为1个循环。
1.2.3 试验方法 各组动物均普通饲料喂养,正常饮水,连续30 d。每3天称体重1次,每2天称垫料1次,并用垫料差异法计算每只动物平均日排泄物量,每2天计算1次每只动物平均日摄食量。各组动物禁食不禁水14 h,称重,常温中枢麻醉组和高温中枢麻醉组动物戊巴比妥钠(30 mg/kg)中枢麻醉,2 h后再用氨基甲酸乙酯(1 g/kg)麻醉,其他组均用氨基甲酸乙酯(1 g/kg)麻醉,打开腹腔,腹主动脉采血10 mL,室温静置30 min,6 500 r/min离心10 min,分离血清,采用ELISA检测T3、T4、TSH、TRH、EPI、ACH含量;采血后迅速剥离腹主动脉上神经组织并剪取一段3 cm长血管,采用免疫组化方法检测腹主动脉β2受体表达。
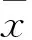
2 结果
2.1 对体重的影响
由表1可知,试验前各组体重差异不显著,饲养30 d后,各高温组大鼠体重均极显著低于各常温组(P<0.01)。

表1 温度对大鼠体重的影响
注:与常温正常组比较,﹡﹡P<0.01;与常温中枢麻醉组比较,△△P<0.01。
Noet:Compare with the normal temperature control group,﹡﹡P<0.01;Compare with the normal temperature central anesthesia group,△△P<0.01.
2.2 对摄食量、排泄物的影响
采用垫料差异法,由表2可知,除常温中枢麻醉组外,各组大鼠摄食量均显著低于常温正常对照组(P<0.05或P<0.01),与常温中枢麻醉组相比,高温中枢麻醉组大鼠摄食量极显著降低(P<0.01);各高温组大鼠排泄物量均显著高于各常温组(P<0.05)。
2.3 对大鼠血清T3、T4含量的影响
从表3可知,各组大鼠血清T3含量均低于常温正常对照组,其中常温中枢麻醉组大鼠血清T3含量降低尤为显著(P<0.01);各组大鼠血清T4含量均低于常温正常对照组,但无显著性差异,不具有统计学意义,而高温中枢麻醉组大鼠血清T4含量高于常温中枢麻醉组,差异显著(P<0.05)。

表2 温度对大鼠摄食量、排泄物的影响
注:与常温正常组比较,﹡P<0.05,﹡﹡P<0.01;与常温中枢麻醉组比较,△P<0.05,△△P<0.01。
Noet:Compare with the normal temperature control group,﹡P<0.05,﹡﹡P<0.01;Compare with the normal temperature central anesthesia group,△P<0.05,△△P<0.01.
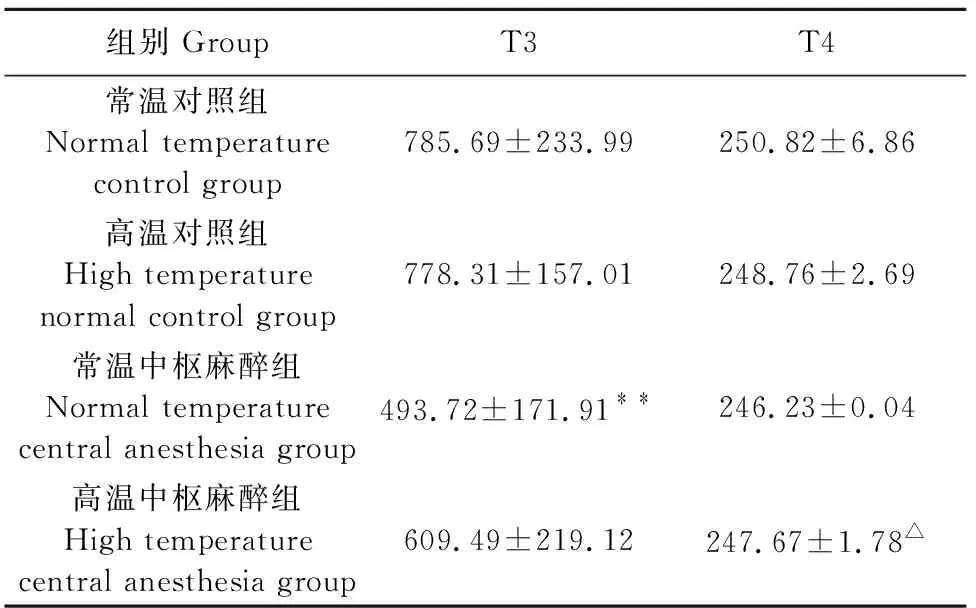
表3 温度对大鼠血清T3、T4含量的影响
注:与常温正常组比较,﹡﹡P<0.01;与常温中枢麻醉组比较,△P<0.05。
Noet:Compare with the normal temperature control group,﹡﹡P<0.01;Compare with the normal temperature central anesthesia group,△P<0.05.
2.4 对大鼠血清TRH、TSH含量的影响
由表4可知,各组大鼠血清TRH含量均低于常温正常对照组,但无显著性差异;各组大鼠血清TSH含量均低于常温正常对照组,其中常温中枢麻醉组和高温中枢麻醉组大鼠血清TSH含量降低极为显著(P<0.01),而各高温组大鼠血清TSH含量明显高于常温中枢麻醉组(P<0.05或P<0.01)。

表4 温度对大鼠血清TRH、TSH含量的影响
注:与常温正常组比较,﹡﹡P<0.01;与常温中枢麻醉组比较,△P<0.05,△△P<0.01。
Noet:Compare with the normal temperature control group,﹡﹡P<0.01;Compare with the normal temperature central anesthesia group,△P<0.05,△△P<0.01.
2.5 对大鼠血清ACH、EPI含量的影响
由表5可知,与常温正常对照组相比较,各高温组大鼠血清ACH均呈升高趋势,但差异不显著,而常温中枢麻醉组大鼠血清ACH含量极显著性降低(P<0.01);与常温中枢麻醉组相比,各高温组大鼠血清ACH含量显著升高(P<0.05或P<0.01)。除高温正常对照组外,其余各组大鼠血清EPI含
量均低于常温正常对照组,但差异不显著。
2.6 对血管β2受体表达的影响
从图1和表6可知,各组平均光密度值均低于常温正常对照组,其中高温正常对照组和常温中枢麻醉组差异著(P<0.05或P<0.01),而常温正常对照组和高温正常对照组大鼠血管β2受体表达光密度值均显著高于常温中枢麻醉组(P<0.05或P<0.01)。

表5 温度对大鼠血清ACH、EPI含量的影响
注:与常温正常组比较,﹡﹡P<0.01;与常温中枢麻醉组比较,△P<0.05,△△P<0.01。
Noet:Compare with the normal temperature control group,﹡﹡P<0.01;Compare with the normal temperature central anesthesia group,△P<0.05,△△P<0.01.
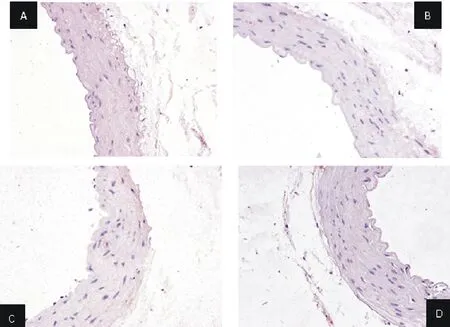
A.常温正常对照;B.高温正常对照;C.常温中枢麻醉;D.高温中枢麻醉
A.Normal temperature control;B.High temperature normal control;C.Normal temperature central anesthesia;D.High temperature central anesthesia

图1 血管β2受体表达免疫组化结果(200×)
注:与常温正常组比较,﹡P<0.05,﹡﹡P<0.01;与常温中枢麻醉组比较,△P<0.05,△△P<0.01。
Noet:Compare with the normal temperature control group,﹡P<0.05,﹡﹡P<0.01;Compare with the normal temperature central anesthesia group,△P<0.05,△△P<0.01.
3 讨论
下丘脑是维持体温稳定的主要脑区。外周感受器能感受与引起全身对热与冷的反应,全身或局部加热或冷却引起的反射必须经过下丘脑的作用激起相应的反射活动,破坏下丘脑,这些刺激只引起局部的反应。下丘脑不仅能传导兴奋,而且能分泌激素,包括促甲状腺素释放激素、促肾上腺皮质激素释放激素等,促进垂体中激素的合成和分泌,它把内脏活动与其他生理活动联系起来,调节着体温、摄食、水平衡、血糖和内分泌腺活动等重要的生理功能[7],因此本试验按高温、中枢麻醉两因素分为常温正常对照组、高温正常对照组、常温中枢麻醉组、高温中枢麻醉组4个组。
高温环境会引起人体消化液(如胃液、胰液、胆汁、肠液等)分泌量的减少,消化酶活性及胃液酸度的降低,胃肠道蠕动的减慢,摄食中枢受到抑制,导致食欲减退及消化不良[4]。当环境温度超过体表温度时,蒸发散热在维持体温恒定中发挥重要的作用,出汗量与高温环境之间存在明显相关性[8]。发汗是人体蒸发散热的重要方式,啮齿类动物主要依赖分泌唾液和理毛行为增加蒸发散热[9]。试验结果表明,高温降低大鼠体重和摄食量,而增加排泄量,中枢神经麻醉对以上结果均无明显协同作用。
甲状腺是机体物质代谢及生长发育的重要内分泌器官,甲状腺激素的分泌受中枢神经系统的调控。下丘脑产生促甲状腺激素释放激素(TRH) 经神经细胞释放到垂体促使垂体合成和分泌促甲状腺激素(TSH)[7],腺垂体分泌的TSH维持和促进甲状腺功能,包括促进甲状腺素(T4和T3) 的释放及合成[10]。通常情况下,血液中T3、T4浓度的升降对TSH存在负反馈调节作用,即血液游离T3、T4减少或升高可引起垂体TSH释放和合成的升高或降低,共同构成下丘脑-垂体-甲状腺轴自动控制环路[11-12]。本试验结果显示,与常温正常组相比,常温中枢麻醉T3下降TSH也下降,而T4无明显变化,表明中枢麻醉对T3、TSH有较大影响。与常温中枢麻醉组相比,高温环境下中枢麻醉T4升高TSH也升高,而T3无明显变化。T4水平只在高温中枢神经麻醉的条件下变化,表明T4水平不受高温的影响只受外周神经系统影响,且表现升高趋势。T3只在常温中枢麻醉组中有明显变化,表明T3水平在常温下受中枢神经麻醉影响。与常温正常组相比,常温中枢麻醉和高温中枢麻醉组TSH降低,而相比常温中枢麻醉组,高温正常组和高温中枢麻醉TSH升高。表明高温不直接影响TSH水平,在常温或高温状态下中枢神经或周围神经调节TSH水平。但各组中TRH水平一直无变化,表明高温和中枢神经麻醉对其无影响。
下丘脑尤其是视前区[13-14]热敏神经元和冷敏神经元调节机体的体温变化,该区域受到这些神经元的支配,其活性的变化与体温的波动密切相关。现已知参与下丘脑体温调节的神经递质有乙酰胆碱(Ach)、肾上腺素(EPI)等[15]。乙酰胆碱(Ach)是一种兴奋性神经递质,下丘脑中副交感神经通过其末梢释放乙酰胆碱,支配心血管系统功能,可使全身血管扩张达成散热目的。试验结果表明,常温状态下中枢神经调节ACH水平,高温不直接影响ACH,但高温条件下外周神经也调节ACH水平。肾上腺素无明显变化,表明中枢麻醉、高温对其无影响。血管β2受体是儿茶酚胺受体之一,儿茶酚胺与β受体作用可引起血管弛缓[16]和心脏兴奋[17],起到散热作用。本结果显示,高温和中枢神经麻醉均可降低大鼠腹主动脉β2受体表达。
