芹菜素对黄嘌呤氧化酶活性的抑制机理研究
2018-10-31
(上海震旦职业学院,上海201908)
黄嘌呤氧化酶(xanthine oxidase,XO)是尿酸生成过程中一关键酶,主要存在于哺乳动物的乳汁和肝脏中。在人体内,XO能催化次黄嘌呤成黄嘌呤,最终生成尿酸[1],当XO活性异常活跃时,使尿酸大量的生成和过量积累在血液中,临床表现为高尿酸血症,随着尿酸盐沉积进而引起痛风的发作[2]。研究显示,随着经济的发展,人民生活水平的提高,饮食结构的改变,高尿酸血症和痛风的发病率逐年增高,呈年轻化趋势,并与代谢紊乱、心脑血管疾病等相关[3]。因此抑制XO活性,从源头减少尿酸的产生是临床治疗痛风的重要手段。现临床上应用的XO抑制剂主要是别嘌呤醇,然而可能会引发一些不良反应,如引起过敏及抑制骨髓,对部分充血性心脏功能不全的高尿酸血症患者不利等,这在一定程度上限制了它的临床应用[4]。因此研究新的低毒、少副作用的XO抑制剂具有十分重要的意义。天然产物有效成分的XO抑制剂来源广泛,安全性高,因此引起了广泛的关注。
目前,黄酮类化合物在医药和食品方面有重要的应用。天然的黄酮类化合物有多种生物活性[5],例如清除自由基、抗氧化、抗菌、抗病毒、保护肝脏、抗肿瘤、抗血栓、保护心肌和降血脂等作用。此外,研究表明,有些黄酮类化合物还能抑制XO的活性,从而抑制尿酸的合成以及一系列生理性损伤[6-7]。作为一种黄酮组分,芹菜素又称芹黄素、洋芹素,广泛分布于温热带的蔬菜和水果中,尤以芹菜中含量为高;在一些药用植物如车前子、络石藤等中也有很高的含量,植物源性饮料如茶、酒以及一些调味品中也有分布[8-9]。有文献报道芹菜素对XO也具有较好的抑制活性[10],但其对XO的抑制机理尚未见深入的研究,因此本试验利用多种光谱连用的方法(紫外光谱、荧光光谱和圆二色谱等)结合分子对接技术来探究芹菜素对XO活性的抑制机理,为芹菜素在临床上的应用提供理论依据,有助于深入分析芹菜素对黄嘌呤氧化酶的作用机制和进行药物的临床应用评价。
1 材料与方法
1.1 材料与仪器
美国黄嘌呤氧化酶(编号X4500-5UN,酶活1.0 units/mg~2.0 units/mg,来源于牛奶):Sigma公司;芹菜素(纯度≥98.0%)、根皮素(纯度≥99.0%)、别嘌呤醇(纯度≥98.0%)、黄嘌呤(纯度≥99.5%):上海阿拉丁试剂有限公司;其它试剂均为分析纯。
pH211型精密pH计:意大利HANNA公司;UV-2550型紫外–可见分光光度计:日本SHIMADZU公司;F-4500型荧光光度计:日本Hitachi公司;J-810型圆二色谱仪:日本JASCO公司。
1.2 方法
1.2.1 芹菜素抑制XO的酶活测定
采用Wang等[11]的方法进行酶活测定,并在此基础上稍作修正。XO催化黄嘌呤产生的尿酸在295 nm处有特征吸收峰,利用UV-2550型紫外-可见分光光度计的动力学版块,将固定浓度的XO溶液(7.5×10-8mol/L)与含有不同浓度芹菜素(根皮素)溶液混合,制备一系列3 mL的反应体系(在pH 7.4,0.05 mol/L,Tris-HCl缓冲液中),置于37℃水浴孵化3 h,待反应达到平衡,加入底物黄嘌呤溶液(最终浓度为5.0×10-5mol/L)启动反应,25℃下,以空白作对照,每隔15秒测定体系在295 nm处的吸光度,每种浓度做3个平行。
通过关系式:相对活性/%=(R/R0)× 100,计算 XO的相对活性,以别嘌呤醇作为阳性对照。
式中:R0为无抑制剂时吸光度变化率;R为在含有不同浓度抑制剂体系中吸光度变化率。以未加抑制剂组的酶活力为100%。
1.2.2 芹菜素对XO活性的抑制动力学研究
在上述相同条件下,固定XO的浓度(7.5×10-8mol/L),测定不同浓度芹菜素体系(0、2.5、5.0、10.0 μmol/L)中,不同浓度底物黄嘌呤(2.5、5.0、10.0、20.0×10-5mol/L)对反应速率的影响,每种浓度做3个平行,并以Lineweaver-Burk双倒数方程作图,判断芹菜素对XO抑制作用的可逆性和抑制类型,并求出抑制常数(Ki)和抑制系数(α)。
1.2.3 芹菜素与XO作用的荧光光谱研究
在3 mL反应体系(Tris-HCl缓冲液)中,固定XO浓度(5.0×10-7mol/L),依次滴加一定量的芹菜素溶液(3 μL/次,使浓度逐渐增加)并混合均匀,待静置3 min,分别扫描游离XO和芹菜素-XO混合体系的荧光光谱。扫描条件:激发波长280 nm,激发和发射狭缝均为5 nm,扫描范围300 nm~500 nm。
1.2.4 圆二色谱测定
在上述缓冲介质中,分别扫描游离XO以及芹菜素-XO样品溶液(摩尔比1∶1和2∶1)的圆二色谱。扫描条件:波长范围为190 nm~250 nm,扫描速度为60 nm/min,以相同缓冲液做空白。再通过在线Dichroweb 软 件(http://dichroweb.cryst.bbk.ac.uk/html/home.shtml)计算XO的二级结构含量变化[12]。
1.2.5 分子对接
从Protein Data Base数据库下载XO的晶体模型(PDB ID:3ETR),从Pub Chem数据库下载芹菜素的3D结构,分别进行优化处理。再通过AutoDock 4.2分子模拟软件进行100次结合模拟,选出最佳结合构象进行分析。
2 结果与分析
2.1 芹菜素对XO活性的抑制作用
芹菜素对XO的抑制作用见图1。

图1 芹菜素对XO的抑制作用Fig.1 Inhibitory effect on XO of apigenin
如图1所示,在一定浓度内,随着芹菜素的不断加入,XO的相对活性逐渐降低直至20%,芹菜素对酶的抑制作用呈现一定的浓度依赖关系,是有效的XO抑制剂;而根皮素只将相对酶活抑制到75%,最后趋于平缓,表明根皮素不是有效的XO抑制剂。分析其结构,根皮素与芹菜素的结构差异只在于缺少一个2-苯基色原酮结构,由此可见黄酮组分芹菜素中的2-苯基色原酮结构是抑制XO活性的重要结构[10]。此外,芹菜素和阳性对照别嘌呤醇的IC50分别为(8.63±0.03)μmol/L和(3.02±0.02)μmol/L(n=3),数量级相同,表明芹菜素具有较好的抑制XO活性的潜力。
2.2 芹菜素对XO的抑制动力学分析
通过酶反应动力学方法,用酶促反应速度υ(ΔOD)对酶浓度作图:当不存在抑制剂时,速率直线通过原点;当有可逆性抑制剂存在时,因抑制剂的量恒定,可得到一条通过原点而斜率较低的直线[11]。芹菜素对XO的抑制类型见图2。

图2 芹菜素对XO的抑制类型Fig.2 Inhibitory type of apigenin on XO
图2显示,每个抑制剂浓度下的直线都经过原点,且随着芹菜素浓度的增加直线的斜率不断降低,表明芹菜素对XO的抑制是一个可逆的过程。按照动力学方法区分抑制剂对酶的可逆性抑制作用,以及抑制剂、底物和酶之间的相互关系,可逆性抑制又可分为竞争性抑制、非竞争性抑制、反竞争性抑制和混合竞争型抑制。采用Lineweaver-Burk双导数法作图,判断芹菜素对XO的抑制作用类型,结果见图2,测得的l/υ-1/[S]关系为一组相交于第二象限的直线,这说明芹菜素对XO是一种混合竞争型抑制剂[12]。对这种抑制类型,再分别以直线的斜率和Y-截距对芹菜素浓度二次作图,如图2所示,直线线性关系较好,表明芹菜素在XO上只有一个或一类结合位点[13],再计算得出Ki=(2.35±0.42)μmol/L 和 α=(4.07±0.06)μmol/L。
2.3 芹菜素与XO的相互作用
一般情况下,在激发波长为280 nm时,蛋白质在340 nm附近有一个主要的荧光发射峰(主要因为蛋白质中色氨酸、酪氨酸和苯丙氨酸等荧光发射基团)。图3是不同浓度芹菜素存在下XO荧光发射光谱。
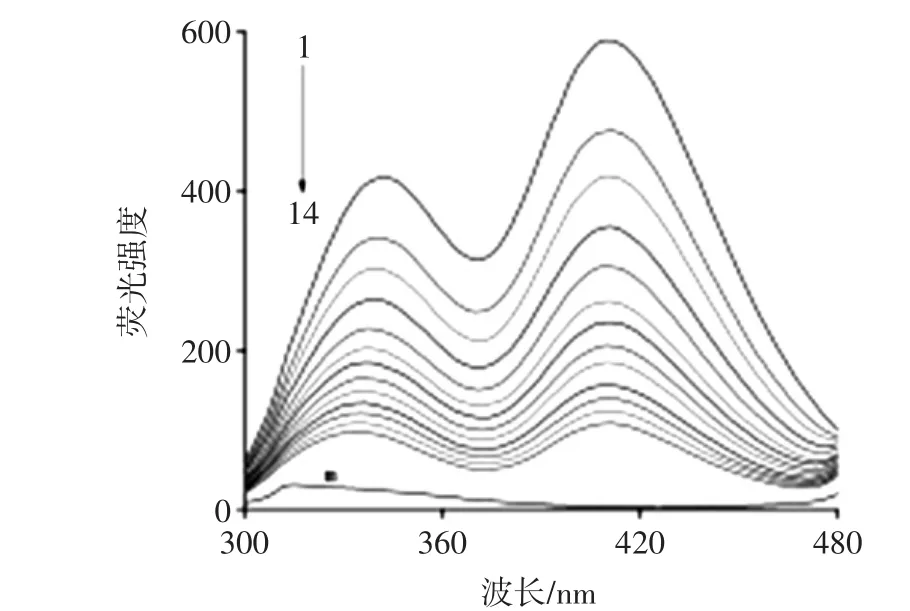
图3 不同浓度的芹菜素对XO荧光光谱的影响Fig.3 Effect of apigenin on fluorescence spectra of XO at different concentrations
芹菜素没有内源荧光,而随着芹菜素溶液不断加入,XO的荧光强度有规律地降低,并且最高峰的峰位出现了略微蓝移,这说明芹菜素与XO之间发生了相互作用,并由此影响了XO内荧光发色氨基酸周围微环境,使其疏水性增强[14]。
为了进一步阐明猝灭机理,在研究中利用Stern-Volmer方程对试验数据进行分析[15]:F0/F=1+Kqτ0[Q]=1+Ksv[Q],lg(F0-F)/F=lgKa+nlg[Q],式中:F0和 F 分别为未加入和加入芹菜素时XO的荧光强度;Kq为双分子猝灭过程速率常数;KSV为猝灭常数;[Q]为芹菜素的浓度。并根据热力学公式:lgKa=-ΔH/2.303RT+ΔS/2.303R,ΔG= ΔH-TΔS,计算焓变(ΔH)、熵变(ΔS)和吉布斯自由能变(ΔG)。根据反应前后热力学焓变ΔH和熵变ΔS的相对大小,可以判断芹菜素与XO大分子相互作用的主要作用力类型[16]。结果列于表1。
表1中,Ksv随着温度的升高而减小且猝灭速率常数Kq值均远大于生物分子的最大扩散速率常数值(2×1010L/(mol·s),这表明芹菜素对XO荧光猝灭为典型的形成复合物的静态猝灭过程;结合常数(Ka)随温度升高而增大,说明复合物的稳定性随温度升高而增强;结合位点数(n)均趋于1,表明芹菜素在XO上存在唯一的结合位点,这与抑制动力学试验结果吻合。
根据ΔG<0,表明芹菜素与XO的作用过程是一个Gibbs自由能降低的自发过程;ΔH>0、ΔS>0,说明形成复合物是熵驱动的吸热反应,揭示芹菜素与XO结合的主要驱动力为疏水作用力[12]。
不同温度下芹菜素-XO体系的猝灭常数(Ksv)、结合常数(Ka)、结合为点数(n)及热力学参数见表1。
2.4 芹菜素对XO二级结构的影响
圆二色谱是研究蛋白质二级结构变化的有效工具,图6为芹菜素与XO相互作用的圆二色谱图,XO出现两个负的特征峰谱带是α-螺旋结构的特征峰,并随着芹菜素浓度增大,图谱中特征负峰减小,且峰位峰形都没有显著变化,表明XO分子中α-螺旋结构发生变化但仍占主导地位。在线SELCON3程序算得XO二级结构含量的值列于表2,可见,当芹菜素与XO的摩尔比增大时(从 0∶1,1∶1到 2∶1),α-螺旋(从36.8%、40.3%到47.6%)和β-折叠(11.8%、13.1%到14.4%)的含量都升高,而β-转角(从26.3%、23.9%到20.6%)和无规卷曲(25.1%、22.7%到17.7%)含量逐渐降低,说明芹菜素的加入诱导XO的二级结构发生部分改变,并且α-螺旋作为主要结构,含量增加可能使XO的二级结构更加紧密,这不利于酶形成活性中心以及底物进入活性中心。
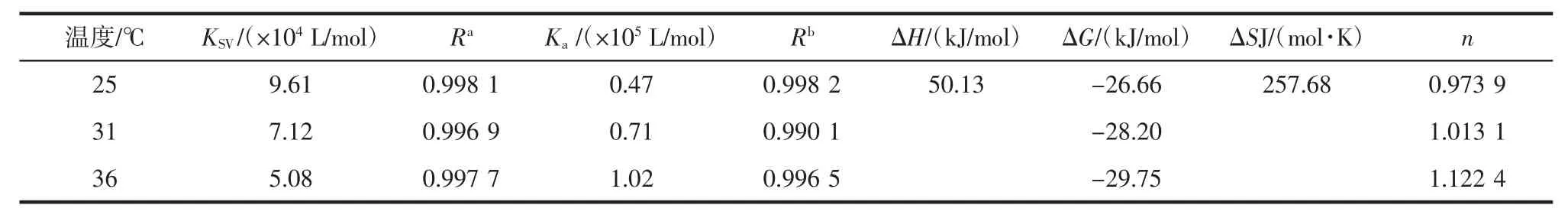
表1 不同温度下芹菜素-XO体系的猝灭常数(Ksv)、结合常数(Ka)、结合为点数(n)及热力学参数Table 1 Quenching constant(Ksv),association constant(Ka),binding sites(n),and thermodynamic parameters of apigenin-XO system at different temperature
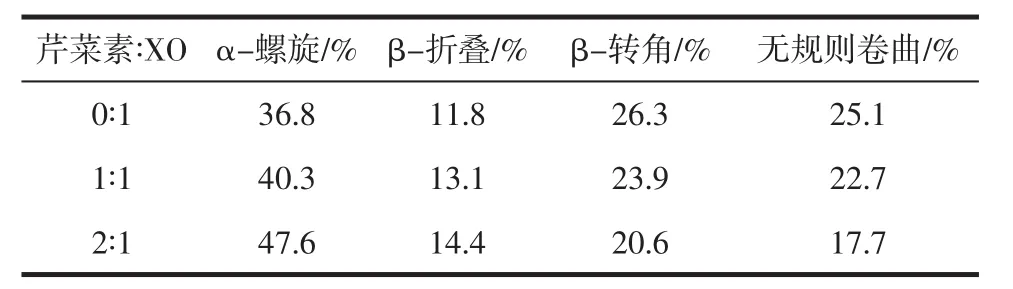
表2 XO和芹菜素-XO体系的蛋白质二级结构含量Table 2 Secondary structure contents of XO and apigenin-XO systems
2.5 分子模拟
计算机分子对接方法可形象地展现出配体与生物大分子的结合情况,这有助于从理论上确定其相互作用的机理和模式。芹菜素与XO分子对接团簇分析见图4,芹菜素与XO分子对接见图5。
如图4,按最佳能量原理,结合能最低(-6.15)结合次数最多(33次)的结合构象最稳定,所得的最佳构象如图5所示,该图仅显示了XO活性空腔内配体芹菜素周围氨基酸残基(Phe 649/1009/1013、Leu 648/873/1014、Glu 802/879、Arg 880、Ser 876、Thr 1011 等),并与阳性对照别嘌呤醇的位置进行对比。从图中可看出,与别嘌呤醇一样,芹菜素的刚性双环结构嵌入XO的疏水腔,而这阻碍了底物分子进入活性中心的通道,由此降低了酶的催化活性。而且芹菜素的疏水结构被疏水氨基酸包围(Leu 648/873/1014,Phe 649/1009/1013),说明芹菜素与XO之间存在疏水作用[11-12],这与热力学研究结果基本一致。再者,考虑到其间近距离,芹菜素苯环结构与周围的芳香族氨基酸(Phe 649/1009/1013)的苯环之间可能存在π-π堆积作用,这有利于配体的结合。图中还显示芹菜素与XO的Leu 873、Phe 649之间形成了氢键,键长分别为3.37 Å和3.16 Å,进一步利于芹菜素稳定在空腔中。
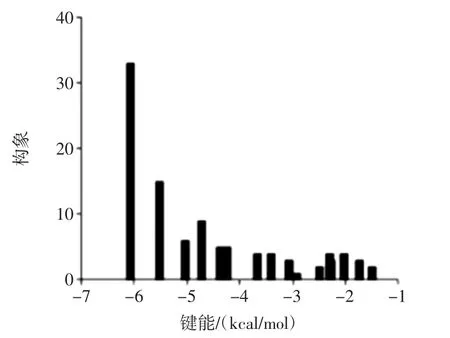
图4 芹菜素与XO分子对接团簇分析Fig.4 Cluster analyses of the AutoDock docking runs of apigenin with XO

图5 芹菜素与XO分子对接Fig.5 Molecular docking between apigenin and XO
3 结论
芹菜素具有良好的XO活性抑制效果;通过研究抑制动力学特点,明确芹菜素对XO具有明显可逆的混合竞争型抑制作用,其半抑制浓度IC50为(8.63±0.03)μmol/L,抑制常数 Ki为(2.35 ± 0.42)μmol/L。再结合芹菜素与XO相互作用进行分析,芹菜素抑制XO活性的机理为:芹菜素进入XO的疏水腔,通过疏水作用力与XO活性中心周围的主要氨基酸残基发生作用;并引起XO的二级结构发生改变,α-螺旋含量增加使得XO的结构更加紧密而不利于底物进入疏水空腔;同时,芹菜素占据底物进入活性中心的通道,也有效地抑制XO对黄嘌呤的催化活性。
