牛骨髓油脂肪酸组成与活性研究
2018-10-31帕尔哈提柔孜阿布力米提伊力木合布力阿布力孜马尔霍夫木合布力克依沙尔艾斯卡尔赵超然王成如
帕尔哈提·柔孜,阿布力米提·伊力,木合布力·阿布力孜,马尔霍夫·木合布力,克依沙尔·艾斯卡尔,赵超然,王成如
(1.中国科学院新疆理化技术研究所,新疆乌鲁木齐830011;2.中国科学院大学,北京100049;3.新疆医科大学药学院,新疆乌鲁木齐830011;4.新疆法拉丁生物科技有限责任公司研发中心,新疆乌鲁木齐830011)
畜禽骨骼主要由骨膜、骨质及骨髓等构成。骨髓是骨之精华,又是造血基质,含有蛋白质、脂肪、矿物质、骨胶原、软骨素以及维生素等对人体有营养滋补和药效功能的活性物质,其具有添骨髓、增血液、减缓衰老、延年益寿等保健功效[1-3]。尽管骨髓中含有多种活性成分,并且这些活性成分具有各式各样的功效,但由于技术及认识等方面的欠缺,经常被浪费或加工成附加值很低的产品[4-5]。国内科研单位和企业早已开展相关研究开发,但产品尚未得到大力推广,副产物-骨髓资源仍然未能被充分利用。
骨髓在我国中医药和民族医药中具有较广的使用范围,中医认为其味甘,性温,具有补血益精、止渴、止血、止带作用,主治精血亏损、虚劳赢瘦、消渴、吐衄、便血及崩漏带下等[6]。牛骨髓在民族药中被用于治疗消肿止痛,舒筋健骨等复方制剂[7]。虽然国内外学者对骨髓的蛋白与油脂进行了相关研究,但主要研究集中在疾病与骨髓移植等方面[8-9],对药效与功能性食品研发尚处于初步阶段。
研究表明,骨骼中含有许多功能成分,其中生长素是人体所需营养保健的精华[10],具有促进骨骼发育和骨伤愈合作用。利用这些特点,本研究团队研发出法拉丁牌增高用牛骨髓复合食品(国家发明专利号:ZL201410118797.5,新疆医科大学)并投入市场,该产品具有一定的提高免疫力和增高作用。骨髓中含有大量的油脂,一般含量达到90%~95%。骨髓脂肪具有治疗骨头坏死,促进糖皮质激素治疗作用,降低胆固醇含量,提高脂联素免疫等功效。随着对动植物脂肪酸活性的不断开发研究[11],脂肪酸的营养价值,以及对心脑血管和肿瘤等疾病的预防作用受到普遍关注。牛骨髓属于药食兼用食品,对其蛋白和油脂部分化学成分和生物活性尚未深入研究,作用机制和构效关系不明,导致其资源的二次回收利用率低。因此,开展牛骨髓油脂类活性物质基础研究,对其质量标准的建立,尤其是含牛骨髓健康类复合产品开发及骨髓资源综合利用提供科学依据等方面具有重要意义。
1 材料与方法
1.1 材料与试剂
牛骨髓:乌鲁木齐华凌市场牛羊肉市场D座(防疫鉴定),由新疆医科大学药学院木合布力·阿布力孜教授鉴定为新疆褐牛(Xinjiang Brown Cattle)的骨髓,经去除骨头碎片和洗去血迹后存于4℃冰箱备用。
石油醚、正己烷(分析纯):天津市百世化工有限公司;无水乙醇(分析纯):天津市汇杭化工科技有限公司;无水硫酸钠(分析纯)、无水甲醇(分析纯):天津市河东区红岩试剂厂;硫酸亚铁(分析纯):天津基准化学试剂有限公司;二甲基亚砜、水杨酸、H2O2、甲苯等均为国产分析纯;白色念球菌(批号ATCC10231)、大肠杆菌(批号ATCC11229):中国医学细菌保藏管理中心;二苯基苦基苯肼(DPPH):Sigma公司生产。
1.2 仪器与设备
Agilent 7890A气质联用仪:美国安捷伦科技公司;RE252A旋转蒸发仪:上海亚荣生化仪器厂;DHG-9123A电热恒温鼓风干燥箱:上海精宏实验设备有限公司;DF-10IS集热式恒温加热磁力搅拌器:郑州长城工贸有限公司;DT200电子分析天平:常熟市衡器厂。
1.3 方法
1.3.1 样品前处理
牛骨髓先用冷水或温水清洗3次~5次,去除血迹与骨头碎片。按骨液比1∶5(g/mL)加二次去离子水蒸煮(4 h)制备牛骨髓油,用4种溶剂(石油醚、正己烷、无水甲醇、无水乙醇)进行提取。
1.3.2 正己烷提取
称取牛骨髓油50 g,加正己烷150 mL,置于索氏提取器中,80℃浸提8 h,经减压蒸馏除去正己烷,得到黄色澄清液体。
1.3.3 石油醚提取
称取牛骨髓油 50 g,加石油醚(60-90)150 mL,置于索氏提取器中,80℃浸提8 h,经减压蒸馏除去石油醚,得到黄色澄清液体。
1.3.4 无水甲醇提取
称取牛骨髓油5 g于圆底烧瓶(50 mL)中,加无水甲醇30 mL,置于集热式恒温加热磁力搅拌器,75℃提取8 h,经减压蒸馏除去无水甲醇,得到黄色澄清液体。
1.3.5 无水乙醇提取
称取牛骨髓油5 g于圆底烧瓶(50 mL)中,加无水乙醇30 mL,置于集热式恒温加热磁力搅拌器,75℃提取8 h,经减压蒸馏除去无水乙醇,得到黄色澄清液体。
1.3.6 甲酯化
称取4种提取溶剂所制备的油脂0.1 g,经参考文献甲酯化处理[12]后,取1 mL溶液,进行气相色谱-质谱联用仪(GC-MS)分析。
1.3.7 气相色谱条件
1.3.7.1 色谱条件
Superco石英弹性毛细管柱(100 m×0.25 mm,0.25 μm);载气为高纯氦气(99.999%),恒定流量为1.0 mL/min;进样量为 1 μL,分流比为 50 ∶1;程序升温:140℃保持5 min,以4℃/min升温到200℃,保持1 min,以3℃/min升温到220℃,保持26 min;进样口温度230℃。
1.3.7.2 液相色谱条件
EI源,电子能量70 eV,离子源温度 230℃,全扫描方式,传输线温度230℃,质量扫描范围40 u~500 u。在脂肪酸的分析中,根据GC-MS中各组分保留时间以及质谱图,采用峰面积归一化法计算各脂肪酸的相对含量。
1.3.8 抗氧化活性比较
1.3.8.1 DPPH自由基清除能力[13]
取4种溶剂制备的油脂各1 mL于具塞试管中,用无水乙醇配成1 mg/mL样品溶液,各加入1 mL配制好的0.2 mmol/L DPPH-无水乙醇溶液1 mL,摇匀,37℃恒温箱恒温30 min,以蒸馏水作为参比,用酶标仪517 nm处测定吸光度。用1 mL蒸馏水代替样品溶液作为空白组,用1 mL甲醇代替DPPH-无水乙醇溶液作为对照组。样品对DPPH自由基的清除率按公式1计算。

式1中:A0为空白组吸光度;Ai为样品组吸光度;Aj为对照组吸光度。
1.3.8.2 羟自由基清除能力[13]
取4种溶剂制备的油脂各1 mL于具塞试管中,用无水乙醇配成1 mg/mL样品溶液,各加入1 mL配制好的6 mmol/L FeSO4·7H2O溶液,1 mL水杨酸-乙醇溶液,混合均匀,之后加入1 mL过氧化氢溶液使反应启动,37℃恒温箱恒温30 min,蒸馏水作为参比,510 nm处测定吸光度。用1 mL蒸馏水代替样品溶液作为空白组,用1 mL水代替过氧化氢溶液作为对照组。样品对羟自由基的清除率按公式2计算。

式2中:A0为空白组吸光度;Ai为样品组吸光度;Aj为对照组吸光度。
1.3.9 抗菌活性比较
用两种试菌白色念球菌,大肠杆菌,利用孔穴法检测其抗菌活性。取各油脂样品20 mg,用二甲基亚砜溶解,将已灭菌的滤纸片浸泡在4种溶剂所制备的油脂二甲基亚砜溶液中,至过饱和后取出晾干,用无菌镊子贴在涂有不同供试菌50 μL的培养基上,细菌37℃条件下培养24 h,记录抑菌圈直径的大小,取平均值[14]。每板贴4片,重复3组,以氨苄为阳性对照,以无待测样的二甲基亚砜试液作为空白,抑菌圈直径≤7 mm时认为样品无抑菌活性。
2 结果与分析
2.1 不同提取溶剂脂肪酸含量
4种提取溶剂所含的脂肪酸组成及含量见表1。

表1 4种提取溶剂脂肪酸组成及含量Table 1 Fatty acids composition and contents of four kinds of extract solvents

续表1 4种提取溶剂脂肪酸组成及含量Continue table 1 Fatty acids composition and contents of four kinds of extract solvents
由表1可知,4种溶剂提取的脂肪酸中不饱和脂肪酸含量均高于饱和脂肪酸,其中石油醚和正己烷、无水甲醇和无水乙醇提取方法所制备的各类脂肪酸组分和含量较接近,但也有一定差别。
4种溶剂提取的油脂中饱和脂肪酸含量均40%以上,甲醇提取部位含量最高(45.56%);主要以肉豆蔻酸(C14:0)、棕榈酸(C16:0)、软脂酸(C17:0)及硬脂酸(C18:0)为主,其中棕榈酸含量最高,其次是硬脂酸为主。单不饱和脂肪酸总含量均在50%以上,含量最高的是石油醚部位(54.64%);主要以肉豆蔻脑酸(C14:1),(Z)-十六烯酸(C16:1),顺-10-十七碳一烯酸(C17:1),油酸(C18:1)为主,其中油酸(C18:1)含量最高。多不饱和脂肪酸含量均 2%以上,主要以亚油酸(C18:2)为主,正己烷部位含量最高(3.9%),比甲醇部位多1.89倍;甲醇提取部位中高级不饱和脂肪酸种类较多。从饱和与不饱和比例来看,排序为:正己烷>石油醚>无水乙醇>无水甲醇。其中正己烷提取部位不饱和脂肪酸含量较高,故选用正己烷较好。
从饱和脂肪酸成分来分析,牛骨髓硬脂酸含量(13.41%~16.49%),棕榈酸含量(22%~24%),与人乳和常见动物乳等含量相当[15]。膳食中的棕榈酸和油酸可代替月桂酸和肉豆蔻酸[16],能够治疗血栓,由此可见,棕榈酸也是有益成分之一。硬脂酸能够减少肠道对胆固醇的吸收,降低血清和肝脏中的胆固醇含量,同时可能会对胆酸的生成有调节作用。此外,骨髓油硬脂酸含量也相当高,也是一种功能成分。
2.2 牛骨髓油4种溶剂主要脂肪酸总离子图谱
图1主要对4种溶剂所提取的脂肪酸组分相对含量高于1%的峰进行收集比较。以出峰时间为参比,每一个提取物选取了10个主要的峰,出峰时间在14 min~24 min之间,其中无水甲醇提取物分离时间较长,出峰时间在13 min~30 min之间,含量较高的脂肪酸均在19 mim~24 min之间出峰。
2.3 牛骨髓4种溶剂主要脂肪酸含量
每个提取部位脂肪酸中选取含量相对较高的10种脂肪酸进行对比分析,其出峰时间、脂肪酸含量及定性结果见表2。
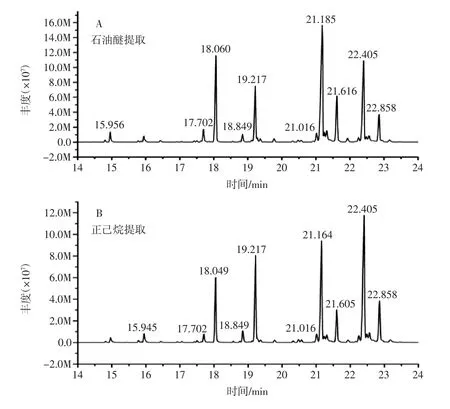

图1 4种溶剂提取部位甲酯总离子流图Fig.1 Total ionchromatograms of four kinds of extract solvents

表2 4种溶剂提取部位主要脂肪酸组成及相对含量Table 2 Main fatty acid composition and contents of extracts from four kinds of extract solvents
表1、表2和图1中的各组分定性结果由人工检索质谱标准图(Famedb23.L,NIST14.L)和人工解释所确定。石油醚、正己烷、无水甲醇、无水乙醇物中总共分离出23、37、41、27个组分,每个提取溶剂脂肪酸主峰中选用含量较高10种脂肪酸进行对比分析。石油醚提取中峰数目较少,但与正己烷提取相比,主要成分的出峰时间和含量大致相同。其中饱和脂肪酸占41.48%,不饱和脂肪酸占58.52%,且油酸在21.185 min时出峰,含量26.96%,不饱和脂肪酸(UFA)在21 min后出峰。正己烷提取中饱和脂肪酸占41.71%,不饱和脂肪酸占58.29%。其中油酸在22.405 min时出峰,含量达到25.24%。UFA在20 min后出峰,主要以油酸等为主。无水甲醇提取中组分较多,饱和脂肪酸占45.56%,不饱和脂肪酸占54.70%。其中油酸在22.710 min出峰,含量达到44.51%。UFA在25 min后出峰,主要以ω-6和ω-9为主。与其它提取物相比,该部位出现了二十碳五烯酸(EPA),α-亚麻酸等UFA成分。无水乙醇提取中饱和脂肪酸占44.45%,不饱和脂肪酸占55.75%。油酸在21.174 min时出峰,含量达到28.91%,UFA在21 min后出峰。比较四种溶剂提取物的出峰时间发现其饱和与不饱和脂肪酸交叉出峰;不饱和脂肪酸总含量大于饱和脂肪酸,但其数量和种类差别不大,牛骨髓油UFA均在20 min后出峰,这可能是骨髓油脂肪酸分离的特异性之一。经综合分析,考察相对含量和出峰时间等因素,选用正己烷作为提取溶剂较为理想。
2.4 抗氧化活性比较
4种不同溶剂所提取的油脂用无水乙醇溶解,配制1 mg/mL的样品溶液,测定其抗氧化能力,两种自由基的清除能力如图2。
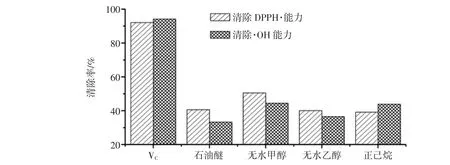
图2 4种溶剂提取的脂肪酸DPPH·与·OH清除能力Fig.2 DPPH·and·OH radical scavenging activity of oils from four kinds of extract solvents
由图2可知,4种溶剂提取所得的牛骨髓油脂对DPPH·与·OH均有清除作用,清除率均在25%以上。无水甲醇部位的清除能力最高,清除率分别为50.56%和44.46%,这可能与无水甲醇制备中出现EPA和α-亚麻酸等有关,虽然含量极小,但这些高级多不饱和脂肪酸及其代谢产物具有激活免疫细胞活性、抗炎、等作用,而且(UFA)因自身分子结构特点,具有较强的抗氧化活性[17]。与其他3种骨髓油不同的是正己烷提取的骨髓油对·OH自由基清除能力高于DPPH·。无水甲醇提取物的抗氧化作用明显强于其他溶剂提取部位,但甲醇毒性较大,不适合用作食品类产品的提取溶剂,故建议不使用。4种不同溶剂提取部位对DPPH·和·OH的清除能力与VC相比,清除自由基作用较低,这可能由于油脂样品对自由基的清除能效具有一定的选择性,所以可另加多种抗氧化指标来进一步综合评价。
2.5 抗菌作用比较
4种不同溶剂所提取的油脂用二甲基亚砜溶解,配制20 mg/mL的样品溶液,测定其抗菌能力,两种试菌的抑制能力见表3。
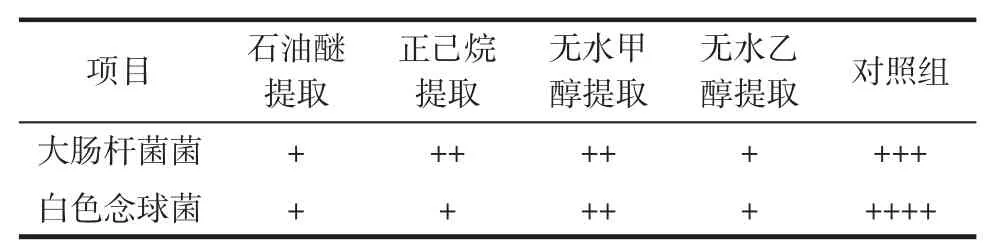
表3 4种不同溶剂提取脂肪酸的抗菌效果Table 3 Antimicrobial activity of oils from four kinds of extract solvents
由表3可知,4种溶剂提取的油脂对两种供试菌的生长均有抑菌作用,这可能与牛骨髓中游离脂肪酸对病原微生物(包括包膜病毒、衣原体和细菌)的抑制作用相关。随着脂肪酸链长增加抗菌活性增强,C8-C12酸的三、六和十缩甘油酯一般有抗菌括性,其中以癸酸和月桂酸多缩甘油脂的活性最强[18]。在不饱和脂肪酸中,棕榈油酸抗菌活性最强[19];当分子中增加第二个双键时(亚油酸)抗菌活性增强,在顺、反异构体中,顺式脂肪酸有明显的抗菌活性。4种溶剂提取的脂肪酸中棕榈酸含量均在15%以上,且组分中顺式脂肪酸含量较高,足以证明骨髓脂肪酸有抗菌活性。其中,无水甲醇提取物对两种试菌的抑制作用均强于其它3种,但在分析各提取溶剂所含成分及其可能对抗菌影响的同时,不能忽视有机溶剂残留对细菌的抑制作用,甲醇作为高极性溶剂,抑菌性能也随之较高,但对人体的神经系统和血液系统影响最大,它经消化道、呼吸道或皮肤摄入均会产生毒性反应,甲醇蒸气能损害人的呼吸道粘膜和视力,故不选用。
对抗菌和抗氧化活性综合比较可知,甲醇处于优势位置,但对其残留的控制以及使用后对人和动物存在的健康隐患进行考虑,选用正己烷作为牛骨髓油提取溶剂较为适宜。
3 讨论与结论
骨油在食品加工行业用途颇广,因动物油脂均有特有的香味,是其它植物油不能代替的品种。大量用于油炸方便面、糕点起酥、速冻食品风味香精等,还可以直接加工硬脂酸、油酸、肥皂、香皂、润滑剂、日用化妆品、蜡纸和甘油提取等[20]。骨油中含有的不饱和脂肪酸有利于胆固醇的代谢与分布,能够减少动脉硬化、防止心血管疾病,可防止肥胖,是一种新型的保健油脂[21]。从饱和度来看,牛骨髓油脂肪酸与人乳和常见动物乳等含量相当[15]。前期,猪骨油精炼和油微胶囊化包埋技术[21-22],牦牛[23],羊骨[24]与鸡骨油[25]等成分研究也取得了相关进展。但这些方法未将骨髓和骨头分开提取,与骨髓油提取率(90%~95%)相比,其提取率较低[21],导致对资源的高附加值利用程度较低。加之,动物骨油常温下呈固态,将其直接用作医药原料、食品配料等带来一定的困难。若对其进行不饱和脂肪酸的富集,高效包埋能避免氧化劣变,掩盖特殊异味,应用范围也能得到拓展。
研究发现,动物骨油SFA主要以棕榈酸,硬脂酸为主;UFA主要以油酸,亚油酸为主;两者比例接近于1∶1,与国际膳食营养素参考摄入量比例一致[21,26]。牛骨髓脂肪酸成分和含量与上述报道基本相似,其中UFA含量53%~58%,SFA含量41%~45%,棕榈酸为22%~24%,硬脂酸为13%~16%,油酸为45%~49%,亚油酸为1.9%~3%。这些数据进一步表明骨髓营养价值远远高于骨头,可作为营养素应用。亚油酸的改善免疫功能和促进生长作用较强[27],一般组织的生长依次为骨骼、皮、肌肉和脂肪,某种程度上骨髓UFA对骨细胞和脂肪细胞分化增殖方面也有一定的功效。一般牛骨做成骨汤、胶原蛋白、肽及油等,用来治疗关节炎、预防骨质疏松、NK细胞活化及提高机体免疫功能等[28-31],可推测牛骨骼药用开发利用前景广阔。骨蛋白抗氧化活性研究报道显示其清除DPPH·能力为14.95%~33.18%[32],本试验提取的牛骨髓油清除DPPH自由基能力30.45%~50.56%,比较可知,骨髓油抗氧化能力强于骨蛋白。动物油抗菌活性方面,鸵鸟油[33]对金黄色葡萄球菌无抑制活性而对白色念球菌和青霉菌有较好的抗性。另外,马油[34]对金黄色葡萄球菌、大肠杆菌、枯草芽孢杆菌、青霉菌、黑曲霉、变形杆菌、酵母菌的抑菌作用不显著,但对白色念珠菌的抑菌作用显著。本试验所提取的骨髓油对金黄色葡萄球菌均无抑制作用,对白色念球菌和大肠杆菌具有抑制活性,这可能是不同动物油的抗菌活性成分组成差异,饱和与不饱和脂肪酸含量比例关系等不同所致,但还需要多种抗菌试验加以验证。今后针对牛骨髓脂肪酸活性物质鉴定和保健食品开发,必须要增加活性评价指标,才能发现关于牛骨髓的新生物活性,从而提高应用价值。
综上所述,牛骨髓饱和与不饱和脂肪酸比例较合理,且其中含有的不饱和脂肪酸有利于胆固醇的代谢与分布、减少动脉硬化、防止心血管疾病、改善免疫功能和促进骨骼生长等方面具有潜在的开发应用效益。四种溶剂(石油醚、正己烷、无水乙醇、无水甲醇)提取的牛骨髓油 SFA/UFA比例分别为 1/1.4,1/1.41,1/1.20,1/1.25,其中正己烷提取物不饱和脂肪酸含量最高,达58.42%。对抗菌和抗氧化活性综合比较发现,正己烷作为提取溶剂较为理想。这对含牛骨髓类功能食品与药品研发及其质量标准的建立提供参考依据。
