血清维生素D水平与原发性高血压患者血管内皮功能及血浆肾素活性的关系
2018-10-31李春莉李玉梅孙小军
李春莉,李玉梅,卢 京,孙小军
(1. 云南省文山州人民医院心血管内科,云南文山 663000;2. 阳春市人民医院内科,广东阳春 529600)
维生素D缺乏症作为一种常见病已成为严重的公共卫生问题[1-2]。大多数观察数据表明,维生素D水平较低可能与血压升高有关,并且与高血压的发生风险更为密切[3-4]。动物实验研究及一些人体观察和介入数据表明,维生素D及其代谢产物与肾素-血管紧张素-醛固酮系统(renin-angiotensin-aldosterone system, RAAS)有关[5]。相关研究表明,高血压患者的血管内皮功能障碍会导致动脉僵硬度增加,是高血压患者总体死亡率的独立危险因素[6]。有少数研究报道了维生素D水平与血管内皮功能障碍及RAAS系统活化的关系。然而,到目前为止,这些关系尚未在高血压患者中进行研究。因此,本研究旨在阐明血清维生素D水平降低对原发性高血压患者血管内皮功能及血浆肾素活性(plasma renin activity, PRA)的影响。
1 资料与方法
1.1病例选择本研究共纳入2016年9月-2017年3月在云南省文山州人民医院门诊就诊的923例29~84岁原发性高血压患者。排除了146名错误的动态血压监测(ABPM)数据、85名不完整的实验室检查者及23名体检资料不完整者。最终分析了669名符合纳入和排除标准的患者。排除标准如下:明显的心血管事件(心房颤动、脑卒中、心肌梗死、慢性阻塞性外周动脉病或心力衰竭)的既往史;原发性甲状旁腺功能亢进症;与吸收不良或慢性胰腺炎有关的慢性胃肠疾病;风湿性疾病;和/或最近的急性病史、恶性疾病和药物或酒精滥用史;服用钙或维生素D补充剂。在133例无药物治疗或未经治疗干扰RAS(ACE抑制剂和血管紧张素Ⅱ1型受体拮抗剂)、SNS(β-受体阻滞剂或β受体拮抗剂)的患者中评估PRA活性、血管紧张素Ⅱ和血浆醛固酮(plasma aldosterone concentration, PAC)浓度;此外,未服用利尿剂或其他影响钙磷代谢的药物。为避免因饮食盐摄入量的差异而混淆,在指标评估前的7 d,受试者被建议摄入固定的钠饮食(每天8 g NaCl)。本研究方案获得云南省文山州人民医院伦理审查委员会的批准。
1.2指标检测过夜禁食后于次日采集患者的血液样品,并将血清以等分试样储存在-80 ℃直至分析。使用罗氏维生素D检测试剂盒(电化学发光法)测定血清维生素D含量,血清维生素D<20 ng/mL定义为缺乏。在清晨8∶30至10∶30之间收集PRA、血管紧张素Ⅱ和PAC第1份血样,静置至少30 min。平躺2 h后收集第2份血液样本。将PRA和血管紧张素Ⅱ血液样品收集在含有EDTA冰冷的Vacutainer真空采血管中。采用放射免疫法测定PRA、血浆血管紧张素Ⅱ。使用肝素作为抗凝剂收集PAC血液样品并通过放射免疫测定法测定其含量。通过自动分析仪测量生物化学参数,如血糖、钙、磷酸盐、肾功能和脂质谱。
1.3血管内皮功能所有患者在检测前4~6 h内避免运动、高脂肪饮食、喝咖啡、服用维生素C和吸烟。利用UNEXEF 38G血管内皮功能检测仪(日本Unex公司)测量血流介导的血管舒张功能(flow mediated vasodilation, FMD)。所有检测由1位有经验的操作员完成。操作人员变异<5%,内部操作变异<6%。
1.4血压测量坐位血压测量:受试者保持坐姿10 min,采用水银血压计3次测量右臂血压。ABPM监测:所有受试者在日常生活中使用MC-6800动态血压监测仪(深圳迈瑞生物医学电子有限公司)进行24 h ABPM监测。选择大小适中的袖带放在非优势手臂周围,每15 min(白天)或30 min(晚上)记录血压1次。
1.5统计学分析采用SPSS 17.0软件进行数据分析。组间比较采用χ2检验和独立样本t检验。Pearson相关性分析评估维生素D与实验室测试指标及FMD之间的相关性。采用多元逐步线性回归分析方法,确定了维生素D的独立关联,并构建了多变量回归模型。模型1:标准模型,将FMD、低密度脂蛋白胆固醇(LDL-c)、超敏C反应蛋白(hs-CRP)和PRA的所有显著变量纳入模型进行双变量分析;模型2:调整年龄和性别加上模型1;模型3:调整甲状旁腺激素水平加上模型2;模型4:调整体表面积和平均血压加上模型3。P<0.05为差异有统计学意义。
2 结 果
2.1患者的一般资料在纳入的669例患者中,有272例(40.7%)患者存在维生素D缺乏。维生素D正常组和维生素D缺乏组年龄和坐位SBP组间差异有统计学意义(P<0.05,表1)。
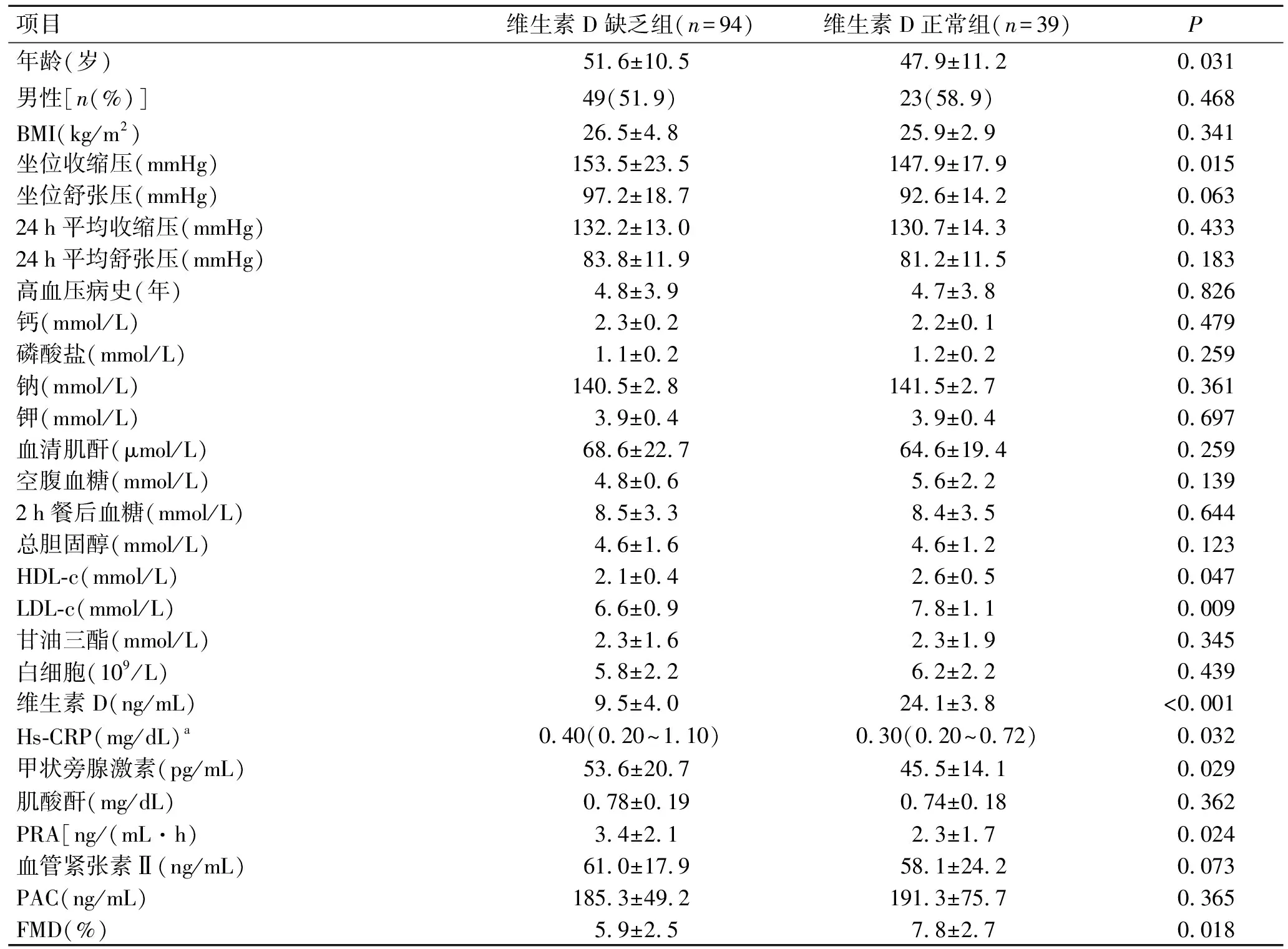
2.2无药物治疗或使用钙通道阻滞剂治疗患者的一般资料在133例无药物治疗或使用钙通道阻滞剂治疗的高血压患者中,有94名(70.7%)患者存在维生素D缺乏。维生素D正常组和维生素D缺乏组在年龄、坐位收缩压、HDL-c、LDL-c、维生素D、Hs-CRP、甲状旁腺激素、PRA、FMD组间差异均有统计学意义(P<0.05,表2)。
表1维生素D缺乏和正常组高血压患者基线临床特征和ABPM参数的比较
Tab.1 Comparison of baseline clinical characteristics and ABPM parameters between hypertensive patients with and without 25-hydroxyvitamin D deficiency

(n=669)
表2维生素D缺乏和正常组高血压患者(无药物治疗或使用钙通道阻滞剂治疗)的基线临床特征和生化特征的比较
Tab.2 Comparison of baseline clinical characteristics and biochemical features between hypertensive patients with and without 25-hydroxyvitamin D deficiency on calcium channel blocker or no medication
(n=133)
a中位数(四分位间距)。
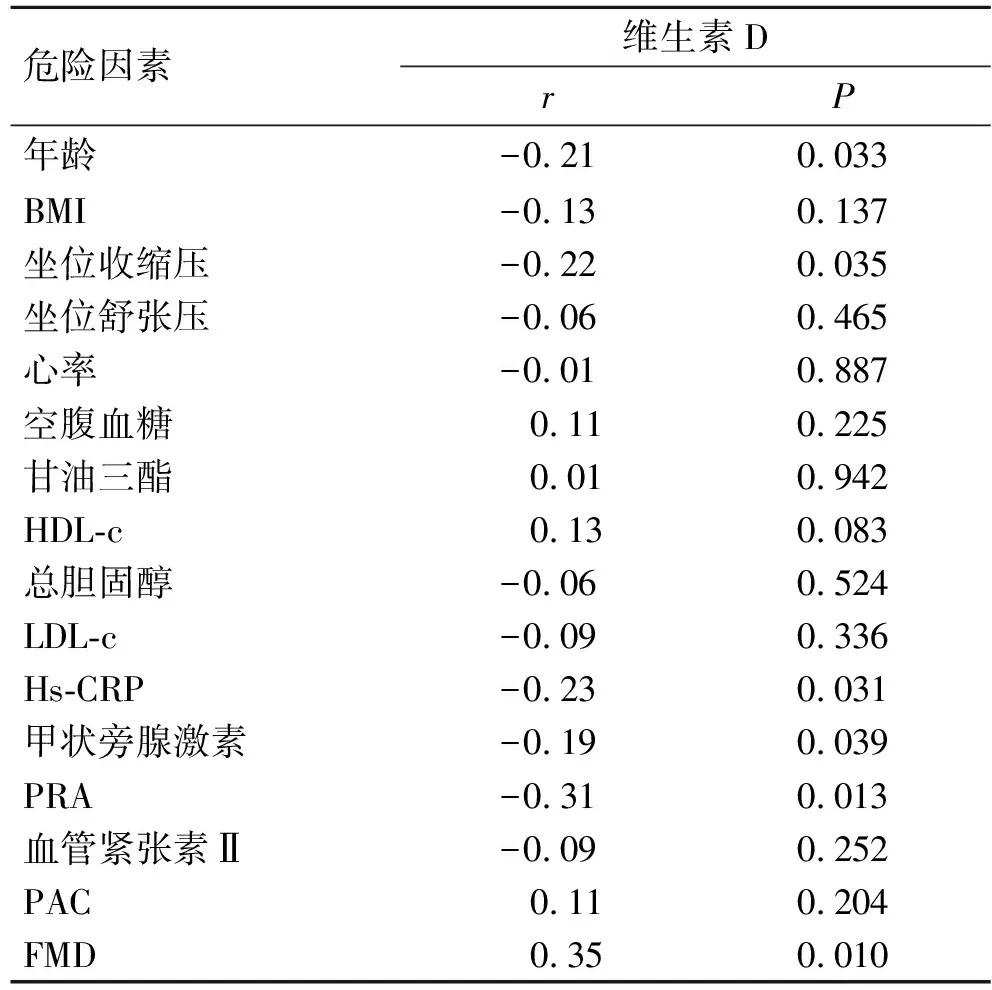
2.3原发性高血压患者疾病相关危险因素与维生素D的相关性Pearson相关性分析结果显示,维生素D与年龄(r=-0.21,P=0.033)、坐位收缩压(r=-0.22,P=0.035)、Hs-CRP(r=-0.23,P=0.031)、甲状旁腺激素(r=-0.19,P=0.039)、PRA(r=-0.31,P=0.013)和FMD(r=0.35,P=0.010)之间具有显著相关性(表3)。图1和图2显示了维生素D与PRA及FMD之间的关系。
表3原发性高血压患者疾病相关危险因素与维生素D的相关性
Tab.3 Associations of disease risk factors with 25-hydroxyvitamin D in patients with essential hypertension
(n=133)
2.4多元逐步线性回归分析在模型1中,血清维生素D与PRA(β=-0.235,P=0.002)存在负相关性,与FMD(β=0.432,P<0.001)存在正相关性。尽管在模型1和模型2中观察到维生素D与hs-CRP呈负相关(β=-0.143,P=0.047和β=-0.149,P=0.044),但在调整甲状旁腺激素后,该关联被减弱至无相关性(β=-0.130,P=0.070)。在模型1和模型2中,血清维生素D与LDL-c无相关性,但在调整甲状旁腺激素后该关联被增强至负相关(β=-0.159,P=0.027,表4)。
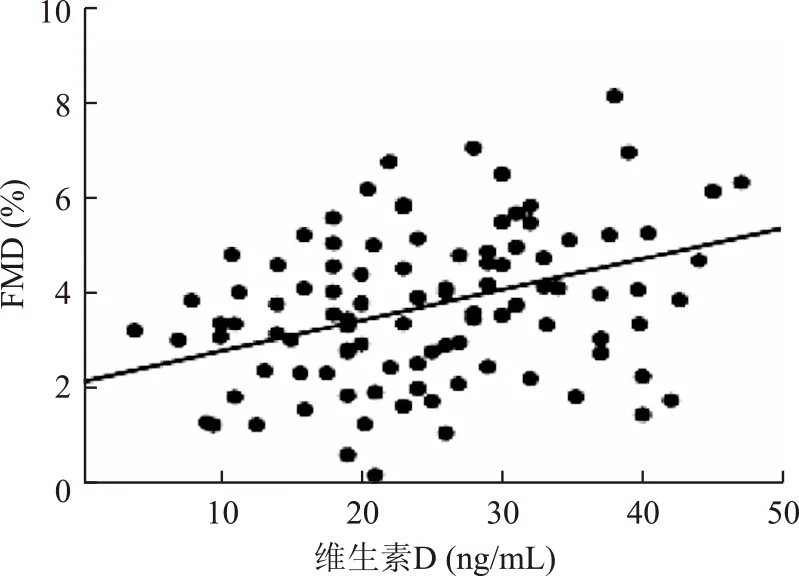
图1血清维生素D水平与FMD的相关性
Fig.1 Relationship between serum 25-hydroxyvitamin D level and FMD

图2血清维生素D水平与PRA的相关性
Fig.2 Relationship between serum 25-hydroxyvitamin D level and PRA
表4多元回归分析显示维生素D相关变量
Tab.4 Multivariate regression analysis showed variables associated with vitamin D

变量模型1βP模型2βP模型3βP模型4βPPRA-0.2350.002-0.2410.002-0.2220.003-0.305<0.001FMD0.432<0.0010.495<0.0010.463<0.0010.501<0.001LDL-c-0.1140.090-0.1350.068-0.1590.027-0.1550.027Hs-CRP-0.1430.047-0.1490.044-0.1300.070-0.1240.077
β表示标准化的β-回归系数。
3 讨 论
本研究证实,维生素D缺乏在原发性高血压患者中非常普遍,发生率约为40.7%,尤其是在无药物治疗或使用钙通道阻滞剂治疗(排除可能对维生素D水平的药理影响)患者中更高,发生率为70.7%。对此可能的解释是维生素D缺乏仅仅是多种体液因素之一,联合血液动力学不平衡、“不健康”的生活方式和遗传背景,可能会促进高血压向严重方向发展[7]。事实上,维生素D通过调节炎性细胞因子、氧化应激和RAAS系统[8],发挥心血管保护作用。此外,在本研究的高血压人群中,维生素D与PRA呈负相关性,与FMD呈正相关性,且调整年龄、性别、甲状旁腺激素水平、体表面积和平均血压并没有改变这些关联,提示维生素D的不足对RAAS系统和血管内皮功能有直接的的致病作用。
本研究结果显示,血清维生素D水平和收缩压、PRA水平呈显著负相关,与以往的报告结果一致。根据LEE等[9]的研究,收缩压但不是舒张压与维生素D浓度呈负相关。最近的一项荟萃分析也表明,补充维生素D可以降低收缩压0.16 mmHg(95%CI:-0.298~-0.022,P=0.023),但对舒张压无影响[10]。RAAS系统是维持钠水稳态和血管张力的中枢调节因子,其盐皮质激素效应在细胞外保留了盐和水,并增加了心输出量和血压[11]。许多研究已经提出了维生素D对血压影响效应的作用机制。首先,维生素D可通过形成CRE-CREB-CBP复合物来抑制肾素基因表达[12];其次,维生素D是肠道吸收钙的重要因素,因此,低水平的维生素D可能会使钙的吸收减少超过50%,导致继发性甲状旁腺功能亢进,引起血压升高[13]。本研究证实了上述观点,即在原发性高血压患者中,维生素D缺乏与甲状旁腺激素水平升高呈负相关。此外,内皮细胞、平滑肌细胞和心肌细胞中的维生素D受体可通过减少促炎因子的产生来减少周围血管的阻力,如本研究发现维生素D水平增加能抑制血清Hs-CRP释放。
血管内皮功能障碍是原发性高血压发展的关键步骤。本研究表明,高血压患者血清维生素D缺乏与血管内皮功能(FMD)障碍增加独立相关,我们的结果与先前的研究结果一致,其中包括非高血压患者。PARK等[14]研究表明,维生素D不足与导管和阻力血管中的动脉硬化和内皮功能障碍增加有关。常晶等[15]报道维生素D水平低与伴有肾功能减退老年患者动脉僵硬度增加相关。维生素D缺乏介导的内皮功能障碍的实际机制仍不清楚,但几种合理的机制可以解释维生素D如何影响内皮功能障碍。分子和细胞生物学研究表明,维生素D通过对血管平滑肌发挥抗增殖作用影响内皮细胞和平滑肌细胞功能,并通过调节淋巴细胞和单核细胞/巨噬细胞分化和释放炎性细胞因子来介导血管炎症,进而改善内皮功能[16]。此外,维生素D还通过调节RAAS来影响血管壁。降低血清维生素D水平可促进血管平滑肌的增殖,抑制内皮细胞依赖性血管舒张,并促进血管钙化[17]。有证据表明,血管钙化可能会增加动脉僵硬度,反之亦然。最后,维生素D还可以保护血管免受动脉粥样硬化、血管钙化和内皮功能障碍。维生素D的保护内皮功能作用包括抑制巨噬细胞胆固醇摄取、下调血管平滑肌细胞增殖和迁移、抑制炎症引发的内皮活化和内皮黏附分子的表达[18]。这些机制可能导致内皮功能障碍。
目前的研究有几个局限性:①在排除那些干扰RAAS的药物后,只有少数严格选择的受试者进行了研究。②血清维生素D水平随着地区、季节和海拔高度的变化而变化,这可能是由于阳光的影响。但是,本研究没有关于日照时间的数据。③本研究并不是为了区分维生素D对PRA或FMD的影响机制,因此,研究结果仅仅表明这些因素之间可能存在的相互作用,需要更多的研究去探寻其中的作用机制。④由于样本是在一家医院选取的,而且不是随机选择的,它可能不代表居住在本地区高血压患者的维生素D状况。
总之,本研究观察结果表明,维生素D缺乏症在原发性高血压患者中非常普遍,并且维生素D水平与PRA活性和FMD独立相关,未来的研究需要探索这些复杂的关系。
