肠道菌群与Treg细胞/Th17细胞平衡
2018-10-30管剑龙
陈 永,张 靓,管剑龙
(复旦大学附属华东医院,上海 200040)
对多种疾病如癌症[1]、心脑血管疾病[2]、慢性阻塞性肺疾病[3]、糖尿病[4]、风湿性疾病[5-6],以及过敏[7]等发病机制的研究中,均发现了Treg(调节性T细胞)/Th17轴的紊乱,尤其是Treg水平下降或相对下降而Th17活性增高是这类疾病的共同机制[8]。人类肠道栖息着多种多样的复杂微生物群落,在人体健康中起着非常重要的作用。据估计人体肠道中有1 000多种细菌,其基因数目是人体的100倍[9]。肠道菌群在人体健康的巨大作用包括对宿主消化、生理、营养及免疫方面的调节,可以说是我们潜在的消化器官[10],而肠道菌群的失调可导宿主机体有益或有害的变化而影响健康。目前研究发现肠道菌群失调在肠道相关疾病如肥胖[11]、营养不良[12],系统性疾病如糖尿病[13],慢性炎症性疾病如炎性肠病[14]、溃疡性结肠炎及克罗恩病中有明显的相关性[15]。而针对肠道菌群的调节显示出对各种中炎性疾病具有的潜在治疗价值。我国早在东晋时期葛洪所著的《肘后备急方》中,即有采用粪清来治疗食物中毒、腹泻、发热并濒临死亡的患者,述“饮粪汁一升,即活”的记载,相当于现代的粪便移植。
人体作为一个有机整体,在疾病的发病机制网络中常触一发而动全身[16]。肠道菌群失调可以导致免疫系统调节障碍、损害肠黏膜屏障、诱发慢性炎症。不同的肠道细菌可能对不同的免疫细胞亚群分化及功能起调节作用。作为多种疾病的两个共同发病机制学说,Treg/Th17失衡、肠道菌群失调可能会共同参与疾病状态的发生发展。目前已有部分肠道菌群通过Treg/Th17轴影响相关疾病的机制研究,本文对这一部分的研究前沿加以综述。另外,国内粪便移植相关研究尚缺乏,希望将来粪便移植能够开展更多的研究,服务更多的患者。
1 肠道菌群失调与炎症
在生理条件下,健康人群的肠道菌群对维持肠道及整个机体的免疫平衡起重要作用。研究显示肠道菌群失调,及肠道菌群的多样性改变与炎性肠病、自身免疫性疾病、哮喘、食物过敏、糖尿病、肥胖及肝硬化等多种疾病相关[17]。动物模型研究证实,肠道菌群失调可导致免疫功能紊乱,肠道黏膜屏障受损,从而引起疾病相关的慢性炎症。大量研究显示肠道菌群影响肠黏膜相关淋巴组织(GALTs)中免疫细胞的分化[18],也就是黏膜浆细胞产生T细胞依赖的针对条件致病菌及病原菌或凋亡细胞的自然IgM抗体[19]。有研究显示自然IgM抗体对固有免疫起着抑制炎症信号通路及自身免疫性疾病[20]。在识别细菌抗原之后,肠道树突状细胞(DCs)可诱导原始CD4+T细胞分化成为不同类型的效应细胞或调节性T细胞[21]。Garrett等[22]研究发现,系统性红斑狼疮患者肠道厚壁菌(Firmicutes)与拟杆菌(Bacteroidetes)比例下降。Elinav等[23]采用T-bet-/-RAG2-/-小鼠可发生自发性结肠炎,16S rRNA基因分析显示T-bet-/-RAG2-/-小鼠肺炎克雷伯菌(Klebsiellapneumoniae)和奇异变形杆菌(Proteusmirabilis)数量增加,在NLRP6缺失小鼠模型中,肠道共生菌发生了改变,并表现出对右旋糖酐硫酸酯钠诱导结肠炎的敏感性。
2 肠道菌群与Treg/Th17轴
在炎症性肠病患者中,Th17细胞积聚,并分泌IL-17等相关炎症因子,而Treg细胞相对减少[24]。Hang等[25]研究发现,肠蠕虫如类细旋线虫(Heligmosomoidespolygyrusbakeri)不经iTreg细胞分化,更重要的是从类细旋线虫感染的小鼠中分离得的Foxp3+/IL-10-和Foxp3+/IL-10+T细胞亚群可以阻止溃疡性结肠炎小鼠模型结肠炎的发生,而无此类细旋线虫感染的小鼠中分离得的Treg细胞则无此保护功能。类细旋线虫感染可激活Foxp3+T细胞。Atarashi等[26]发现在抗生素治疗的小鼠或裸鼠中肠Foxp3+Treg细胞缺失或减少,而在缺乏肠道菌群的小鼠肠道中Treg细胞不变或增加。Round等[27]研究发现脆弱拟杆菌的多聚糖A(polysaccharide A)可促进肠道CD4+T细胞向Foxp3+的Treg细胞分化及其IL-10的生成,多聚糖A在动物模型中不仅是预防,甚至是治愈结肠炎。可见脆弱拟杆菌在与宿主共生中促进了Treg细胞分化从而诱导免疫耐受。
最近的临床研究显示对于,益生菌和肠道菌群可缓解肠道疾病如炎性肠病的临床症状。IL-17是一种参与炎性肠病的炎症性细胞因子,Th17细胞及其他产生IL-17的细胞均可参与炎性肠病的病理机制。益生菌在炎症性肠病中的保护性抗炎作用可能是多种保护性机制,包括免疫调节及模式识别受体如Toll-样受体家族介导的对Th17细胞活性、IL-17的产生进行抑制。稳定状态的Th17细胞在宿主抵抗病原的过程中起重要作用。有趣的是,近来的研究还表明某些共生菌群如分节丝状菌(SFB)可在多种物种,包括小鼠中诱导小肠Th17细胞的分化生成[28]。
3 肠道菌群移植的运用
粪便菌群移植(fecalmicrobiotatransplantation,FMT)即采用正常人的粪便细菌采用十二指肠导管、内镜或灌肠器移植给患者改变其肠道菌群。FMT在艰难梭菌(Clostridiumdifficile)感染引起的伪膜性结肠炎患者中取得疗效[29]。因此,针对采用FMT治疗其他炎症相关性疾病如多发性硬化、炎性肠病等成为当前的研究热点。
研究显示肠道菌群可以调节肠道以外的Treg/Th17轴,特定的细菌刺激免疫机能可能对炎症性疾病有益[30]。一些特定的细菌菌种可能刺激原始淋巴细胞向诱导Treg细胞(iTreg,由幼稚T细胞抗原启动后从外周淋巴器官中直接发展而来[31])分化,尤其是共生菌中的双歧杆菌(Bifidobacterium)和梭状芽孢杆菌(Clostridiumspp.)对Treg细胞的诱导作用研究较为丰富[32]。
由于欧美艰难梭菌感染的流行,FMT获得越来越显著的关注,一些专家主张采用FMT作为艰难梭菌感染的一线治疗。2013年的一个随机对照研究显示,FMT对成人艰难梭菌感染效果非常明显,且比万古霉素单独使用更加有效[33]。FMT在实验研究中用于治疗胃肠道疾病包括结肠炎、便秘、肠易激综合征及神经系统疾病如多发性硬化、帕金森等。FMT在2013年通过美国食品药品监督管理局(FDA)作为实验性用药[34]。
4 小 结
免疫功能的紊乱是许多非感染性疾病如自身免疫、过敏、癌症等的发病原因或机制。而胃肠道是宿主免疫系统与微生物(包括共生微生物和致病微生物)最初、最基本的接触部位。
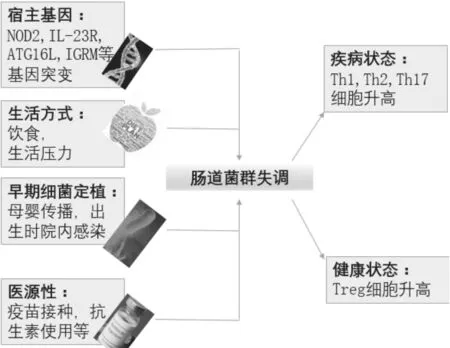
(ATG16L, autophagy-related gene 16-like; IGRM, immunity-related GTPase family M; IL23R, interleukin-23 receptor; NOD2, nucleotide-binding oligomerization domain 2; Th,辅助性T细胞; Treg, 调节性T细胞.)
图1 肠道菌群失调原因
许多因素可以导致肠道菌群失调,包括宿主基因、生活方式、暴露于病原微生物及医疗因素等(图1)。存在基因突变个体的免疫调节机制或促炎症反应通路可导致肠道过度的炎症反应,而炎症进一步作用于肠道菌群,使得肠道菌群向致病菌偏移。同样地,宿主可对某种微生物进行“选择”或清除。这种选择可以是主动的(该微生物可识别宿主特定的受体)或被动的(宿主环境更利于所选择的微生物生长)。宿主的对病原的选择性在肠道炎症中起决定性作用。饮食和生活压力也对肠道菌群有潜在的影响[35]。在无菌的医院环境中分娩的胎儿可免于暴露有害致病菌,但也切断了早期接触益生菌的机会。疫苗和抗体的滥用,也是肠道菌群失调的重要原因。
尽管FMT在原理上人粪便菌群对炎性疾病治疗可能有效,但使FMT真正的商业化面临生产、质控、病原感染风险、供体选择和患者的接受度还面临挑战。虽然中国有中医文献记载是最早开展粪便移植的历史,但目前FMT在国内尚没有正式运用于临床,相关基础研究尚缺乏。在我院,诊治白塞病是医院风湿科特色。白塞肠病的治疗虽然取得了一定成绩,但仍然面临药物耐药、不良反应等多种挑战,希望加强肠道菌群与白塞病Treg/Th17轴的研究,促进粪便移植在中国的进一步推进。
