川芎嗪注射液对重型急性胰腺炎肾损伤大鼠肾功能的保护作用及机制研究
2018-10-30沈文拥刘爱民邓明明
杨 丹,唐 静,沈文拥,吴 涛,刘爱民,邓明明
(1. 重庆市涪陵中心医院,重庆 408000;2. 泸州医学院附属医院,四川 泸州 646000)
重症急性胰腺炎(SAP)是临床上常见的急腹症,占整个急性胰腺炎的10%~20%,具有病死率高、并发症多和预后差等特点[1-2]。急性肾衰竭(ARF)是SAP最主要的并发症之一,亦是导致SAP患者死亡、住院时间延长和住院费用提高的主要原因之一,其发生率为14%~43%[3-4]。目前针对SAP合并ARF尚无特效疗法。中药川芎的有效成分川芎嗪可调节细胞凋亡,清除氧自由基,调节炎症递质的释放和增加脏器微循环血流量,广泛用于各种疾病的治疗[5-6]。本研究观察了川芎嗪注射液对SAP大鼠肾细胞的保护作用,旨在为SAP合并ARF的临床治疗提供更多参考依据。
1 实验资料
1.1实验动物 45只健康雌性SD大鼠,体质量200~250 g,由陆军医科大学附属大坪医院动物实验中心提供,标准颗粒混合饲料喂养。
1.2试剂及仪器 0.6%川芎嗪注射液(无锡第七制药厂),兔抗大鼠β-actin多克隆抗体、兔抗大鼠Bcl-2多克隆抗体和Bax多克隆抗体(SantaCruz公司),DAB显色试剂盒(上海翊圣生物科技有限公司),原位细胞凋亡(TUNEL)试剂盒(美国Roche公司)。光学显微镜(BX60,日本Olympus公司),全光谱分光光度仪(VARIOSKAN10-240VAC,德国Eppendorf公司),离心机(5415D,德国Eppendorf公司),全自动生化分析仪(Hitachi 7060,日本Olympus公司), 超低温冰箱 (8571型 ,美国Forma仪器公司),光学摄像系统(AX-70,日本Olympus公司),电热恒温培养箱(PYH-DHS-50X65-B-Ⅱ,上海跃进医疗器械厂),微量加样枪( Eppendorf,德国Eppendorf公司)
1.3实验方法 将45只雌性SD大鼠随机分为正常组、模型组和川芎嗪组,每组15只。模型组和川芎嗪组以4%牛磺胆酸钠经腹腔逆行胰胆管注射方法制备SAP模型,空白组大鼠开腹后翻动肠壁即关腹。术后10 min正常组、模型组大鼠尾静脉注射生理盐水10 mL/kg,川芎嗪组大鼠尾静脉注射0.6%川芎嗪注射液10 mL/kg。
1.4观察指标
1.4.1血清淀粉酶(AMY)、尿素氮(BUN)和肌酐(Cr)水平 分别于术后12 h、24 h和48 h,每组随机选取5只SD大鼠各抽取股动脉血5 mL,置于生化管中,用于检测血清AMY、BUN和Cr水平。
1.4.2肾组织HE染色病理表现 分别于术后12 h、24 h和48 h,每组随机抽取5只SD大鼠处死,留取约1.0 cm3肾实质组织并置于4%甲醛中固定,脱水,常规石蜡切片包埋,进行HE染色,光镜下观察肾组织的病理形态学。采用Rabb法[2]评估肾脏组织损伤情况,其中单种改变病理损伤范围>75%记为4分,单种改变病理损伤范围>25%~75%记为3分,单种改变病理损伤范围5%~25%记为2分,单种改变病理损伤范围<5%记为1分,无病理损伤记为0分。常见病理变化包括肾小管上皮细胞水肿、坏死、脱落,肾间质炎症及水肿,基底膜断裂再生,肾小球皱缩,肾小囊扩张,近曲小管的刷状缘丢失等。
1.4.3肾组织细胞凋亡指数 取1.4.2项下肾组织进行免疫组织化学染色,参照文献[1]及试剂盒说明操作。采用TUNEL法检测肾组织细胞凋亡情况,以细胞内出现棕黄色颗粒为阳性细胞,统计肾脏标本内阳性细胞数及显色度,阳性强度用半定量法:阳性细胞>75%记为3分,阳性细胞51%~75%记为2分,阳性细胞10%~50%记为1分,阳性细胞<10%记为0分;细胞着棕褐色为3分,着黄色为2分,着浅黄色为1分,不着色为0分。两者积分乘积>4分为中强度阳性(),1~4分为弱阳性(+),0分为阴性(-)。
1.4.4肾组织中Bcl-2及Bax蛋白表达情况 采用Western Blot法检测。取3块大小约1.0 cm3肾实质组织冷冻于-196 ℃液氮灌内,逐步解冻后,剪碎组织并匀浆,加入Western裂解液提取蛋白,4 ℃ 12 000 r/min离心取上清液,采用BCA试剂盒检测蛋白浓度。取20 μg蛋白样品,在10%聚丙烯酰胺凝胶上进行电泳,100 V电转印到PVDF膜上。后加入50 g/L脱脂牛奶封闭2 h,再稀释一抗4 ℃孵育过夜。PBS洗涤膜3次,将辣根过氧化物酶标记的二抗1∶2 000稀释后加入孵育,洗膜后ECL法显色剂显色并照相。用凝胶图像分析系统进行半定量分析,GAPDH为参比。
2 结 果
2.13组大鼠血清AMY、BUN及Cr水平比较 正常组大鼠各时间血清AMY、BUN及Cr水平比较差异均无统计学意义(P均>0.05);模型组和川芎嗪组大鼠各时间血清AMY、BUN、Cr水平均明显高于正常组(P均<0.05),且随着时间延长,模型组和川芎嗪组大鼠血清AMY、BUN、Cr水平均显著提高(P均<0.05),但川芎嗪组均明显低于模型组(P均<0.05)。见表1~3。
表1 3组大鼠术后不同时间点血清AMY水平比较
注:①与正常组比较,P<0.05;②与模型组比较,P<0.05。
2.23组大鼠肾脏实质组织HE染色病理表现 正常组大鼠术后各时间点肾脏组织未见异常,见图1。模型组大鼠术后12 h HE染色显示肾小管上皮细胞中重度肿胀,肾小球毛细血管淤血;术后24 h显示肾小管上皮细胞肿胀,少量坏死,细胞界限不清,炎细胞浸润,可见间质水肿,肾小球毛细血管淤血;术后48 h显示肾小管上皮细胞肿胀,明显坏死,大量炎症细胞浸润,间质明显水肿,肾小球毛细血管明显淤血,见图2。川芎嗪组大鼠术后各时间点肾小管上皮细胞肿胀程度、细胞坏死数量、炎细胞浸润及间质水肿程度均较模型组轻,见图3。模型组和川芎嗪组大鼠肾脏组织损伤病理评分显著高于正常组(P均<0.05),但川芎嗪组显著低于模型组(P均<0.05),见表4。

表2 3组大鼠术后不同时间点血清BUN水平比较
注:①与正常组比较,P<0.05;②与模型组比较,P<0.05。
表3 3组大鼠术后不同时间点血清Cr水平比较
注:①与正常组比较,P<0.05;②与模型组比较,P<0.05。
2.33组大鼠肾组织细胞凋亡指数比较 凋亡细胞主要位于肾小管上皮细胞,胞质和胞核染成棕褐色,肾间质和肾小球凋亡细胞较少。正常组大鼠术后各时间点凋亡指数比较差异均无统计学意义(P均>0.05);模型组和川芎嗪组大鼠各时间点凋亡指数均明显高于正常组(P均<0.05),且随着时间延长,模型组和川芎嗪组大鼠凋亡指数均显著提高(P均<0.05),但川芎嗪组均明显低于模型组(P均<0.05)。见表5。
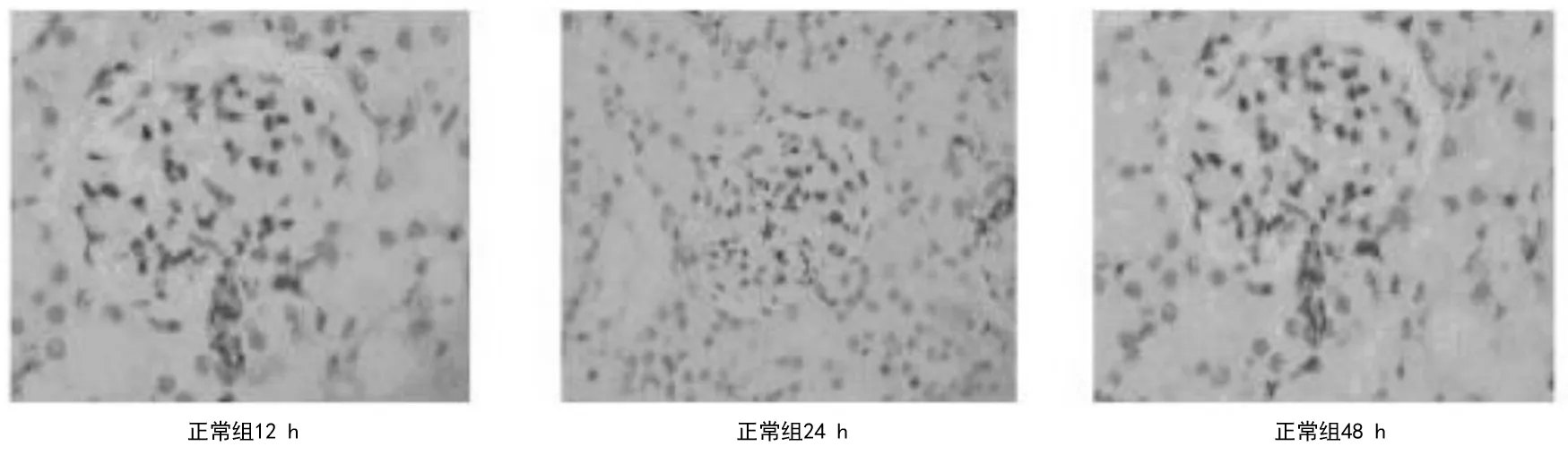
图1 正常组大鼠术后不同时间点肾脏组织HE染色表现(×400)
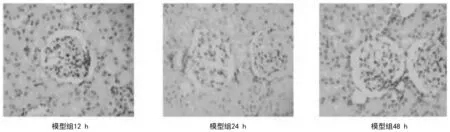
图2 模型组大鼠术后不同时间点肾脏组织HE染色表现(×400)
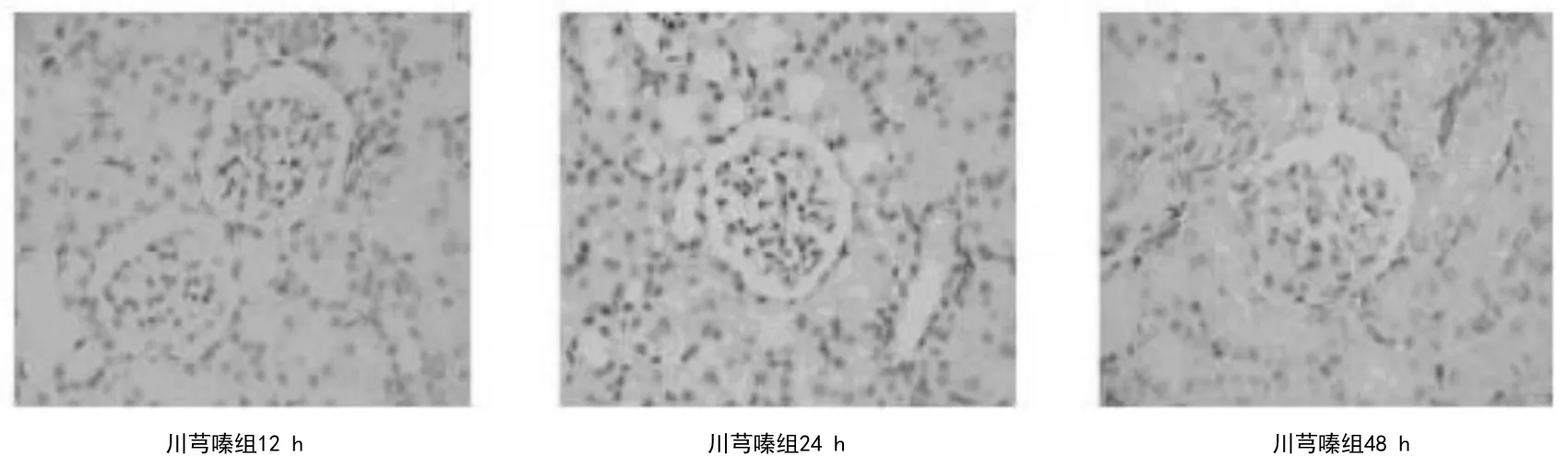
图3 川芎嗪组大鼠术后不同时间点肾脏组织HE染色表现(×400)
组别12h24h48h正常组49.98±0.920.47±0.610.42±0.39模型组56.42±0.63①8.019±1.22①7.982±1.66①川芎嗪组54.12±1.01①②4.986±0.72①②6.023±0.72①②
注:①与正常组比较,P<0.05;②与模型组比较,P<0.05。
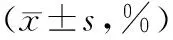
表5 3组大鼠肾组织细胞凋亡指数比较
注:①与正常组比较,P<0.05;②与模型组比较,P<0.05。
2.43组大鼠肾组织中Bcl-2、Bax蛋白表达水平比较 正常组大鼠各时间肾组织中Bcl-2、Bax蛋
白表达水平比较差异均无统计学意义(P均>0.05);模型组和川芎嗪组大鼠各时间Bax蛋白表达水平均明显高于正常组(P均<0.05),Bcl-2蛋白表达水平均明显低于正常组(P均<0.05),且随着时间延长,模型组和川芎嗪组大鼠Bcl-2、Bax蛋白表达水平变化越显著(P均<0.05),但川芎嗪组Bax蛋白表达水平均明显低于模型组而Bcl-2蛋白表达水平均明显高于模型组(P均<0.05)。见图4和表6。
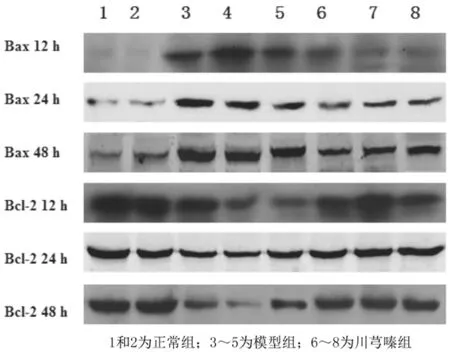
1和2为正常组;3~5为模型组;6~8为川芎嗪组图4 3组大鼠肾组织中 Bcl-2、Bax 蛋白表达情况
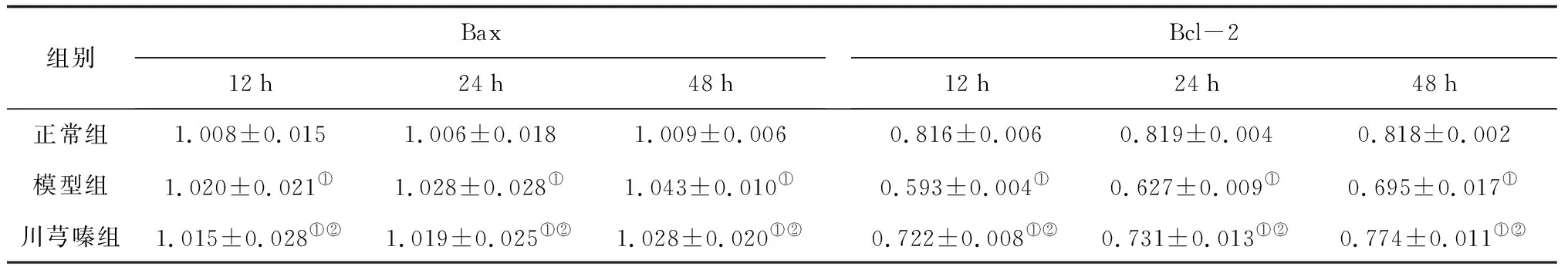
组别Bax12h24h48hBcl-212h24h48h正常组1.008±0.0151.006±0.0181.009±0.0060.816±0.0060.819±0.0040.818±0.002模型组1.020±0.021①1.028±0.028①1.043±0.010①0.593±0.004①0.627±0.009①0.695±0.017①川芎嗪组1.015±0.028①②1.019±0.025①②1.028±0.020①②0.722±0.008①②0.731±0.013①②0.774±0.011①②
注:①与正常组比较,P<0.05;②与模型组比较,P<0.05。
3 讨 论
川芎嗪是从中药川芎中分离的一种生物碱,其可改善微循环和凝血障碍,增大毛细血管口径,促使血流增快及血流增加,促进开放毛细血管数增多并抑制白细胞游走;可降低感染性坏死性SAP患者炎症递质如白细胞介素-6(IL-6)和肿瘤坏死因子-α(TNF-α)水平,减轻炎症反应对组织的损害;可减轻大鼠实验性肾小球肾炎基底膜损伤,减少渗出,阻抑新月体形成,减少蛋白尿,改善肾功能;还能促进糖尿病肾病受损内皮细胞功能修复,进而延缓糖尿病肾病进展7-10。本实验结果显示,模型组和川芎嗪组大鼠术后各时间血清AMY、BUN、Cr水平均明显高于正常组,但川芎嗪组均明显低于模型组;HE染色结果显示,川芎嗪组大鼠术后不同时间点肾小管上皮细胞肿胀程度、细胞坏死数量、炎细胞浸润及间质水肿程度均明显轻于模型组,病理评分明显低于模型组,提示川芎嗪具有保护SAP致肾损伤大鼠肾脏功能作用。
既往关于SAP大鼠肾损伤的研究发现,模型大鼠的肾脏组织细胞凋亡增加,RT-PCR检测表现为促凋亡基因Bax上调及抑凋亡基因Bcl-2下调,提示Bax和Bcl-2可能参与SAP的肾脏损害过程[11-13]。本实验结果显示,模型组大鼠肾脏组织的细胞凋亡指数、Bax蛋白表达水平均明显高于正常组,Bcl-2蛋白表达水平明显低于正常组,提示SAP肾损伤与Bcl-2和Bax蛋白异常表达相关,与上述研究结果一致;川芎嗪组大鼠术后不同时间点肾脏细胞凋亡指数、Bax蛋白表达水平明显低于模型组,Bcl-2蛋白表达水平明显高于模型组,表明川芎嗪可以抑制或减少SAP大鼠肾小管上皮细胞凋亡,发挥肾脏保护作用,可能机制在于上调Bcl-2蛋白表达和相对下调Bax蛋白表达。胡旭光等[14]研究显示,川芎嗪能够通过上调抗凋亡因子Bcl-2表达,下调软骨细胞促凋亡因子Bax以及Caspase-3表达而抑制软骨细胞的凋亡。李中华等[15]研究发现,川芎嗪可通过促进Bcl-2抑制Bax表达延缓失神经骨骼肌萎缩。韩娇艳等[16]实验发现,川芎嗪可通过调节Bcl-2及Bax表达影响前列腺癌PC3细胞增殖及凋亡。宣柳等[17]报道,川芎嗪可通过调控Bcl-2和Bax蛋白抑制AA大鼠滑膜细胞的异常增殖,诱使滑膜细胞凋亡。从上述研究可见,川芎嗪调节Bcl-2及Bax表达并不具有组织特异性,这也可能是川芎嗪具有广泛药理作用的原因之一。
综上所述,川芎嗪对SAP所致的肾损伤具有保护作用,其可能机制为促进Bcl-2蛋白表达,下调Bax蛋白表达,抑制肾小管上皮细胞凋亡,这为川芎嗪临床用于SAP 的治疗提供了一定理论依据。
