慢性阻塞性肺疾病患者组织基质金属蛋白酶-9、基质金属蛋白酶抑制剂-1及血管内皮生长因子测定的临床价值
2018-10-30卓致远付国昊
卓致远 张 琦 付国昊
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD) 是一种以气流受限为特征的慢性气道炎症性疾病,具有较高的患病率和病死率[1],给患者家庭及社会造成了严重的经济负担[2]。研究发现, COPD 的发生机制是多种因素共同作用的结果,而蛋白酶/抗蛋白酶失衡学说在其发病机制的研究中起重要作用,其中基质金属蛋白酶9(matrix metalloproteinases 9,MMP-9)和组织型金属蛋白酶抑制物-1(tissue inhibitor of metalloproteinases-1,TIMP-1)平衡失调即MMP-9 /TIMP-1 比值的变化在COPD 发病机制中发挥重要作用[3]。在近年来COPD患者发病机制中,血管新生和肺血管重构进程尤为重要,许多血管生成促进因子参与其中。其中血管内皮生长因子(vascular endothelial growth factor,VEGF)作为血小板源性生长因子(platelet derived growth factor,PDGF)的重要一员,被认为是参与血管新生和重构的最重要的因子。本研究通过检测COPD急性加重期(AECOPD)及稳定期患者血清中的MMP-9、TIMP-1及VEGF水平,并监测AECOPD 患者治疗前后血清中上述指标水平变化,探讨其与COPD不同病程阶段及肺通气功能的相关性, 以期为研究COPD 发病机制和临床诊治COPD 提供新策略。
资料与方法
1.病例资料 根据慢性阻塞性肺疾病诊治全球策略(2011 年修订版),患者在吸入支气管舒张剂后,若 FEV1/FVC<70%,即可定义为不完全可逆性气流受限,该类患者在排除其他慢性支气管肺疾病,可确诊为慢性阻塞性疾病。本研究根据以上标准,选择2015年7月至2016年6月,于我院就诊并确诊的COPD患者共73例设为COPD组,分为以下两个亚组:于本院呼吸内科住院的慢性阻塞性肺病急性加重期患者34例为A组;同期门诊随访的慢性阻塞性肺病稳定期患者39例为B组;A、B两组患者入组前均无长期吸入糖皮质激素(ICS) 及长效β2 受体激动剂(LABA) 史。选择健康体检无吸烟史或戒烟5年以上志愿者为健康对照组(C组),该组患者近1个月无呼吸系统疾病史,经病史询问、体格检查、胸X线检查、肺通气功能测定(包括支气管舒张试验)均未发现异常,共32例为对照组(C组)。所有入组患者均同意并签署知情同意书。
排除标准:不能配合肺功能检查者;严重心、肝、肾功能损害者。退出标准:患者或家属以任何理由要求中途退出治疗或随访期失联者。
2.检测方法 B组患者及C组受检者入组后清晨空腹抽血,行肺功能检查,A组患者为入院次日清晨空腹抽血并行肺功能检查。采用双抗体夹心酶联免疫吸附(enzyme-linked immunosorbent assay, ELISA)试验法检测MMP-9、TIMP-1、VEGF的浓度。肺功能检查结果记录FEV1及FCV占预计值数值。
3.肺通气功能检测 所有受试对象吸入支气管舒张剂后行肺功能通气检测,测各组研究对象用力最大肺活量(FVC)、第一秒用力呼气容积(FEV1),计算FEV1/FVC百分比及FEV1占预计值百分比,各做3次,取最佳值。
4.统计学方法 采用SPSS 21.0统计学软件包处理数据。计量资料以均数±标准差表示,两组数据比较采用独立样本t检验,三组比较采用方差分析,两组比较采用SNK法;相关性分析采用Pearson线性相关分析法。以P<0.05为差异有统计学意义。
结 果
1.共纳入本实验受检者共105例,男性66例,女性39例,年龄46~80岁,平均年龄63.2岁。COPD组和对照组受检者性别、年龄比较,差异无统计学意义(表1),具有可比性,两组受试者肺功能指标具有显著性差异(P<0.01)。
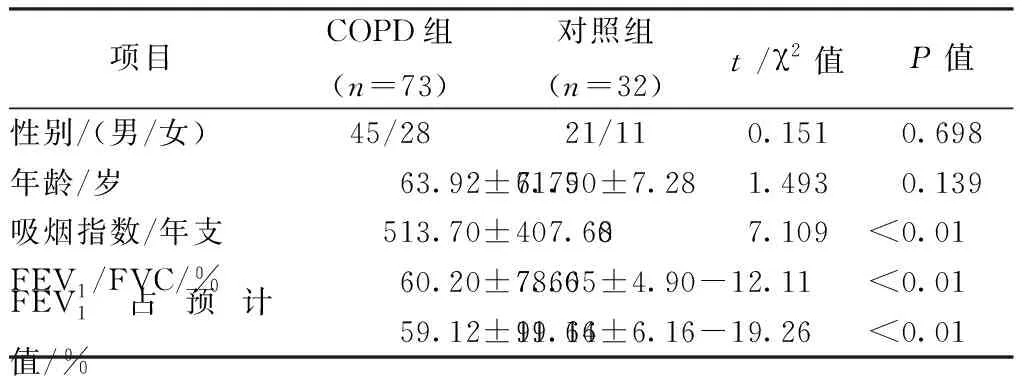
表1 两组患者一般资料
COPD 组急性加重期患者血清VEGF、MMP-9 及 TIMP-1 的水平以及MMP-9/TIMP-1比值均明显高于正常对照组,差异均有统计学意义(P<0.01)
2.COPD 组稳定期患者血清VEGF、MMP-9 及 TIMP-1 的水平以及MMP-9/TIMP-1比值均明显高于正常对照组,差异均有统计学意义(P<0.05),尤其是MMP-9、MMP/TIMP-1比值、VEGF水平差异更为显著(P<0.01,表2)。
COPD 组急性加重期VEGF、MMP-9 及 TIMP-1 的水平以及MMP-9/TIMP-1比值与稳定期相比明显升高,差异均有统计学意义(P<0.05),尤其是MMP-9、MMP/TIMP-1比值、VEGF水平差异更为显著(P<0.01)。

表2 三组受试者MMP、TIMP-1、VEGF的浓度分析
3.相关分析 (1)对 COPD急性加重期及稳定期组患者VEGF、MMP-9 及 TIMP-1 血清浓度进行相关分析,结果见表3。
COPD 组中,MMP-9 与TIMP-1存在显著正相关性,VEGF与MMP-9、TIMP-1分别具有显著的正相关性,VEGF与MMP-9/TIMP-1比值有良好的正相关性。
(2)COPD组患者VEGF、MMP-9、TIMP-1浓度与肺功能的相关性分析(表4)。
COPD组患者血浆中MMP-9、TIMP-1浓度、VEGF浓度与FEV1 /FVC%、FEV1占预计值 %均呈显著负相关性(P<0.01,图1)。MMP-9/TIMP-1浓度比值与FEV1占预计值 %呈现良好的负相关性(P<0.05),与FEV1 /FVC%成更为显著的负相关性 (P<0.01)。

表3 COPD组患者VEGF、MMP-9 及 TIMP-1 血清浓度相关分析结果

表4 VEGF、MMP-9、TIMP-1及MMP-9/TIMP-1与FEV1/FVC%,FEV1占预计值 %相关分析结果
讨 论
慢性阻塞性肺疾病是一种慢性呼吸系统疾病,COPD 是可以预防和可以治疗的常见疾病[4]。COPD 的发病机制复杂多样,目前其具体的发病机制尚未完全清楚,普遍认为其发病机制是多种因素作用的结果。蛋白酶/抗蛋白酶失衡学说是近数十年来较为广泛接受的COPD发病机制学说。研究认为,COPD发生、发展的重要原因之一是肺组织中弹性基质成分的降解,而调节细胞外基质ECM降解合成的主要酶类即本研究所涉及的MMP-9及TIMP-1[3]。
基质金属蛋白酶家族(MMPs)是进化高度保守的一类酶,能降解大部分ECM及蛋白成分,参与呼吸道构建,按底物分为明胶酶、间质胶原酶、基质溶解素、膜型基质金属蛋白酶及其他;MMP-9又称明胶酶B,是明胶酶类的主要成分,是一种锌离子依赖性内肽酶,在呼吸系统,主要由中性粒细胞、内皮细胞、巨噬细胞、单核细胞、平滑肌细胞、小胶质细胞及粒细胞等多种细胞合成和分泌[5]。MMP-9的增加加速了呼吸道管壁ECM的降解,进而使得基底膜崩裂,诱导炎性细胞在气道的聚集,增加了气道高反应性[6]。
TIMPs 是一组低分子量糖蛋白,可以抑制MMPs的活性。包括TIMP-1,TIMP-2,TIMP-3,TIMP-4四个家族成员,其中TIMP-1是MMP-9的天然组织抑制剂,正常情况下TIMP-1 以1∶1的分子比例与pro-MMP-9 或MMP-9催化区中羧基末端特异性结合形成复合物,从而特异性抑制MMP-9的活性,共同维持呼吸道壁修复及破坏之间的平衡,参与支气管、肺泡壁进行性破坏和不可逆的呼吸道重构过程[7]。
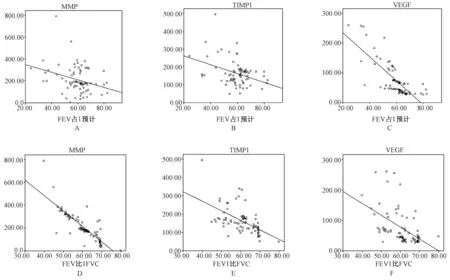
图1 COPD组MMP-9、TIMP-1浓度、VEGF浓度与FEV1 /FVC%、FEV1占预计值(%)的相关性 A:MMP-9 与FEV1占预计值(%)的相关性;B:TIMP-1与FEV1占预计值(%)的相关性;C:VEGF与FEV1占预计值(%)的相关性;D: MMP-9 与FEV1 /FVC(%)的相关性;E:TIMP-1与FEV1 /FVC(%)的相关性;F:VEGF与FEV1 /FVC(%)的相关性
目前普遍认为MMP-9、TIMP-1共同参与COPD气道炎症反应、气流受限、气道重塑、血管重建等发病过程的多个环节,MMP-9/TIMP-1比值的失衡更是与COPD肺气肿、肺心病的形成密切相关[8]。国内外学者通过测定COPD患者痰液、肺组织、血清中的MMP-9及TIMP-1的浓度,多项研究结果发现二者比例异于健康人群。Vignola等得出结论:COPD 患者的痰液中MMP-9/ TIMP-1比例下降, 且与FEV1%呈正相关, 此时以TIMP-1增多更显著[9]。而鉴于肺组织标本取得的风险性、痰标本合格率等影响因素,把MMP-9及TIMP-1在外周血浓度作为COPD患者急性加重和气道阻力的指标可以更为方便地反映特定人群气道阻力及气道重塑的变化。本研究结果显示,COPD急性加重期患者血清中MMP-9、TIMP-1含量以及MMP-9/TIMP-1比值高,稳定期患者上述指标亦增加,且前者增高更为明显。上述指标均且与气道阻力指标(包括FEV1/FVC%,FEV1占预计值%)均成负向关系,部分结果与国外学者Higashimoto研究相符[10]。
COPD的患病率及病死率在最近年来呈逐渐上升趋势, 并有可能在2020年之前成为全球第3位死亡原因[4]。气道重塑是COPD疾病进程中复杂的病理生理过程,涉及多种因素,最终导致不可逆的气流受限[11-12]。近年来,血管新生机制在COPD气道重塑中的作用受到很多学者的关注[13-14]。国内外研究认为,许多血管生成促进因子参与了血管新生和肺血管重构的进程,其中VEGF被认为是其中最重要的因子之一[15-16]。而近年来,血管VEGF信号通道在COPD气道重塑中的作用受到越来越多的关注[17-18]。近年有研究[19]认为VEGF 与COPD 的发病可能有密切关系,并参与了COPD的病情进展。
VEGF是血小板衍生生长因子家庭成员之一,分为VEGF-A, -B, -C, -D, -E六个等型,VEGFR-1、-2、-3三个血管内皮生长因子受体与各等型特异性相结合而发挥不同的生物学特性[20]。在COPD 病程中, 多种病因造成气道上皮细胞、血管内皮细胞损伤, 激活炎症反应, 刺激VEGF表达, 肺组织及血中VEGF水平升高并与VEGFR结合,促进内皮细胞增殖、增加微血管通透性,促进血管增生并修复血管损伤[21],同时刺激平滑肌细胞分裂增殖,支气管壁和血管壁的基质增厚,参与慢性炎症和血管生成,由此导致了气道重塑,临床上表现为进行性加重的气道阻塞[22-23]。
本研究COPD两个亚组血清VEGF水平均高于对照组,急性加重组升高更为显著,可能与急性加重期患者缺氧加重[24],炎症介质释放增加,肺血管重构加重,造成VEGF的高表达[25]有关。本研究亦显示,COPD患者血清VEGF水平与气道阻力指标(包括FEV1/FVC%,FEV1占预计值%)成负向关系,这进一步证实了VEGF是参与COPD血管重塑和气道重塑的重要物质,与Anna等[26]的研究结果相符。
通过本研究可以表明,MMP-9,TIMP-1与VEGF的表达与COPD严重程度及肺功能程度密切相关,这与MMP-9、TIMP-1、MMP-9/TIMP-1失调的水平参与了肺气肿的形成,气道阻塞以及VEGF参与血管重塑有关。MMP-9,TIMP-1及 MMP-9/TIMP-1的比率与VEGF明确的相关关系,其内部是否存在调控机制尚需进一步细胞层面研究。在 COPD 患者中,我们可以监测其血清中 MMP-9,TIMP-1与VEGF的水平变化,预测其气道重塑、血管重塑及肺功能情况,有着良好的灵敏性及特异性。目前国内COPD患者的病情控制不良,COPD患者的生命质量远差于健康人群[27],因此在疾病早期控制病情进展尤为重要。在疾病早期或急性加重期如可适当使用两种因子的抑制剂或临床上的药物调节机体内水平的变化,预防气道和血管的重塑,以期对COPD的多个环节进行调控,更有利的减慢或逆转肺功能的进展。
