利用米酒为碳源去除农村家庭饮用地下水中硝酸盐的现场试验研究
2018-10-30黄骏宇蒋亚萍陈余道程亚平
黄骏宇,蒋亚萍,陈余道,程亚平
(桂林理工大学环境科学与工程学院,广西 桂林 541000)
近年来,硝酸盐污染已经成为许多国家和地区地下水的主要环境问题[1]。如美国一些地区地下水中硝酸盐质量浓度高达500~700 mg·L-1[2],我国川中丘陵区54.5%的地下水硝酸盐含量超过世界卫生组织 (WHO)《饮用水水质准则》的允许值[3]。华北平原一些丘陵地区地下水中硝酸盐质量浓度高达313 mg·L-1[4]。有研究表明,长期饮用硝酸盐浓度过高的地下水能引起高铁血红蛋白症,增加儿童患白血病的几率,对人体健康构成威胁[5]。硝酸盐去除技术大体分为物理化学处理技术和生物处理技术2种。物理化学去除技术包括蒸馏法、电渗析、反渗透和离子交换法等[6-7]。其中蒸馏、反渗透及离子交换法都是将硝酸盐集中在介质或废液中,并没有彻底去除硝酸盐,电渗析不仅成本高而且维护困难,生物反硝化法因其高效低耗等特点,成为目前研究较多的地下水硝酸盐污染去除方法[8]。在利用生物反硝化法去除硝酸盐的过程中,乙醇作为电子供体(碳源)投注,具有显著的应用潜力[9]。基于此,笔者所在课题组在室内利用米酒作为碳源,通过抽出处理方法对地下水中硝酸盐的去除效果进行室内研究,结果表明该方法不仅硝酸盐去除率高,而且操作简单、成本低,具有应用于农村家庭或集体饮用水处理的可行性[10-11]。然而,已有研究多以室内试验为主,且单个实验体的持续时间短[12],在野外环境条件下针对饮用水中硝酸盐的去除研究很少见,也缺乏较长时间连续运行的相关研究。为此,笔者在野外调查的基础上,以桂林市漓江东区白竹干村2个农村家庭为试验点,利用米酒作为碳源,开展现场饮用地下水中硝酸盐的去除试验研究,目的是验证该方法在现场长时间运行条件下的硝酸盐去除可行性和稳定性。
1 试验地概况
近年来桂林市城区地下水硝酸盐污染程度较明显。根据黄旋[13]对2001—2008年枯水期527个地下水水样的检测结果,桂林城区地下水硝酸盐(以N计)质量浓度均小于18 mg·L-1,全部达到GB/T 14848—2017《地下水质量标准》中的Ⅲ类水质标准。到2010年,桂林市城区地下水硝酸盐污染趋于严重,漓江东区浅层地下水硝酸盐(以N计)质量浓度为4.47~41.36 mg·L-1,平均值为16.07 mg·L-1,呈现出白竹干和半塘尾这2个高于30 mg·L-1的峰值区[13]。
研究场地处于漓江一级阶地上,地下水类型为松散岩类孔隙水,接受大气降水补给,水位埋深2~3 m,水化学类型为HCO3-Ca型,是当地居民的自备饮
用水源。近年来随着城市扩展,固体废弃物和生活污水处置不当以及养殖业发展导致地下水硝酸盐浓度明显提高。试验所选取的2个试验点地理坐标为25°18′29″ N,110°20′16″ E,其周围居民居住较密集,生活污水以及固体废弃物的不合理处置使得地下水硝酸盐浓度超标严重,经调查发现,1号试验点枯水期和丰水期的NO3-质量浓度分别达142.95和117.58 mg·L-1,2号试验点分别达122.98和116.22 mg·L-1,均超过GB 5749—2006《生活饮用水卫生标准》的允许值,基于此,选取1号和2号试验点研究利用米酒为碳源去除地下水中硝酸盐的效果。
2 材料与方法
2.1 试验装置与设计
试验装置如图1所示,由200 L聚乙烯反应桶和60 L聚乙烯储存桶组成。反应桶作为水处理装置,用黑布包裹,避免太阳直射,用于微生物进行反硝化作用去除硝酸盐。反应桶底部装填有粒径0.5~1.5 cm的砂砾,按照砂砾和水体积比1∶3确定砂量。储存桶用于储存从反应桶排出的地下水。试验用水为农村家庭压水井抽取的浅层地下水,水化学指标背景值如表1所示。1号与2号试验点同时进行试验且试验装置相同。

图1 现场试验装置示意
表1水化学指标背景值
Table1Backgroundvaluesofhydro-chemicalindicators
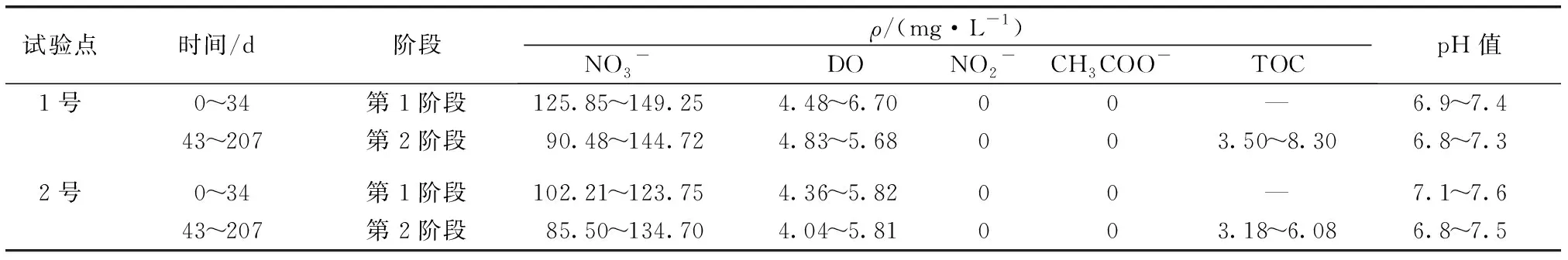
试验点时间/d阶段ρ/(mg·L-1)NO3- DONO2-CH3COO-TOCpH值 1号0~34第1阶段125.85~149.254.48~6.7000—6.9~7.4 43~207第2阶段90.48~144.724.83~5.68003.50~8.306.8~7.3 2号0~34第1阶段102.21~123.754.36~5.8200—7.1~7.6 43~207第2阶段85.50~134.704.04~5.81003.18~6.086.8~7.5
35~42 d试验装置维修,暂停1周后重启试验。“—”表示未检测。
根据农村家庭的饮用水需求量以及节能、操作方便等要求,试验采用非连续注水模式,即每3 d从反应桶出口处排放50 L水,随后通过压水井向反应桶补充等量地下水。根据课题组已有研究,添加米酒碳量与试验用水硝酸盐氮量之比(C/N比)推荐值为1.5~1.99[14-15],该试验实际采用C/N比为1.5~2.2。米酒来自于农村销售点,酒精度(即乙醇体积分数)为34%,乙醇检测质量浓度为268.26 g·L-1。结合试验点地下水硝酸盐检测浓度,1号和2号试验点每3 d投放的米酒体积介于15~22 mL之间。
2.2 取样分析
在试验开始反应阶段,每天固定时间取样分析,待试验稳定后,取样间隔增至每3 d 1次,在反应桶出水口与压水井各取1个水样,2个试验点共取4个水样。用离子色谱仪(DIONEX ICS-1000IC)分析检测NO3-、NO2-、CH3COO-浓度,用气相色谱仪(Agilent 6890N)检测乙醇浓度,分析方法参照文献[16],用总有机碳分析仪(MultiN/C 3100 TOC/TN)检测TOC和TN浓度,氨氮浓度采用由恒生生物生产的水质快速检测系列氨氮测定试剂盒进行现场测试。
3 结果与分析
3.1 硝酸盐的去除效果
试验总共进行207 d。由图2可以看出,在农村家庭环境条件下,利用米酒作为反硝化反应所需的碳源,能够达到去除地下水中硝酸盐的目的,除2号试验点在第15、75、78天分别检测出25.8、2.92和9.63 mg·L-1硝酸盐外,其余时间硝酸盐的去除率都能达到100%。在反硝化作用过程中,硝酸盐还原为氮气一般经历NO3-—NO2-—N2O—N2的过程[17]。
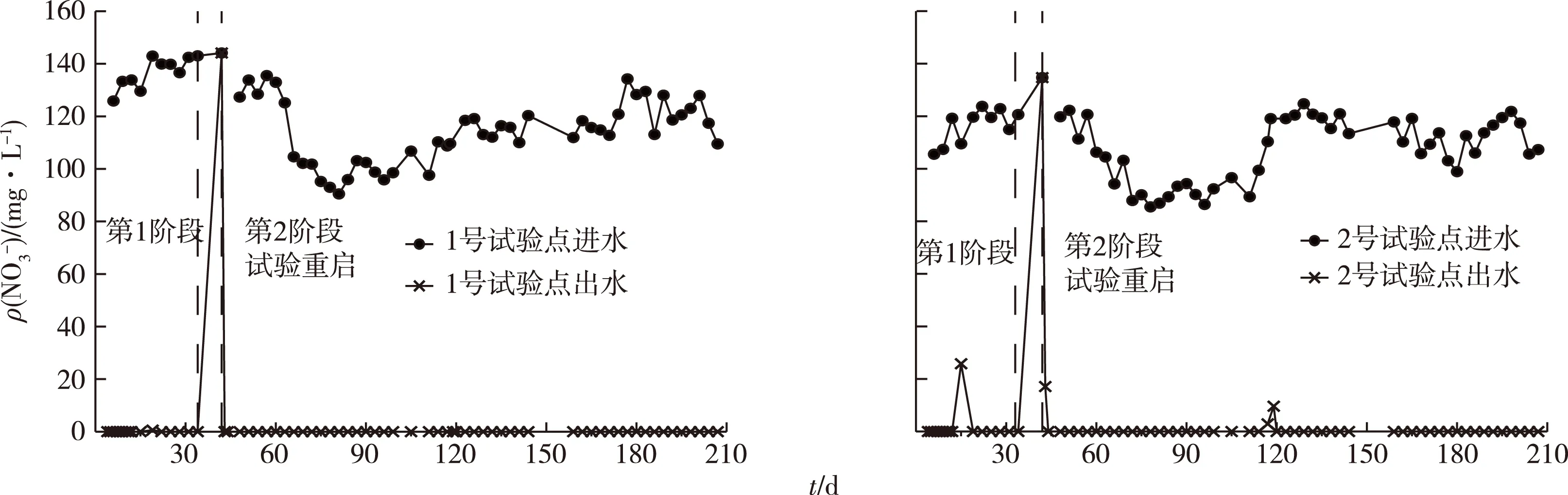
图2 1号和2号试验点进出水硝酸盐浓度变化
第1阶段试验平均气温为15 ℃,1号试验点首次进水硝酸盐质量浓度为149.25 mg·L-1,在投入米酒后,其出水口在第4天时检测不到硝酸盐,硝酸盐去除速率为37.3 mg·L-1·d-1;2号试验点首次进水硝酸盐浓度为110.40 mg·L-1,其出水口在第3天就检测不出硝酸盐,硝酸盐去除速率为36.8 mg·L-1·d-1。
第2阶段试验平均气温为20 ℃,1号试验点144.12 mg·L-1的进水硝酸盐仅用1 d时间就被完全去除,其硝酸盐去除速率为144.12 mg·L-1·d-1;2号试验点134.7 mg·L-1的进水硝酸盐也仅用2 d的时间就被完全去除,硝酸盐去除率为67.4 mg·L-1·d-1。引起硝酸盐去除速率加快的原因可能如下:一是温度的升高能促进反硝化作用的进行,使得硝酸盐的去除速率加快,这和侯卫龙等[18]反硝化试验的结果相同;二是第2阶段是在第1阶段的基础上进行的,具备第1阶段的微生物数量和活性基础,使得反硝化启动速度加快。由此也可以说明短暂的试验停止会导致出水中硝酸盐浓度反弹,但影响时间较短。
3.2 中间产物的积累和pH值变化
该装置在长期运行过程中,除了2号试验点在第15、75、78天分别检测出25.8、2.92和9.63 mg·L-1的硝酸盐外,其余时间出水硝酸盐处于未检出的状态,达到了预期的去除效果。但是,反硝化中间产物亚硝酸盐和碳源过量等问题不容忽视。
3.2.1亚硝酸盐的积累情况
在生物反硝化过程中,艾小凡等[19]研究认为碳源不足时容易生成中间产物亚硝酸盐,由于亚硝酸对人体具有毒害作用,所以碳源的投放量显得尤其重要。该试验中,2个试验点的地下水均没有检测出亚硝酸盐。由图3可以看出,第1阶段2个试验点在投放米酒的第3天后就没有检测出亚硝酸,虽然2号试验点在第15天检测出1.19 mg·L-1的亚硝酸盐,但在第18天就表现为未检出。通过对比2个阶段的试验结果可以看出,第1阶段1号桶和2号桶出水亚硝酸盐积累的时间比第2阶段长,其原因可能是在第1阶段的试验初期砂桶内的亚硝酸盐还原菌活性低且数量少,无法迅速降解由硝酸盐还原生成的亚硝酸盐。第2阶段试验是在第1阶段试验的基础上进行的,砂桶内的微生物数量多且活性强,使得砂桶内的亚硝酸盐得以迅速降解,因此出现2个砂桶出水亚硝酸盐在第2阶段积累时间少于第1阶段的现象,这与艾小凡等[19]的研究结果相吻合。在实际运用中,可利用次氯酸钠快速去除亚硝酸盐的积累[20]。
3.2.2乙酸盐与TOC的积累情况
乙酸盐与TOC一样,其是否积累与碳源的投入量有关。在反硝化作用过程中,如果投入的碳源相对充足,则容易生成中间产物乙酸。由图4可知,在第1阶段试验中,1号和2号试验点实际平均C/N比分别为1.56和1.63,乙酸盐质量浓度从没有明显检出逐渐增高到10~14 mg·L-1。

图3 1号和2号试验点出水亚硝酸盐浓度变化Fig.3 The changes of nitrite concentration of the effluent in No.1 and No.2 test spots
在第2阶段试验中,1号和2号试验点实际平均C/N比分别为1.69和1.86,乙酸盐可明显检出,最高质量浓度达26.9 mg·L-1。由表1可知,2个试验点地下水TOC背景值较低。由图5可以看出,1号试验点出水TOC平均质量浓度为12.5 mg·L-1,2号试验点为9.8 mg·L-1。
由此可知,当实际C/N比提高时,出水乙酸盐与TOC含量也相应提高,推测其原因可能是:试验所用水为农家自家压水井抽提上来的浅层地下水,其硝酸盐浓度时刻都在发生变化,这就导致投入的碳源无法做到按照理论C/N比的计算量来投放,使得实际C/N比有时偏高。
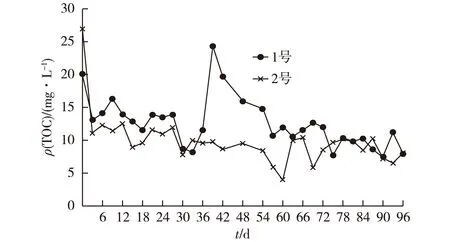
图5 1号和2号试验点出水TOC浓度变化
3.2.3pH值变化
生物反硝化作用的外界影响因素较多,其中pH值是主要的影响因素之一。有研究认为中性pH有利于反硝化作用的进行[21]。试验结果表明,2个试验点出水pH值比进水有小幅度的增高,大约提高0.8个单位。乙醇作为电子供体,硝酸盐作为电子受体发生反硝化作用的反应式为CH3CH2OH+0.8NO3-→ CH3COO-+0.4N2+0.2H++1.4H2O,CH3COO-+1.6NO3-+2.6H+→ 0.8N2+2CO2+2.8H2O。由2个反应式可以看出,在反硝化作用过程中,有碱性物质的生成使得出水pH值升高,但出水pH值始终保持在7.2~8.0之间,符合GB 5749—2006的要求(6.5~8.5)。
3.2.4氨氮与总氮检测结果
对2个试验点井水氨氮(以N计)和总氮(TN)浓度进行检测,结果显示2个试验点井水氨氮质量浓度均小于0.02 mg·L-1,1号和2号试验点井水TN质量浓度分别介于15.35~19.75与 14.21~17.83 mg·L-1之间;在投入米酒后,1号和2号试验点出水氨氮质量浓度分别为0.05~0.15和 0.04~0.2 mg·L-1,出水TN质量浓度分别为1.01~3.62和1.01~2.43 mg·L-1。由此可见,在投入米酒后,2个试验点出水氨氮浓度有所提高,但都小于GB 5749—2006的限值(0.5 mg·L-1),出水TN浓度也出现大幅降低,表明2个试验点出水受有机物和营养物质污染的程度较轻,也间接表明利用米酒去除地下水中硝酸盐是可行的。
3.3 试验方法的实用性
该试验采用简易的聚乙烯桶作为反硝化反应装置,不需要配置外在的动力装备;砂砾为普通的河砂,可以参考装置体积确定砂砾用量,提取的地下水可以一次性注入桶内,从制作到管理均适用于农村家庭条件。试验中所使用的碳源为农家自酿米酒,其来源广泛、经济便利,米酒作为人们日常生活的饮品,本身可以饮用,所以米酒作为生物反硝化作用所需的碳源不会受到用户的心理排斥。假设1瓶(500 mL)米酒价格为10元,酒精度为30%,农村家庭日饮用水量为20 L·d-1,地下水硝酸盐质量浓度为150 mg·L-1,则去除水中硝酸盐的米酒用量约为每月263 mL。米酒所需费用不到70元·a-1,这对于普通的农村家庭是可以接受的。因此该处理方法在水处理设施相对落后的农村地区具有可实践性。该次试验针对农村家庭,也可以扩展到一个集体,比如集中供水站。
4 结论
在桂林市漓江东区2个农村家庭的试验结果表明,利用米酒作为碳源,可以通过反硝化作用有效去除地下水中的硝酸盐组分。当C/N比为1.56~1.86时,长时间连续运行去除率可达100%,没有明显的亚硝酸盐积累;当碳源过量(C/N比>1.9)时,会产生乙酸盐积累,TOC浓度增加;去除过程对pH值没有明显影响。硝酸盐的去除受水温影响较明显,但可以通过改变室温来调节,经过处理后的地下水受有机物和营养物质污染程度较轻。该方法操作简单、装置简便、成本低,在农村地区具有实践价值。
