糖尿病致心房颤动机制与钙信号的关系
2018-10-27赵灿综述吴永全审校
赵灿 综述 吴永全 审校
(首都医科大学附属北京友谊医院心内科,北京100050)
心房颤动是临床上最常见也是最复杂的心律失常,发生率占总体人群的0.4%~1%,随着年龄增长会逐渐增加,年龄>80岁的老年人群中发生率可超过6%[1]。心房颤动可产生严重的临床后果:加重和诱发心力衰竭,引起血栓栓塞,导致脑卒中,具有很高的致残率和致死率。心房颤动的病因复杂,对其发病机制的探讨是目前本领域内的研究热点。近年来大量流行病学资料显示,糖尿病与心房颤动的发生密切相关,是心房颤动发生的独立、强烈的预测因子。随着全球范围内糖尿病的发病率显著增加,糖尿病相关心房颤动的发生率也将迅猛增加;然而,糖尿病诱发心房颤动的机制目前尚不明确,研究表明钙信号在糖尿病致心房颤动机制中起到非常重要的作用。
1 糖尿病与心房颤动关系的研究
中国糖尿病人口众多,成人糖尿病的患病率达9.7%,空腹血糖调节受损以及糖耐量异常的患病率达15.5%。糖尿病及空腹血糖调节受损和糖耐量异常的患病率会逐年增长[2]。
一系列大型临床试验证实了糖尿病与心房颤动之间的关系[3-4],糖尿病可以通过各种机制导致心房颤动[5]。美国一项研究[3]对比观察了1 410例新发心房颤动和2 203例非心房颤动患者,两组患者年龄、性别和危险因素均相匹配。研究发现,心房颤动患者中17.9%为需药物治疗的糖尿病患者,而非心房颤动组仅为14.1%;糖尿病与非糖尿病组患者相比,心房颤动发生的校正OR值为1.4(95%CI1.15~1.71)。该研究显示,糖尿病病程越长、血糖控制越不良的患者,心房颤动发生的风险更大。另一项大型观察性队列研究也显示了相似的结果[4],该研究以健康协作组织糖尿病注册研究人群为观察对象,包括17 372例糖尿病患者和年龄、性别相匹配的非糖尿病患者。结果显示,糖尿病和非糖尿病患者中心房颤动的患病率分别为3.6% vs 2.5%(P<0.000 1)。随访(7.2±2.8)年后的资料显示,基线水平时无心房颤动的糖尿病患者与无糖尿病患者相比,每1 000人/年心房颤动的发生分别为9.1人vs 6.6人。在一项有关糖尿病新发心房颤动的研究中[6],对这些糖尿病患者随访了4.2年的的时间,结果表明糖尿病患者出现心房颤动的比例是无糖尿病患者的1.49倍,结果同时表明,糖尿病患者出现心房颤动的风险明显上升,这是具有重大意义的公共健康问题,心房颤动和糖尿病均具有年龄相关性,糖尿病和心房颤动都随着年龄的增长而增长。
然而,尽管糖尿病与心房颤动之间存在着如此密切的联系,但糖尿病致心房颤动的机制目前还不是非常清楚,研究显示钙信号作用可能在其中起到非常重要的作用。
2 心房肌细胞“钙信号”异常是调控心房颤动的关键环节
心房颤动是脑卒中强烈的危险因素,可增加死亡率。现有的药物治疗心房颤动是不够的,无论从细胞水平还是分子水平上来讲,心房颤动的发生和维持机制都很复杂,进一步理解心律失常机制也许可以启发作者获得更安全、更有效地治疗心房颤动的方法。电重构及解剖学重构被认为是致心房颤动的重要因素,而异常钙信号是潜在的容易被忽视的促发和维持心房颤动的关键点[7]。
钙信号可表现为不同的形式,比如钙火花、钙瞬变、钙波、钙星,其中钙火花比较常见,且是钙信号的基本单元,正常情况下,心肌细胞内钙信号事件是维持动态平衡的。Ca2+通过因去极化而开放的L型钙通道(L-type calcium channels,LCC)和/或Na+-Ca2+交换体(Na+/Ca2+exchanger,NCX)进入心肌细胞内时,通过钙致钙释放(Ca2+-induced Ca2+release,CICR)机制激活雷诺定受体(ryanodine receptor,RYR);这时肌质网内Ca2+就借助顺浓度梯度流入胞质,导致胞内Ca2+浓度的瞬时增加和肌细胞收缩[8]。心脏舒张期细胞内的Ca2+浓度会下降,先前释放的钙会借助主动转运回到肌质网,这一过程是由内质网/肌质网上的Ca2+-ATP酶(sarco/endoplasmic reticum Ca2+-ATP,SERCA)参与完成的。同时Ca2+由质膜上的NCX和SERCA排出细胞外,重新达到动态平衡。
心房肌与心室肌的钙信号是不完全相同的,由于心房肌细胞缺乏橫管结构,LCC形成的电流可间接控制RYR的活性,1,4,5-三磷酸肌醇受体(inositol 1,4,5-triphosphate receptor,IP3)位于连接肌质网的位置,在空间上非常接近RYR,可以通过RYR易化CICR[9]。T管分布及数量的不同会影响信号的传导,可引起潜在的心律失常[10]。Ca2+与肌钙蛋白结合可以引起心肌的收缩,Ca2+与肌钙蛋白解离可以引起心肌的舒张,进入细胞质的Ca2+由SERCA回纳入钙库。
钙信号动态平衡的异常贯穿于心房颤动的发生发展过程中。各种致心房颤动因素可以导致钙信号调控的异常,增加钙负荷,从而产生晚期后除极或早期后除极触发心房颤动。同时,钙信号异常还可以缩短动作电位时程,缩短不应期,导致细胞内Ca2+稳态的失衡,从而促进折返进而促使心房颤动的发作与维系[11]。
Hove-Madsen等[12]利用激光共聚焦显微镜技术研究分析了41例患者心房肌细胞的钙信号数据,其中15例患者有心房颤动病史,其余的26例患者没有心律失常病史。研究发现心房颤动组钙火花频率明显高于非心房颤动患者[(6.0±1.2)s vs(2.8±0.8)s,P<0.05)],心房颤动组钙波的频率也明显高于非心房颤动患者[(2.8±0.8)s vs(1.1±0.3)s,P<0.05],Hove-Madsen等[12]同时用膜片钳技术分析了10例心房颤动患者及13例非心房颤动患者的自发内向电流,发现心房颤动患者的内向电流明显高于非心房颤动患者[(0.101±0.028)s vs(0.031±0.007)s,P<0.05]。研究认为心房颤动患者钙的释放可能与肌质网Ca2+通道有关,钙信号与心房颤动的发生密切相关。
快速心房起搏和心房颤动可引起“电重构”,所谓的电重构包括心房动作电位时程、有效不应期及心房传导速度的改变,其中心肌细胞动作电位时程缩短可引起有效不应期的缩短,可以相互影响,参与到心房颤动的发生、发展及维持过程中。L型钙通道电流(L-type calcium channel current,ICaL)的下调对心房有效不应期的缩短起主要作用,目前研究表明ICaL下调与5-羟色胺受体4密切相关[13]。心房颤动时心房肌细胞内Ca2+浓度会增高,机体为了对抗这种钙稳态的改变,ICaL通道亚单位及5-羟色胺受体4的 mRNA表达就会下调,然而下调的同时会引起心肌电生理改变,尤其是以缩短动作电位时程为主要特点。
在心力衰竭犬模型的实验中发现,心力衰竭犬的心房颤动更容易维持,这与折返和局部驱动机制有关,这可能与钙超载引起的晚期后除极和触发活动有关[15]。心房颤动患者由于房性心动过速所致的重构和心脏结构重构同时存在,这就导致了复杂的心脏功能的改变,钙信号的异常广泛参与其中。研究表明心房颤动会导致钙通道的改变[16],使LCC下调,在房性心动过速犬模型中不仅有LCC下调还有动作电位时程的缩短,钙调控的异常可以引起折返,促进心脏结构的重构。
3 糖尿病与钙信号的切合点——氧化应激
糖尿病是最常见的慢性病之一,是威胁人们生命健康的重要疾病,其并发症严重影响人类的健康生活,并且有年轻化的趋势。糖尿病患者易患心血管疾病,较非糖尿病患者多见且较重[17]。糖尿病是以糖脂代谢异常为主要表现的一种长期的进行性发展性疾病,糖尿病可以引起冠心病和糖尿病性心肌病,糖尿病可以引起明显的心肌细胞凋亡,其可能在糖尿病导致的心脏损伤中起着非常重要的作用,而活性氧(reactive oxygen species,ROS)物质的积聚和氧化应激是心肌细胞发生凋亡的重要因素。
既然心房肌细胞“钙信号”异常是调控心房颤动的关键环节,而糖尿病与氧化应激相关,心脏中包含的心脏钙通道RYR及IP3对氧化应激比较敏感,因为RYR及IP3的调节蛋白含有大量的自由硫醇,而这是ROS及硝基物质的作用靶点,因而糖尿病高血糖可以产生氧化应激进而可能影响细胞内钙通道,从而促发产生心律失常[18]。
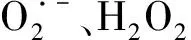
为抗衡氧化应激水平的升高,机体内存在两类抗氧化系统,一类是酶抗氧化系统,包括过氧化氢酶、谷胱甘肽过氧化物酶、超氧化物歧化酶等;另一类是非酶抗氧化系统,包括谷胱甘肽、维生素C和E、硫辛酸、辅酶Q10及微量元素如铜、锌、硒等。抗氧化系统对清除自由基、保护细胞及机体起着重要作用。正常情况下,机体通过这些抗氧化系统保持自由基体系的产生与清除的平衡。一旦平衡被打破,体内自由基会增加,同时机体抗氧化防御能力下降,当氧化能力超过抗氧化能力的时候就会发生氧化应激,引起细胞成分,如蛋白质、脂质和核酸的氧化损伤,最后可导致细胞凋亡,组织损伤导致疾病的产生。
因此糖尿病产生氧化应激机制涉及两方面:一方面细胞内ROS生成增加;另一方面抗氧化活性减低。血糖升高通过还原型烟酰胺腺嘌呤二核苷酸磷酸-依赖氧化酶、黄嘌呤氧化酶、线粒体氧化酶等一系列途径,使血管内皮细胞和心肌细胞线粒体传递链水平超氧化物过度生成,是高糖造成氧化应激的重要原因。高糖造成抗氧化蛋白糖基化或失活,造成功能蛋白抗氧化屏障弱化或失活,同时可引起细胞凋亡[20]。同时,糖尿病氧化应激还可直接抑制两种抗粥样硬化的关键酶,即内皮一氧化氮合酶和前列环素合酶,并进一步诱导促炎症因子基因表达。糖尿病可引起炎症反应,慢性炎症状态进一步造成并发症的发生和组织、结构功能异常[21]。
ONOO-水平升高所致的蛋白质硝基化,会影响细胞对糖的摄取及代谢。氧化应激可以对糖尿病患者脂肪及肌肉对葡萄糖的摄取产生损害,导致慢性高血糖状态,进而对多种细胞产生高糖毒性。高糖高脂可促使诱导型一氧化氮合成酶和还原型烟酰胺腺嘌呤二核苷酸磷酸-依赖氧化酶的表达,引起ONOO-水平升高,从而抑制凋亡的蛋白(超氧化物歧化酶、硫氧还蛋白)硝基化,减弱其抗凋亡作用,与此同时,促凋亡蛋白(JUN氨基末端激酶、细胞色素C 、p38激酶)硝基化后加强凋亡作用,增加心肌细胞损伤和凋亡[23]。
高糖导致的氧化应激可引起细胞内至少5条重要的信号通路激活:多元醇通路,晚期糖基化终末产物合成增加,晚期糖基化终末产物活性配体和受体表达增加介导氧自由基生成增加,蛋白激酶C激活,以及氨基己酸通路过度激活,引起细胞功能紊乱,参与糖尿病血管病变发生[24]。这几种信号通路的传导是有交叉的,可以相互作用相互促进,参与多种心血管疾病病理过程。
氧化应激在心肌细胞中的钙稳态异常中有着十分关键的作用。研究发现自由基能够直接损伤或从分子水平对一些重要蛋白质的活性和表达产生影响,如ATP依赖性Na+-K+-ATP酶、Ca2+-ATP酶、NCX,抑制肌质网释放Ca2+,改变Ca2+通道数量,致心肌细胞内Ca2+稳态失衡,引起钙超载[25]。 高糖能上调线粒体钙转运体mRNA及蛋白表达,而且其对高糖有时间和浓度依赖性,高糖会引起线粒体及细胞质内钙超载,增加细胞凋亡[26]。高糖可能通过氧化应激影响钙稳态,进而导致电重构形成心房颤动。
4 糖尿病、心房颤动与钙信号
尽管有很多关于心肌钙信号的实验,但心室肌细胞的研究较多见。关于心房肌细胞钙稳态及钙调控异常还有很多未知的领域,还需要进一步的探索。有证据证明钙信号在心房颤动的病理过程中发挥了重要的作用,而糖尿病可通过氧化应激影响钙稳态;心房肌细胞异常钙调控,为糖尿病致心房颤动的治疗开辟了新的道路,为糖尿病致心房颤动的机制提供了新的思路,但是在这一方法实现之前还有很多工作要做,需要大量的长期的基础和临床试验。
