饲料中添加盐酸甜菜碱对刺参幼参生长、消化酶活力和免疫力的影响
2018-10-26刘佳亮王琳超曹学彬李静李君华宋盛亮王福辰刘石林
刘佳亮,王琳超,曹学彬,李静,李君华,宋盛亮,王福辰,刘石林
(1.山东东方海洋科技股份有限公司,国家海藻与海参工程技术研究中心,山东 烟台 264003;2.中国科学院海洋研究所,山东 青岛 266071)
刺参Apostichopusjaponicus含有丰富的对人体有益的营养物质,可作为大众的保健食品,是“海产八珍”之一,也是中国北方沿海地区养殖的重要海珍品[1]。近年来,随着刺参养殖范围的逐渐扩大,作为饲料主要成分的各种大型藻类价格居高不下,养殖成本逐年增加,因此,增强刺参的摄食和消化能力、提高饲料利用率不仅可以减少养殖成本,还可以避免刺参养殖水域环境污染。另外,养殖过程中水温、盐度和人工操作等外界环境因子的变化均会造成刺参的应激反应,导致刺参摄食锐减、疾病发生。因此,寻找环保高效、无副作用的饲料添加剂成为解决上述问题的有效路径。
盐酸甜菜碱(Betaine hydrochloride,BHE),又称为甜菜碱盐酸盐,为晶体性粉末,呈白色至微黄色。甜菜碱盐酸盐是一种绝佳的富含营养的添加剂,普遍用于猪和鸡等陆生经济动物养殖中,也用于鱼类等水生动物养殖中,其功能与甜菜碱有相似之处[2]。已有研究表明,甜菜碱可促进动物生长,提供丰富的甲基作用于养殖动物体内氨基酸和脂肪酸代谢;可提高饲料引诱效果,增加水产动物摄食量,从而显著提升饲料利用率[3]。甜菜碱在预防水产鱼类动物不良应激反应及提高其对不利环境因子的耐受力中均有较好表现[4],但是甜菜碱对刺参摄食和免疫机能的影响目前尚未见报道。本试验中,以盐酸甜菜碱为添加剂,设置不同含量梯度的刺参饲料,研究BHE对刺参摄食能力、防御疾病能力和增重效果的影响,旨在摸清盐酸甜菜碱有效的添加范围,为盐酸甜菜碱在棘皮动物配合饲料中的应用提供科学依据。
1 材料与方法
1.1 材料
试验用刺参选用山东东方海洋科技股份有限公司育苗车间2017年上半年培育的刺参幼苗。挑选体质量为(2.32±0.04)g同一批次健康幼参分别暂养于水泥池(4 m×3 m×1.6 m)中。
1.2 方法
1.2.1 试验饲料的制备 基础饲料为本公司健康养殖实验中心生产的幼参配合饲料,投喂时1份基础料混合4份风干海泥,基础饲料的配方及营养水平见表1,包括藻类、微生物发酵过的豆粕、干麦麸等,粗脂肪在饲料中的比例是4.59%,粗蛋白质为19.83%。饲料级的盐酸甜菜碱购于上海市仟爵生物科技有限公司,纯度为98.0%。在基础饲料中分别添加0.2%、0.4%、0.6%和0.8%的BHE制成4种试验饲料,以不含有BHE的基础饲料为对照饲料,将刺参饲料的不同成分用搅拌机充分混匀,保存在-20 ℃的低温环境中待用。
表1基础饲料配方及营养组成(风干基础)
Tab.1Ingredientsandapproximatecompositionsofthebasaldiet(air-drybasis)
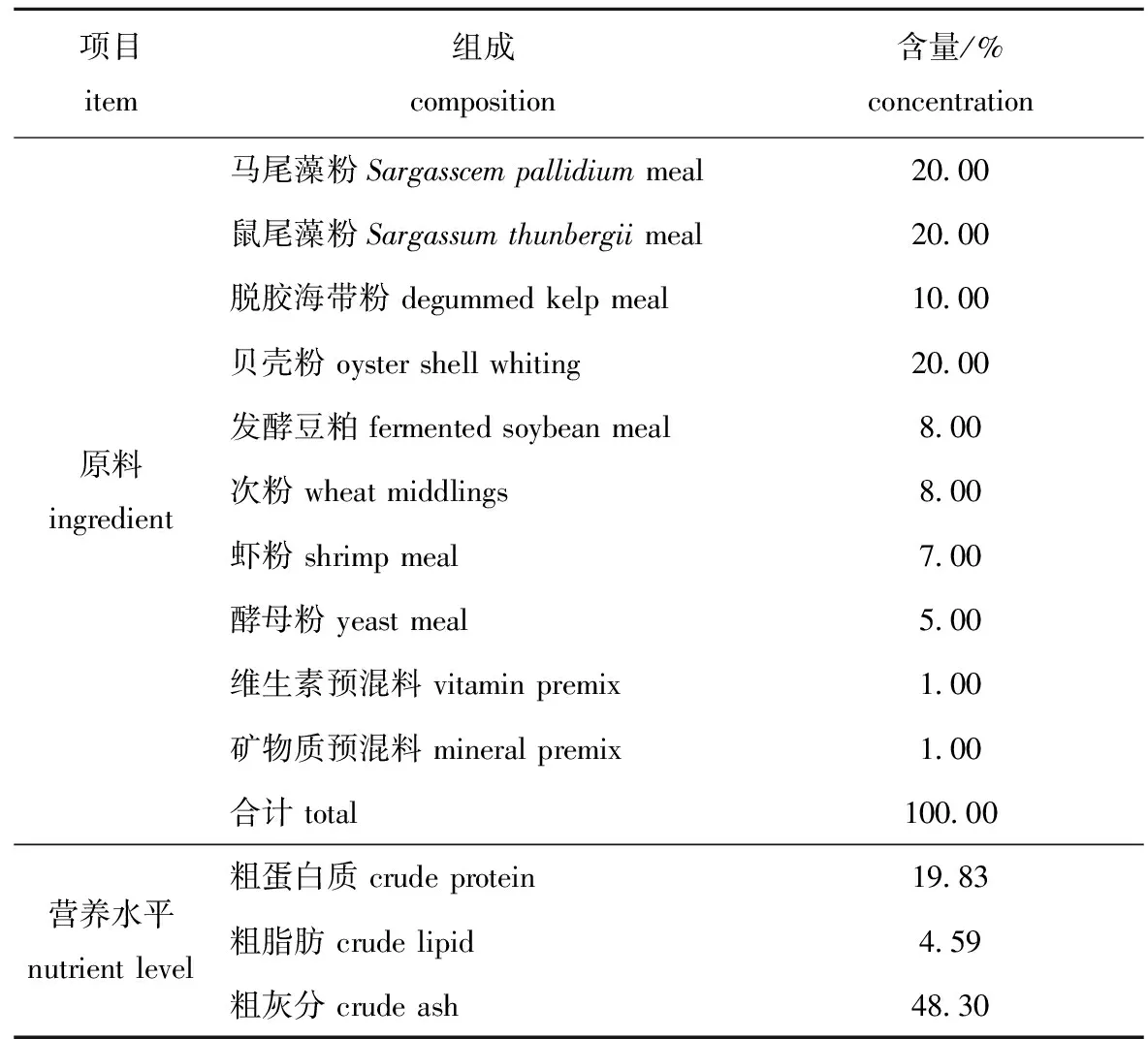
项目item组成 composition含量/%concentration原料 ingredient马尾藻粉Sargasscem pallidium meal鼠尾藻粉Sargassum thunbergii meal脱胶海带粉 degummed kelp meal贝壳粉 oyster shell whiting发酵豆粕 fermented soybean meal次粉 wheat middlings虾粉 shrimp meal酵母粉 yeast meal维生素预混料 vitamin premix矿物质预混料 mineral premix合计 total20.0020.0010.0020.008.008.007.005.001.001.00100.00营养水平nutrient level粗蛋白质 crude protein粗脂肪 crude lipid粗灰分 crude ash19.834.5948.30
1.2.2 试验设计 养殖试验容器为60 L白色塑钢水桶,每个水桶放养30头刺参,试验设5组,每组设3个重复,分别投喂添加BHE为0(对照)、0.2%、0.4%、0.6%、0.8%的饲料。试验期间,连续充气,溶氧>5 mg/L,海水盐度为33~35,水温为10.2~25.8 ℃。试验用刺参最初需要投喂基础饲料一周,使刺参适应养殖环境,在开始投喂含不同添加量的BHE饲料之前,要停喂2 d。试验于2017年8—11月在山东东方海洋科技股份有限公司刺参研究中心试验车间进行,养殖周期为90 d。试验期间,每天换水二分之一,使用自制虹吸装置清除水桶底部刺参粪便。每天用海泥混合料近饱食投喂不同组的刺参,同时依据刺参食欲增减投喂量。
1.2.3 样品的采集 试验开始时称重一次,然后在试验进行的第30、60、90 天时计数、称量每桶刺参的体质量,并从每个水桶中随机抽取5头刺参,获取组织样品。为了获取干净且无杂质的肠道,解剖刺参肠道前停食48 h。称量每个个体的体质量,称重前用吸水纸吸干刺参体表水分,称重后在盛冰的瓷盘上解剖取其肠道,除去刺参体内的呼吸树及其他不相干部分,在4 ℃下用经过双蒸水配制的 pH 7.0的磷酸缓冲液(Na2HPO4-NaH2PO4)冲洗后,再用吸水纸除去液体,置于冻存管内,-20 ℃下保存,用于消化酶和免疫指标的测定[5]。
1.2.4 指标的测定 刺参生长指标的计算公式分别为
存活率=100%×Nt/N0,
特定生长率SGR=100%×(lnWt-lnW0)/t,
出皮率=100%×Z1/Z2,
刺参干物质表观消化率[6]ADDM=100% ×
(1-S/F)。
其中:N0、Nt分别为试验开始和试验结束时刺参参数量(ind.);W0、Wt分别为试验开始时和试验结束时刺参质量(g);t为试验时间(d);Z1为刺参体壁湿质量(g);Z2为刺参湿体质量(g);S为饲料中的酸不溶性灰分含量(%);F为粪便中酸不溶性灰分含量(%)。
分别采用福林-酚试剂法和淀粉-碘显色法测定刺参肠道蛋白酶和淀粉酶活力[7]。按照南京建成生物技术公司试剂盒说明书步骤测定刺参肠道组织中的SOD和AKP活力。
1.3 数据处理
试验数据用 Excel软件进行分析处理,采用SPSS 18.0软件进行方差分析和Duncan多重比较,试验结果用平均数±标准误表示,显著性水平设为0.05。
2 结果与分析
2.1 投喂含有盐酸甜菜碱的饲料对刺参幼参生长指标和干物质表观消化率的作用效果
从表2可见:试验中各处理组刺参成活率无显著性差异(P>0.05);投喂含不同比例BHE的饲料能不同程度地提高刺参幼参的生长,当BHE含量为0.4%时,幼参的特定生长率达到最高值(P<0.05),为1.80%/d,当饲料中 BHE含量继续增加至0.6%时,幼参的特定生长率仍显著高于对照组(P<0.05),但当BHE添加量为0.8%时,幼参的特定生长率与对照组无显著性差异(P>0.05);饲料中添加BHE明显影响幼参的出皮率,BHE添加组的出皮率均高于对照组,但仅0.4%和0.6% BHE添加组刺参的出皮率显著高于对照组(P<0.05),且BHE添加量为0.4%时幼参的出皮率最高,为63.23%;BHE添加组幼参的干物质表观消化率均显著高于对照组(P<0.05),且BHE含量为0.4%时,幼参的干物质表观消化率达到最高,为10.06%。
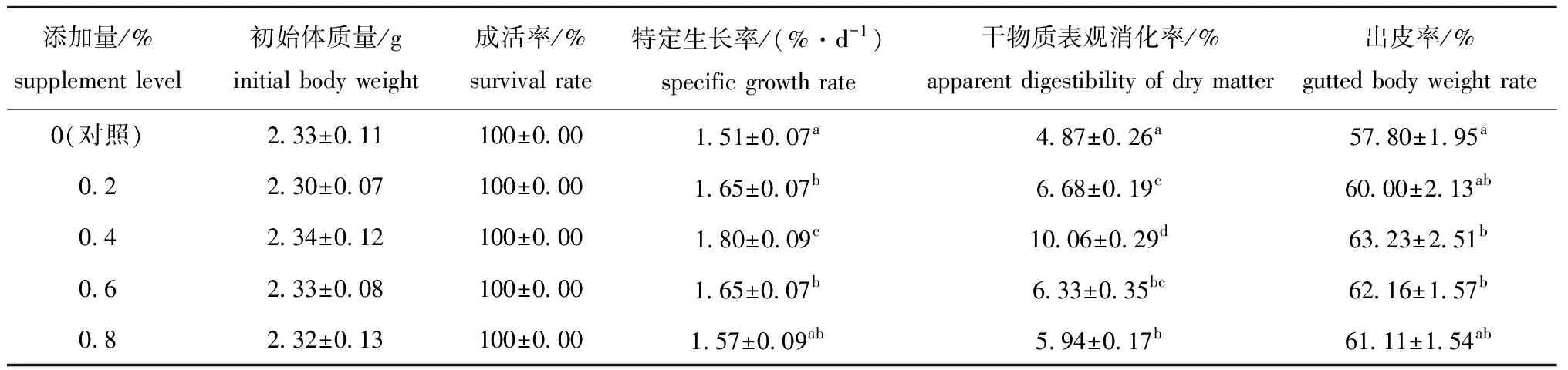
表2 饲料中加入BHE对刺参幼参生长性能和干物质表观消化率的作用Tab.2 Effects of dietary BHE on growth performance and ADDM of sea cucumber Apostichopus japonicus
注:同列中标有不同小写字母者表示组间有显著性差异(P<0.05),标有相同小写字母者表示组间无显著性差异(P>0.05),下同
Note: The means with different letters within the same column are significant differences at the 0.05 probability level,and the means with the same letters within the same column are not significant differences,et sequentia
2.2 幼参肠道消化酶活力随饲料中盐酸甜菜碱添加量的变化
从表3可见:随着试验刺参个体的不断生长,各组幼参肠道蛋白酶活力均有增加,淀粉酶活力则均有所减小;试验进行到30 d时,BHE添加组幼参肠道淀粉酶活力和蛋白酶活力均较对照组有显著增加(P<0.05),且0.4%添加组的淀粉酶活力(90.99 U/mg prot)大于其他各组,该组的肠道蛋白酶活力也达到最大值(35.87 U/mg prot);试验进行到60 d时,0.2%、0.4%、0.6% BHE添加组幼参肠道蛋白酶活力显著高于对照组(P<0.05),且0.4% BHE添加组幼参蛋白酶活力最高(41.63 U/mg prot),各BHE添加组刺参淀粉酶活力均显著低于对照组(P<0.05),而各 BHE添加组(0.2%、0.4%、0.6%)间无显著性差异(P>0.05);试验进行到90 d时,BHE添加组幼参肠道蛋白酶活力比对照组要高许多,其中,0.2%、0.4%、0.6% BHE添加组蛋白酶活力显著高于对照组(P<0.05),且0.4% BHE添加组蛋白酶活力最高,较对照组高出37.74%,各添加组淀粉酶活力均显著低于对照组(P<0.05),且BHE添加量最高(0.8%)时的淀粉酶活力最低(P<0.05)。
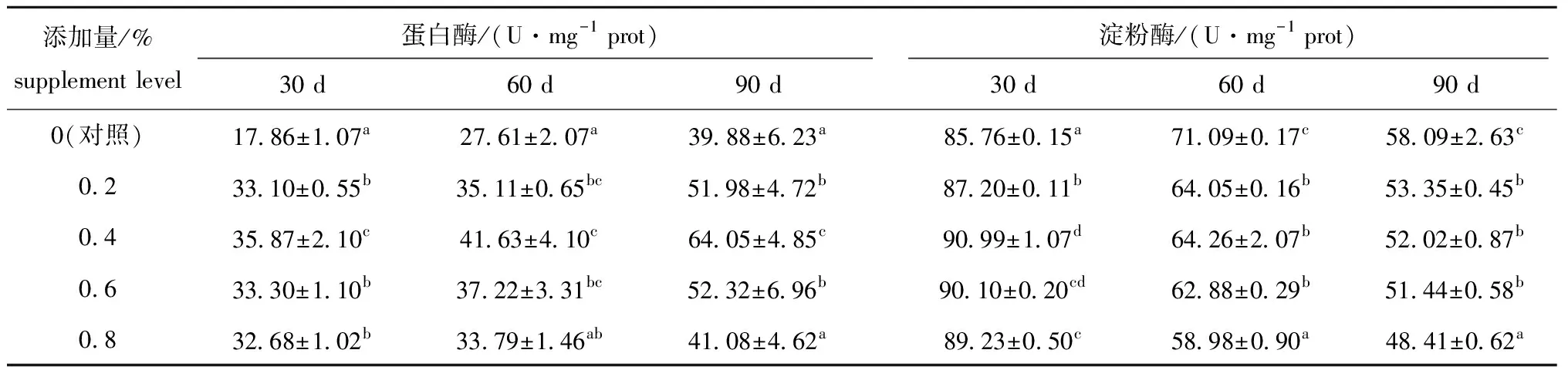
表3 饲料中加入BHE对刺参幼参肠道蛋白酶和淀粉酶活力的影响Tab.3 Effects of dietary BHE on intestinal protease and amylase activities of sea cucumber Apostichopus japonicus
2.3 幼参免疫性能随饲料中盐酸甜菜碱添加量的变化
从表4可见:与对照组相比,BHE添加组刺参的SOD、AKP活力均有不同程度增加,随着试验的进行各组刺参肠道中SOD活力呈先增加后减小的趋势,而AKP活力则呈先降低后增加的趋势。试验进行到30 d 时,0.4% BHE添加组刺参幼参肠道 SOD活力增长最快,且显著高于对照组(P<0.05),而对照组AKP活力显著低于各BHE添加组(P<0.05)。试验进行到60 d时,仅0.4% BHE添加组刺参肠道SOD活力显著高于对照组(P<0.05),其他BHE添加组SOD活力与对照组无显著性差异(P>0.05);饲料中添加BHE,可提高刺参肠道AKP活力,但仅0.4% BHE添加组肠道AKP活力与对照组有显著性差异(P<0.05)。在试验90 d时,0.4%~0.8% BHE添加组肠道SOD活力均显著高于不含盐酸甜菜碱的对照组(P<0.05),SOD活力随BHE添加量增加而升高,BHE添加量为0.8%时SOD活力最高(99.25 U/mg prot);0.2%、0.4%和0.6% BHE添加组幼参肠道AKP活力与对照组有显著性差异(P<0.05),0.4%添加组AKP活力最高(234.73 U/g prot)。
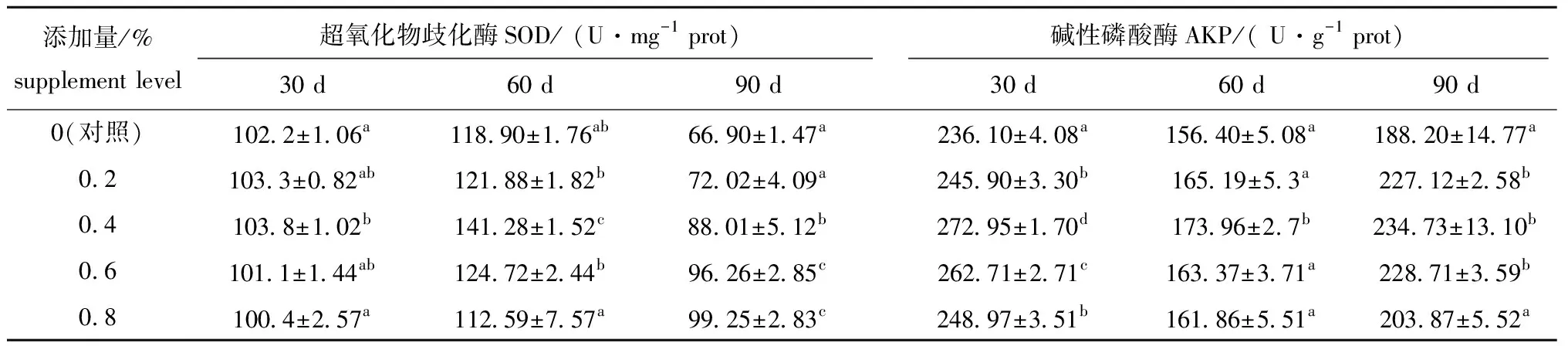
表4 饲料中加入BHE对刺参幼参肠道免疫指标的影响Tab.4 Effects of dietary betaine hydrochloride on intestinal immunity of sea cucumber Apostichopus japonicus
3 讨论
3.1 盐酸甜菜碱对刺参幼参生长指标的影响
甜菜碱可以刺激水产动物的嗅觉,并引诱动物摄食,一般在饲料中的添加量为0.5%~1.5%;甜菜碱也可以改善饲料适口性,缩短采食时间,避免残饵长时间沉积腐败污染水质。动物体内只有活化的甲硫氨酸才可以参与体内的甲基代谢,而动物本身不能合成甲硫氨酸,必须从外部环境中摄取,甜菜碱可通过相关酶的催化作用,为高半胱氨酸提供甲基后转变成甲硫氨酸[8]。本研究结果表明,含有盐酸甜菜碱的饲料能显著促进刺参幼参的生长。目前,有关诱食剂能促进养殖动物的生长已有一些报道。刘胜高[9]用含有0.6%复合甜菜碱的饲料投喂翘嘴鲌CulteralburnusBasilewsky幼鱼,其日均增重率、特定生长率均有改善,两者随复合甜菜碱添加量的增加而增大,呈先升高再降低的变化规律。杨代勤[10]用含有不同比例甜菜碱的饲料投喂黄鳝Monopterusalbus,结果显示,甜菜碱添加组较未添加组黄鳝增重加快,饲料利用率提高,添加量为1.5%~2.0%时,黄鳝生长率最高。张文超等[11]报道,投喂含甜菜碱的饲料能够改善军曹鱼Rachycentroncanadum的生长性能,添加水平为0.05%时生长性能最佳。李红霞等[12]研究表明,用含有0.1%甜菜碱的饲料投喂异育银鲫Carassaisauratusgibelio,鱼的增重率显著高于不含甜菜碱组,较对照组提高了10.28%;含有0.1%甜菜碱的试验组异育银鲫的干物质表观消化率比对照组显著增加了9.36%。本试验中,用含有0.2%~0.6% 盐酸甜菜碱的饲料进行投喂,能显著加快刺参幼参的生长,最优添加水平为0.4%,与其他学者阐述的最优添加剂量不一致,推测可能是由于刺参嗅觉功能不强,摄食行为较迟缓,造成对盐酸甜菜碱的利用率与其他动物有差异。
饲料营养的干物质表观消化率可以用来衡量不同饲料能否被水产动物有效利用,用于指导饲料配方设计。邹青[13]研究表明,进食含甜菜碱6 g/kg饲料的吉富罗非鱼Oreochromisniloticus,能量、饲料干物质、粗蛋白质的表观消化率明显高于不含甜菜碱组。Seo等[14]研究表明,使用主要成分为藻粉和豆粕的食物饲喂刺参,表观消化率超过36.0%。夏苏东[15]报道,以70%的海泥和30%的6种藻粉饲喂刺参,不同藻粉组刺参的表观消化率为9.63%~15.84%。本试验中不同盐酸甜菜碱添加组刺参幼参的干物质表观消化率变化范围为4.87%~10.06%,盐酸甜菜碱因具有良好的诱食效果,可提升刺参消化能力,故可以显著提高饲料利用率。本次试验过程中,投喂所用料的组成中有五分之四是海泥,饲料营养的干物质表观消化率低于其他学者报道中表述的干物质表观消化率。饲料中海泥含量较多估计是造成表观消化率低的原因之一。
刺参出皮率代表刺参养殖的实际产出量,高磊等[16]研究表明,不同养殖模式中刺参的出皮率为55.4%~62.7%。本试验中,刺参出皮率的变化范围为57.80%~63.23%,刺参出皮率最大时的盐酸甜菜碱添加量为0.4%,推测盐酸甜菜碱添加量为0.4%时,最有利于体壁物质的积累。
3.2 盐酸甜菜碱对刺参幼参肠道消化相关酶的影响
消化酶是机体多种酶中一部分能够起到催化消化作用的酶的统称,包括与蛋白质消化有关的蛋白酶、与淀粉分解有关的淀粉酶、与脂肪代谢有关的脂肪酶等。一些物质加入饲料中可以增加机体消化相关酶的活力,而消化酶活力的增加可以改善动物对营养成分的消化和利用。伍莉等[17]报道,饲料中添加0.5%甜菜碱的处理组较对照组斑点叉尾鮰Ictaluruspunctatus肠道的淀粉酶和蛋白酶活力显著提高。阎希柱等[18]对尼罗罗非鱼Tilapianilotica的研究显示,当饲料中含有0.5%的甜菜碱时,鱼体肠道中蛋白酶和淀粉酶的活力达到顶峰。胡武波等[19]报道,使用含有不同浓度的甜菜碱投喂黄鳝,3种酶活力随甜菜碱比例的上升,蛋白酶、淀粉酶和脂肪酶均呈上升趋势。本试验结果显示,盐酸甜菜碱添加组的幼参肠道蛋白酶活力均有提高,在试验阶段随盐酸甜菜碱添加水平的增加,幼参肠道蛋白酶活力的变化规律为先升后降。甜菜碱是高效的甲基供体,并且作为诱食剂刺激提升肠道蛋白酶活力,具有类似于蛋氨酸的性质,进而促进饲料蛋白质的吸收与转化。盐酸甜菜碱投喂初期,幼参肠道淀粉酶活力明显提高,但随着试验的进行,盐酸甜菜碱添加组刺参的淀粉酶活力均显著低于对照组,淀粉酶活力随盐酸甜菜碱添加水平的提高逐渐降低。在养殖试验开始不久,幼参肠道蛋白酶活力有显著变化,而肠道淀粉酶活力变化相对缓慢,结合出皮率的变化,推测盐酸甜菜碱能有效提高刺参机体蛋白质积累,而对碳水化合物的代谢有抑制作用,其相关机制未来需进一步探索。
3.3 盐酸甜菜碱对刺参幼参免疫性能的影响
刺参免疫包含细胞免疫和体液免疫。刺参的体液免疫是免疫相关活力因子对外来物质识别打击,同时也制造一些增加本身免疫力及保全免疫稳定的抗氧化酶类[20]。刺参体液免疫中,AKP、ACP、SOD是几种关键酶类[21]。在外界环境异物进入刺参机体时,体腔细胞会制造不同水解酶类对外来成分启动消化和处理,AKP是一种磷酸单酯水解酶,可以降解有毒有害物质,对食物的利用有关。SOD可以清除机体内过剩的氧自由基,是体内重要的抗氧化酶,使刺参免受氧自由基的危害。冯家斌等[22]研究表明,一定范围内,随甜菜碱在饲料中加入比例的上升,黄鳝体内溶菌酶和SOD活力逐渐提高,含有适量甜菜碱的饲料能够提升鱼类非特异性免疫效能,但添加过量时,溶菌酶和SOD活力反而会迅速下降。蒋雪樱等[23]报道,在日粮中添加500 g/t甜菜碱可改善肉鸡抗氧化性能,这是由于甜菜碱可通过提供甲基促进了谷胱甘肽(GSH)的合成,而 GSH是动物体内关键的抗氧化物质。在本试验中,添加不同浓度的盐酸甜菜碱可显著提高幼参肠道的SOD酶活力,证明盐酸甜菜碱可提高棘皮动物的非特异性免疫力,其原因可能是盐酸甜菜碱可通过提供甲基促进机体抗氧化物质的合成来发挥作用。今后的试验要深入研究和解释盐酸甜菜碱与幼参免疫效应的关系,对长久投喂含盐酸甜菜碱的饲料是否能持续提高刺参免疫性能,进行更深入地试验验证。
