杂合抗菌肽Scy-Hep3在毕赤酵母中的分泌表达及其抗菌活性
2018-10-26彭会王克坚
彭会,王克坚
(1.厦门大学 海洋与地球学院,福建 厦门 361102; 2.海洋生物制备技术国家地方联合工程实验室,福建 厦门 361102)
多重耐药性超级细菌频繁出现,威胁着人类健康和公共卫生安全,开发新型抗菌药物刻不容缓。抗菌肽是一类从生物体中分离的小分子多肽,广泛存在于生物界的各个门类,其进化上相对保守,在抵抗病原微生物感染方面发挥着至关重要的作用。随着对抗菌肽的深入研究发现,绝大多数抗菌肽具有多重生物学功能,不但具有抗细菌作用,还具有抗病毒、抗真菌、抗肿瘤、免疫调节和促进创伤修复等生物学功能[1-4]。研究、开发与应用抗菌肽,对解决细菌耐药性和饲料中滥用抗生素造成的药物残留及环境污染等问题具有重要的科学意义和实际应用价值。
抗菌肽Scygonadin(简记为Scy)是厦门大学海洋生物制备技术国家地方联合工程实验室2006年首次报道的从雄性拟穴青蟹Scyllaparamamosain精浆中分离鉴定的一个新型抗菌肽,在毕赤酵母Pichiapastoris表达系统中可以获得高表达,其表达产物对溶壁微球菌Micrococcuslysodeikticus、谷氨酸棒杆菌Corynebacteriumglutamicum、金黄色葡萄球菌Staphylococcusaureus、嗜水气单胞菌Aeromonashydrophila和荧光假单胞菌Pseudomonasfluorescens具有较强的抗菌活性(最小抑菌浓度MIC<25 μmol/L),并对对虾白斑病毒(WSSV)具有一定的抑杀作用[5]。Hepcidin 3 (简记为Hep3)是2013年在斜带石斑鱼Epinephecuscoioides中新发现的Hepcidin抗菌肽,不同于常见的含有8个半胱氨酸残基形成的四对二硫键的Hepcidin,其主要特点是含有4个半胱氨酸残基形成的两对二硫键,其原核表达产物能选择性地抑制革兰氏阳性和阴性菌,杀菌动力学曲线显示,12 μmol/L的重组蛋白Hep3能够在60 min内杀灭全部金黄色葡萄球菌,30 min内杀灭全部施氏假单胞菌Pseudomonasstutzeri,显示出较大的应用价值[6]。
本试验中,通过重叠延伸PCR技术构建了抗菌肽Scy和Hep3的真核融合表达载体pPIC9K-scy-hep3,在毕赤酵母 GS115菌株中诱导表达获得杂合抗菌肽Scy-Hep3,并阐明其抗菌活性和抗菌谱,旨在为杂合抗菌肽Scy-Hep3的生产和开发应用提供数据资料。
1 材料与方法
1.1 材料
1.1.1 载体与菌株 毕赤酵母表达用载体pPIC9K和菌株GS115均购自Invitrogen公司。抗菌试验用菌株:金黄色葡萄球菌、溶壁微球菌、谷氨酸棒杆菌、施氏假单胞菌、蜡样芽孢杆菌Bacilluscereus、弗氏志贺氏菌Shigellaflexneri、荧光假单胞菌和嗜水气单胞菌购自中国普通微生物菌种保藏管理中心(China General Microbiological Culture Collection Center, CGMCC)。
1.1.2 主要试剂 质粒小量中量提取试剂盒购自天根生化科技有限公司;DNA凝胶回收试剂盒购自广州东盛科技有限公司;DNA聚合酶购自全式金公司;限制性内切酶EcoRⅠ、NotⅠ、SalⅠ和DNA 连接Kit购自TaKaRa公司;酵母粉和胰蛋白胨购自OXOID公司;丙烯酰胺、N,N’-亚甲基双丙烯酰胺购自生工生物工程(上海)股份有限公司;HisTrapTMFF crude 5 mL购自GE公司;预染蛋白Marker购自Thermo Scientific公司。
1.2 方法
1.2.1 目的基因片段 根据分泌型表达载体pPIC9K上的EcoRI和NotⅠ酶切位点,以及拟穴青蟹抗菌肽scy基因的cDNA序列(GenBank登录号:AY864802)和斜带石斑鱼hep3基因的 cDNA序列(GenBank登录号:HQ008222),运用重叠延伸PCR原理设计杂合肽scy-hep3的上、下游引物,两个基因中间连接肽(Linker)的氨基酸序列为GGPGSG,其对应的碱基序列为5′ GGTGGCCCAGGTTCCGGT 3′(见表1引物F2方框内碱基序列),该段碱基序列的反向互补序列为5′ ACCGGAACCTGGGCCACC 3′(见表1 引物R1方框内碱基序列)。将连接肽的碱基序列设计成重叠互补序列,重叠区互为模板便于PCR扩增出全长目的基因片段。同时为检测目的基因的表达,在引物R2中终止密码子前引入组氨酸标签(6×His标签),大小为18 bp。使用重叠延伸PCR方法,以上述拟穴青蟹抗菌肽scy的cDNA序列和hep3的cDNA序列为模板,分别以F1和R1、F2和R2为上、下游引物,PCR扩增获得scy和hep3基因片段。然后以获得的scy基因片段和hep3基因片段为模板,以F1和R2为上、下游引物,PCR扩增获得scy-hep3目的基因片段。
表1scy-hep3目的基因扩增的上、下游引物
Tab.1PrimersusedforthepPIC9K-scy-hep3plasmidconstruction
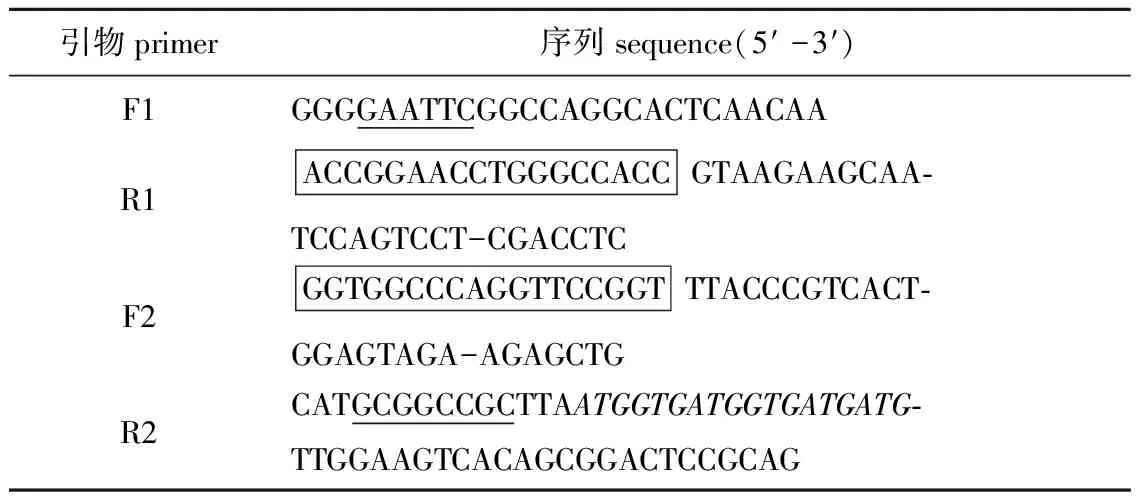
引物primer序列sequence(5′ -3′)F1GGGGAATTCGGCCAGGCACTCAACAAR1ACCGGAACCTGGGCCACCGTAAGAAGCAA- TCCAGTCCT-CGACCTCF2GGTGGCCCAGGTTCCGGTTTACCCGTCACT- GGAGTAGA-AGAGCTGR2CATGCGGCCGCTTAATGGTGATGGTGATGATG- TTGGAAGTCACAGCGGACTCCGCAG
注:其中下划线为限制性内切酶位点,方框内为重叠互补序列,斜体部分为6×His组氨酸标签
Note: The sequences of restriction enzyme sites are shown underlined and the overlap complementary sequences of F2 and R1 are shown the box.Italics indicate sequences coding the hexa-histidine tag
1.2.2 pPIC9K-scy-hep3表达载体的构建 用DNA凝胶回收试剂盒回收scy-hep3目的基因片段,scy-hep3基因片段和载体pPIC9K用EcoRⅠ和NotⅠ限制性内切酶于37 ℃下酶切5~6 h,回收酶切后的基因片段和载体,并用DNA 连接Kit在16 ℃下连接,连接后的产物转化至大肠杆菌DH5α感受态中,将转化后的菌液涂布于含100 μg/mL Amp抗生素的固体LB培养板上,37 ℃下培养过夜。任意挑取若干单克隆用F1和R2引物进行PCR扩增鉴定,并将阳性克隆送交英潍捷基贸易有限公司进行基因测序。
1.2.3 pPIC9K-scy-hep3载体的转化 将测序正确的重组质粒pPIC9K-scy-hep3用SalⅠ内切酶进行线性化,用DNA凝胶回收线性化的质粒,取10 μL回收产物与80 μL GS115感受态细胞混合均匀,用电转化的方法将目的基因整合至酵母基因组中,将转化液涂布于MD选择培养平板上,28 ℃下培养2 d,将长出的阳性单克隆分别转移至YPD平板上,以备后续高效表达菌株的筛选。
1.2.4 杂合抗菌肽Scy-Hep3的真核表达及高效表达菌株的筛选 挑取如上若干个单克隆,分别接种于10 mL BMGY(pH 6.0)培养基中,30 ℃下以230 r/min振荡培养约20 h至对数生长期,以2000g离心收集菌体,并将其重悬于10 mL BMMY表达培养基中,继续培养24 h后离心收集上清液,用SDS-PAGE检测目的蛋白的表达情况[5]。
1.2.5 抗菌肽Scy-Hep3的大量表达与纯化 将重组毕赤酵母表达菌株GS115/pPIC9K-scy-hep3表达24 h后,离心获得发酵上清液,在磷酸盐缓冲液(50 mmol/L磷酸缓冲液+50 mmol/L NaCl,pH 8.5)中透析,以12000g离心,上清液用0.45 μm滤膜进行过滤,待上柱纯化。用5个柱体积去离子水清洗HisTrap纯化柱(HisTrapTMFF Crude 5 mL),流速为2 mL/min;5个柱体积的平衡缓冲液(20 mmol/L磷酸缓冲液+50 mmol/L NaCl+10 mmol/L 咪唑,pH 8.5)平衡柱子,流速为2 mL/min;将过滤后的发酵上清液上样,流速为2 mL/min;用3~5个柱体积的平衡缓冲液过柱洗去未结合的杂蛋白;用流速1 mL/min的洗脱缓冲液(20 mmol/L磷酸缓冲液+150 mmol/L NaCl+250 mmol/L 咪唑,pH 8.5)过柱,洗脱目的蛋白,收集洗脱液并进行SDS-PAGE检测。
1.2.6 杂合抗菌肽Scy-Hep3的最小抑菌浓度的测定 最小抑菌浓度(Minimal inhibitory concentration, MIC)的测定在96孔细胞培养板上进行[7-8]。将-80 ℃下保种的金黄色葡萄球菌、溶壁微球菌、谷氨酸棒杆菌、施氏假单胞菌、蜡样芽孢杆菌、弗氏志贺氏菌、荧光假单胞菌和嗜水气单胞菌划线于营养肉汤平板上,在28 ℃或37 ℃下倒置培养过夜;从各平板上挑取菌落接种于MH培养基斜面上,继续培养12~18 h;用10 mmol/L磷酸钠缓冲液(DPBS,pH 7.2)将细菌从斜面上冲下,用酶标仪测定各个细菌在600 nm波长下的吸光值(OD600 nm),调整菌悬液浓度至OD600 nm为 0.003备用。在96孔细胞培养板上,每种被测细菌都设置阳性对照组和待测蛋白试验组,每组设置3个平行。其中阳性对照组为50 μL磷酸钠盐缓冲液和50 μL含MH培养液的菌悬液,待测蛋白试验组为50 μL待测蛋白样品和50 μL含MH培养液的菌悬液。将细胞培养板置于28 ℃培养箱中培养1 d,观察待测MIC结果。以上试验均重复3次。
2 结果与分析
2.1 目的基因片段scy-hep3的获得
以笔者所在实验室前期已获得的拟穴青蟹抗菌肽scy的cDNA序列(GenBank登录号:AY864802)和斜带石斑鱼hep3的 cDNA序列(GenBank登录号:HQ008222)为模板,分别以F1和R1、F2和R2为上、下游引物(表1),用20 g/L琼脂糖凝胶进行电泳分析,PCR扩增获得scy成熟肽基因相关片段约330 bp(图1-A,第2泳道)和hep3基因相关片段约240 bp(图1-A,第3泳道)。最后以上述PCR扩增获得的scy成熟肽基因片段和hep3基因片段为模版,以F1和R2为上、下游引物,扩增获得560 bp的杂合肽scy-hep3目的基因片段(图1-A,第1泳道),与预期目的条带大小相符。
2.2 真核重组表达载体的构建与鉴定
经EcoRⅠ和NotⅠ双酶切后的表达载体pPIC9K为单一的约9400 bp大小的清晰条带,与载体实际大小相符(图1-B)。经EcoRⅠ和NotⅠ双酶切的杂合抗菌肽scy-hep3目的基因片段和pPIC9K连接转化至大肠杆菌DH5α后,取若干阳性克隆摇菌培养,并进行PCR鉴定,得到的阳性克隆片段长度560 bp(图1-C),与预期大小相符。选择阳性克隆送至英潍捷基贸易有限公司测序,测序结果表明,目的基因scy-hep3已成功构建至表达载体pPIC9K上。
如图2-A所示,分泌型重组表达载体pPIC9K-scy-hep3的特点是其N端采用AOX1启动子,用信号肽α-factor引导目的蛋白Scy-Hep3分泌到胞外表达,在抗菌肽scy基因和hep3基因间加入连接肽序列,并在C端带有6×His标签,便于亲和层析纯化目的蛋白。推导的氨基酸序列组成见图2-B。
2.3 杂合抗菌肽Scy-Hep3在毕赤酵母中的表达及高效表达菌株的筛选
将测序正确的重组表达载体pPIC9K-scy-hep3用SalⅠ限制性内切酶线性化,将其电转入酵母菌GS115后,在选择性平板MD上培养。之后随机挑取若干个重组酵母转化子GS115/pPIC9K-scy-hep3,用体积分数为0.5%的甲醇诱导表达24 h,筛选高效表达菌株。
如图3所示,SDS-PAGE电泳分析结果显示,相对于诱导前的上清(第1泳道),若干克隆(2~7泳道)诱导表达24 h后的发酵上清液中出现相对分子质量大小约24 000的条带,与预期的Scy-Hep3大小相符(毕赤酵母表达的拟穴青蟹抗菌肽Scygonadin表观相对分子质量大小约11 000[5],原核表达的斜带石斑鱼抗菌肽Hepcidin 3相对分子质量约12 000[6],为目的蛋白条带。如图3箭头所指,6号泳道的目的蛋白表达量最高,因此,收获该株毕赤酵母高效表达菌株。
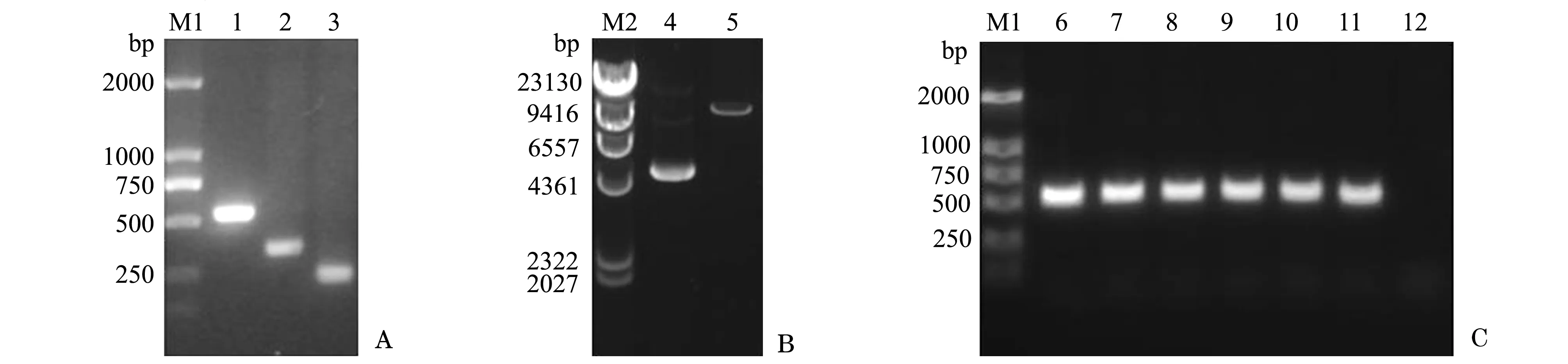
注:M1为DL2000 DNA Marker;M2为λHindⅢ DNA Marker;1为PCR扩增获得实际大小560 bp的杂合抗菌肽scy-hep3目的基因片段;2为333 bp的scy成熟肽基因片段;3为245 bp的hep3基因片段;4为酶切前pPIC9K质粒;5为9276 bp的经EcoRⅠ和NotⅠ双酶切后的pPIC9K;6~11分别为重组表达载体pPIC9K-scy-hep3的阳性克隆;12为阴性对照Note:M1,DL2000 DNA Marker; M2,λHindⅢ DNA Marker;1,PCR amplification of scy-hep3 gene 560 bp fragment; 2,scy mature gene with 333 bp; 3,hep3 gene with 245 bp; 4,pPIC9K; 5,pPIC9K digested with Eco RⅠand NotⅠ for 9276 bp; 6-11,positive clone of recombinant expression vector pPIC9K-scy-hep3; 12,negative control图1 重组表达载体pPIC9K-scy-hep3的构建与PCR鉴定Fig.1 Construction and PCR identification of recombinant expression vector plasmid pPIC9K-scy-hep3
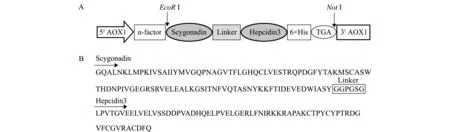
图2 pPIC9K-scy-hep3分泌型重组表达载体的构建示意图及推导的氨基酸序列组成Fig.2 Schematic representation of the secretion expression vector pPIC9K-scy-hep3 and deduced amino acid sequence of hybrid antimicrobial peptide Scy-Hep3
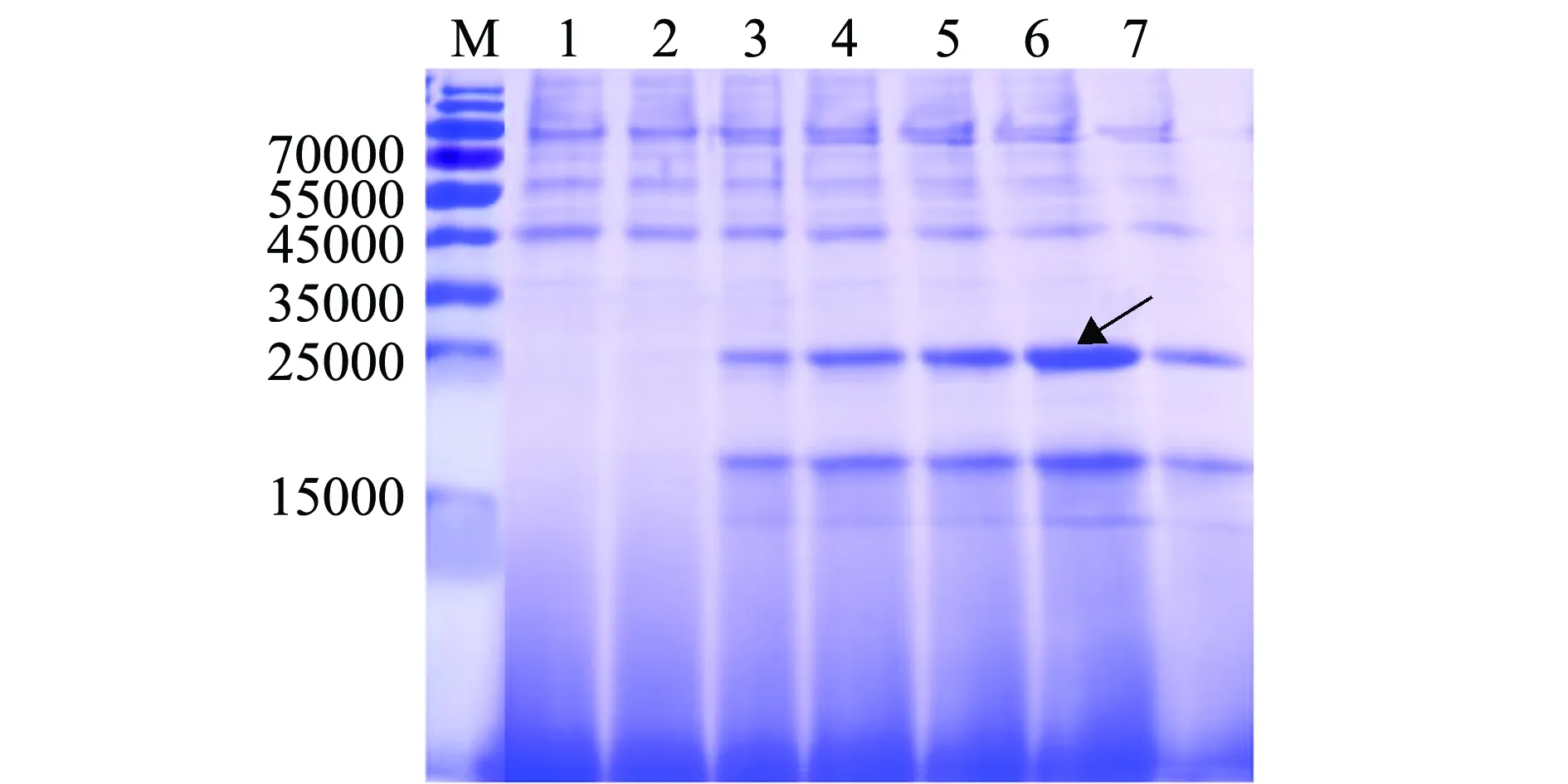
注:M为蛋白Marker;1为重组酵母转化子GS115/pPIC9K-scy-hep3诱导前的发酵上清液;2~7泳道为随机挑选的6个阳性克隆诱导表达24 h后的发酵上清液Note:M,protein maker;1,supernatant of positive strain GS115/pPIC9K-scy-hep3 culture before induction;2-7,supernatant of six strains of GS115/pPIC9K-scy-hep3 culture in 24 h induction 图3 杂合抗菌肽Scy-Hep3在毕赤酵母中的分泌表达及高效表达菌株筛选Fig.3 Hybrid antimicrobial peptide Scy-Hep3 secreted expression in yeast Pichia pastoris and screening of highly expressed strains
2.4 杂合抗菌肽Scy-Hep3的表达和纯化
将筛选获得的重组毕赤酵母高效表达菌株GS115/pPIC9K-scy-hep3,用终浓度为0.5%的甲醇诱导表达24 h后,收集分泌到胞外的上清液进行亲和纯化,用低浓度咪唑(10 mmol/L)的平衡缓冲液可洗脱掉杂蛋白(图4,第3泳道),用高浓度咪唑(250 mmol/L)的洗脱缓冲液可洗脱螯合的目的蛋白(图4,第4、第5泳道)。SDS-PAGE电泳结果表明(图4),相对分子质量约24 000的重组目的蛋白Scy-Hep3可特异性地与镍离子金属螯合层析柱结合,并在高浓度咪唑竞争洗涤后被洗脱。
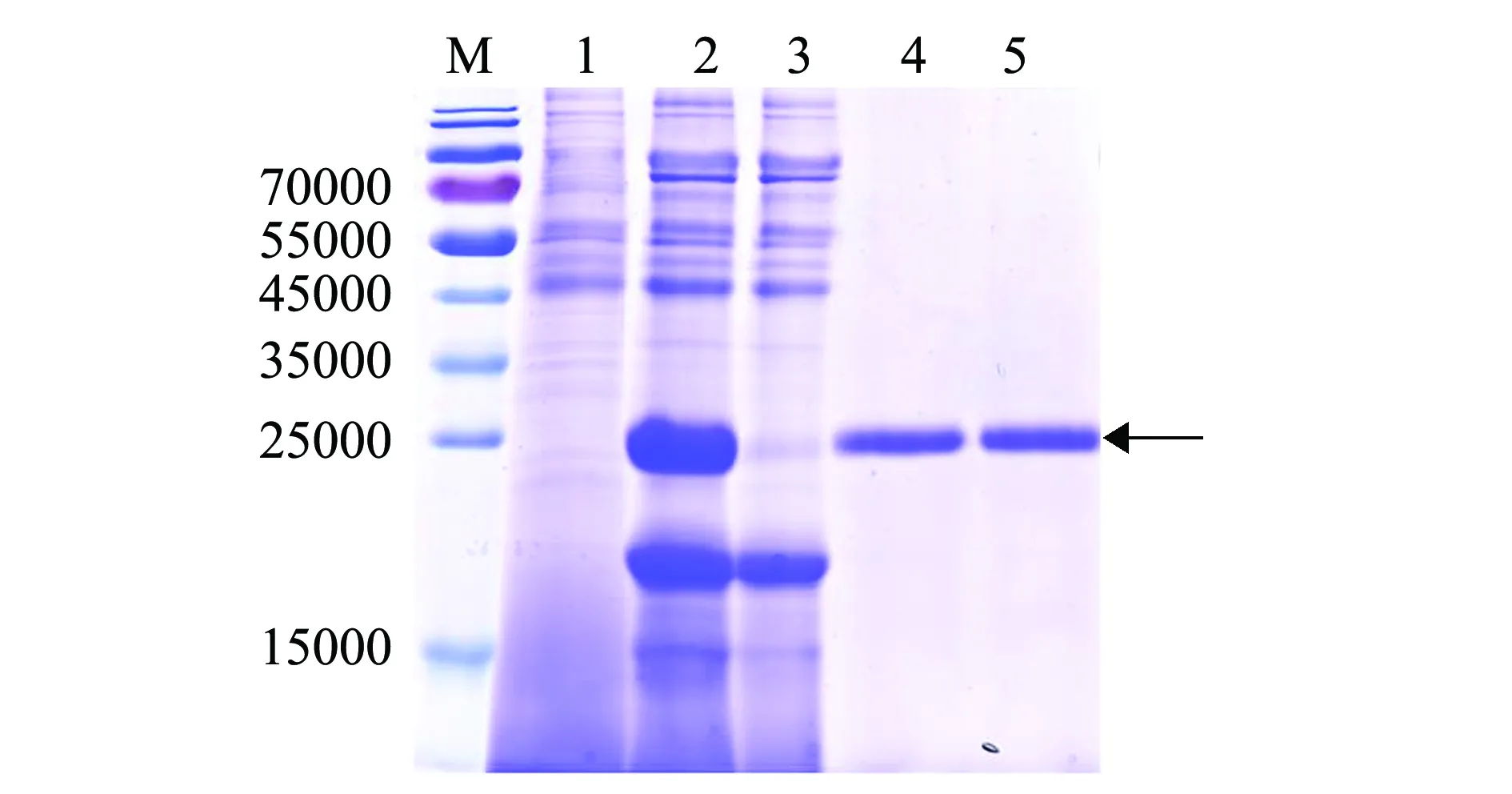
注:M为蛋白Marker;1为重组毕赤酵母菌株GS115/pPIC9K-scy-hep3诱导前的发酵上清液;2为重组毕赤酵母菌株GS115/pPIC9K-scy-hep3诱导表达24 h后的发酵上清液;3为流出组分;4、5为洗脱组分Note:M,protein Maker;1,supernatant of GS115/pPIC9K-scy-hep3 culture before induction;2,supernatant of GS115/pPIC9K-scy-hep3 culture in 24 h induction;3,flow through fractions with 10 mmol/L imidazole; 4 and 5,elution fractions with 250 mmol/L imidazole图4 杂合抗菌肽 Scy-Hep3的表达和纯化Fig.4 Expression and purification of hybrid antimicrobial peptide Scy-Hep3
2.5 杂合抗菌肽Scy-Hep3的抗菌活性
将纯化后的杂合抗菌肽Scy-Hep3经0.22 μm滤膜过滤除菌后,倍比稀释蛋白浓度至1.5、3.0、6.0、12.0、24.0、48.0 μmol/L共6个浓度,与等体积的菌悬液混合培养1~2 d后观察MIC结果。如表2所示,表达的杂合抗菌肽Scy-Hep3具有广谱抗菌活性,能够较好地抑制多数被测的革兰氏阳性菌和革兰氏阴性菌的生长,其中对3种革兰氏阳性菌如金黄色葡萄球菌、谷氨酸棒杆菌、溶壁微球菌和2种革兰氏阴性菌如施氏假单胞菌、荧光假单胞菌的最小抑菌浓度均小于1.5 μmol/L,对2种革兰氏阴性菌如嗜水气单胞菌和弗氏志贺氏菌最小抑菌浓度为6~12 μmol/L,不抗蜡样芽孢杆菌(MIC>48 μmol/L)。抗菌试验结果表明,毕赤酵母表达的杂合抗菌肽Scy-Hep3具有广谱高效抗菌活性,杂合抗菌肽Scy-Hep3的抗菌活性显著高于单一的抗菌肽Scy和Hep3的抗菌活性。
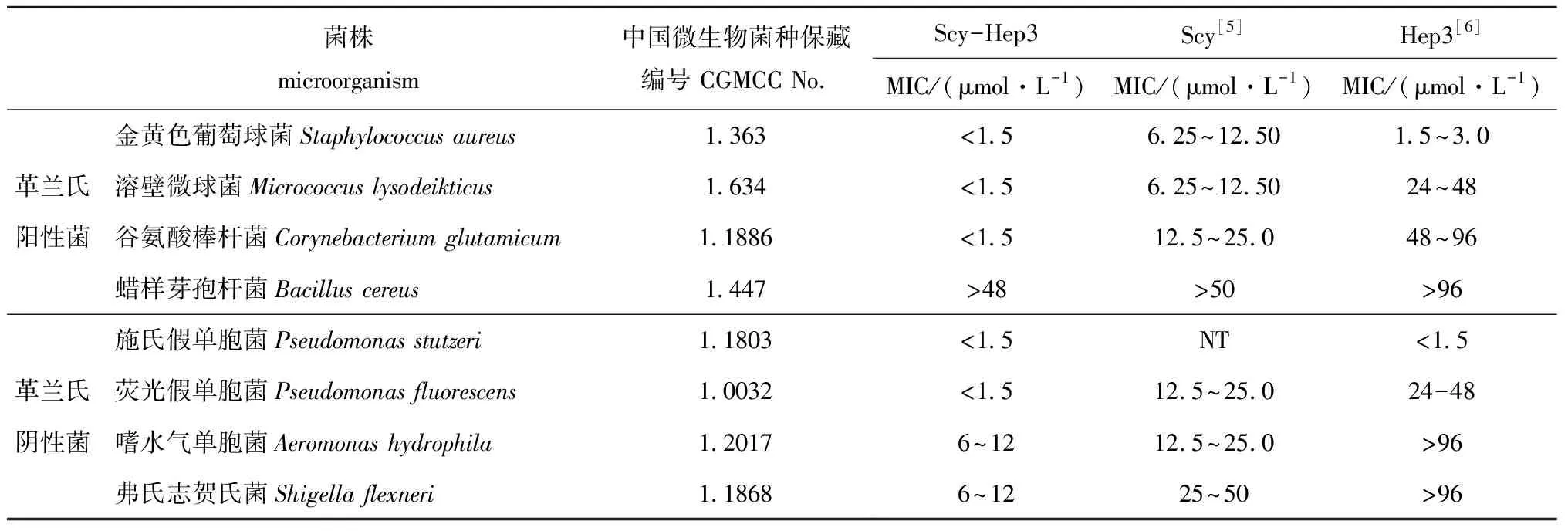
表2 杂合抗菌肽Scy-Hep3的抗菌活性Tab.2 Antimicrobial activities of Scy-Hep3
注:NT表示未检测
Note:NT means undetected
3 讨论
抗菌肽的研发与应用,不仅具有重要的医学开发前景,还是实现海水动物健康养殖、减少抗生素污染的重要保障。近年来,随着对抗菌肽结构功能及杀菌机理的深入研究,人们开始尝试设计抗菌活性更强、抗菌谱更广且稳定性高的杂合抗菌肽。杂合抗菌肽可以提高单一抗菌肽的抗菌活性,同时降低溶血特性,因而有望发展成新型的抗菌药物[9-10]。通过构建杂合肽的工程菌株发酵生产抗菌肽可降低其生产成本[11]。牛明福等[12]为了获得抗菌活性较强的抗菌肽,将几种抗菌肽串联起来在毕赤酵母中表达,获得的复合抗菌肽PL表现出了强于单独的蝎子防御素SD的抗菌活性。
3.1 杂合抗菌肽Scy-Hep3的设计
本研究团队前期对海洋鱼类Hepcidin抗菌肽和青蟹Scygonadin抗菌肽等进行了系列研究[13],其中Scy是从拟穴青蟹精浆中分离鉴定的一个新型阴离子抗菌肽,可能在青蟹的生殖免疫中起着重要作用。斜带石斑鱼Hep3属于鱼类Hepcidin家族的抗菌肽,Hepcidin 是鱼类普遍存在的重要免疫防御因子[13]。前期研究发现,青蟹抗菌肽Scy和斜带石斑鱼抗菌肽Hep3的表达产物对细菌的抗菌活性与抗菌谱显著不同[5-6],例如,Hep3对金黄色葡萄球菌的抗菌活性显著高于Scy,约为Scy抗菌活性的4倍;而Scy对水产致病菌嗜水气单胞菌具有较强的抗菌活性,Hep3不抗嗜水气单胞菌。鉴于青蟹抗菌肽Scy和石斑鱼抗菌肽Hep3不同的抗菌谱,为获得抗菌活性更强或抗菌谱更广的抗海洋鱼类和蟹类病原菌的融合多肽产品,本研究中将青蟹抗菌肽Scy和石斑鱼抗菌肽Hep3在毕赤酵母中进行融合表达和抗菌活性分析。
3.2 连接肽的设计
合适的连接肽应有足够的长度和较高的柔韧性,不会影响融合蛋白中各个蛋白的结构和生物学活性。设计连接肽时一般主要考虑氨基酸组成、连接肽长度、构象、柔韧性等因素,连接肽中常用的氨基酸包括甘氨酸 (Gly)、脯氨酸(Pro)、丝氨酸(Ser)、丙氨酸(Ala)、谷氨酸(Glu)等,其中Gly作为相对分子质量最小且亲水性强的氨基酸使用最为广泛,富含Gly使得连接肽柔软易弯折[14-15]。蔡晓娜[16]通过体外重组表达了含不同连接肽的重组 TRAIL-Fc 融合蛋白,筛选获得了通过连接肽(GGGGGGGG或THTSPPSP)连接的重组融合蛋白结构更稳定。赵昆等[17]使用连接肽(SPGS)将牛抗菌肽Bca7和Bca5融合表达,获得的杂合抗菌肽比单一抗菌肽具有更高的抗菌活性。合适的连接肽能够稳定融合蛋白结构,具有较好的生物学活性,但目前关于连接肽的研究还不够深入,没有统一的标准,还需要更多的试验设计和验证。本研究中使用连接肽(GGPGSG)将拟穴青蟹抗菌肽Scy和携带石斑鱼抗菌肽Hep3构建融合抗菌多肽,主要利用Gly残基无侧链基团的柔软效应和Pro残基的转角效应,认为该柔性短肽有利于各自抗菌肽保持其稳定的空间结构和相对独立的抗菌活性。通过连接肽(GGPGSG)连接的重组杂合抗菌肽Scy-Hep3的抗菌活性显著高于单一的抗菌肽Scy和Hep3。但该连接肽设计的合理性和最优性还需要通过表达不含连接肽或表达含不同连接肽的重组融合蛋白Scy-Hep3,并比较其抗菌活性才能得到进一步验证。
3.3 杂合抗菌肽Scy-Hep3的抗菌活性分析
杂合抗菌肽Scy-Hep3的抗菌活性显著增强可能是由于杂合抗菌肽拓展了单一抗菌肽的抗菌谱,还可能是由于毕赤酵母系统表达的目的蛋白有利于转录翻译后的蛋白折叠加工成正确结构的目的蛋白,从而有利于其抗菌活性的体现。杂合抗菌肽Scy-Hep3中的单一抗菌肽Hep3属于抗菌肽Hepcidin家族,Hepcidin是一种富含半胱氨酸的两性分子,可以通过二硫键形成稳定的β折叠结构和Loop结构,这种结构与Hepcidin的抗菌活性密切相关[18]。一般通过毕赤酵母真核表达系统表达的具有这类特殊结构的蛋白的抗菌活性要比用大肠杆菌表达系统获得的表达产物抗菌活性强。如薛剑峰[19]用大肠杆菌表达系统和毕赤酵母表达系统表达了来源于中国明对虾的对虾素Chp5,毕赤酵母分泌表达的Chp5的抗菌效果与天然抗菌肽相近,而原核表达的Chp5抑菌活性不高,认为是由于大肠杆菌表达系统不具有真核系统对翻译后的蛋白进行修饰加工的作用,Chp5无法形成正确的二硫键结构。本研究中通过毕赤酵母表达系统获得了具有高抗菌活性的杂合抗菌肽Scy-Hep3,将为杂合抗菌肽的开发应用提供数据资料。
