抗甲状腺球蛋白抗体动态监测在131I治疗分化型甲状腺癌患者预后中的价值
2018-10-26陈文新林志毅周庆伟余明钿
葛 华, 陈文新, 林志毅, 周庆伟, 余明钿
分化型甲状腺癌(differentiated thyroid carcinoma, DTC)是最常见的甲状腺恶性肿瘤,多进展缓慢,预后较好,但如发生复发或转移则会严重影响患者的预后,而及时发现复发或转移并进行针对性的治疗可以明显改善其预后[1],故对DTC患者进行长期甚至终生的随访观察以明确疾病进展情况从而及时进行相应的干预措施非常重要。对已清除全部甲状腺的DTC患者,血清甲状腺球蛋白(thyroglobulin, Tg)是判断患者是否存在肿瘤残留或复发敏感而特异的指标[2],但抗甲状腺球蛋白抗体(anti-thyroglobulin antibody, TgAb)的存在会严重影响Tg检测结果的准确性,降低其作为肿瘤标志物的临床价值。目前,在DTC术后Tg阴性的情况下,对患者血清中高水平的TgAb应作何处理,尤其是对于DTC术后Tg阴性的情况下,TgAb能否作为可替代Tg的、用以预测肿瘤复发或转移、判断疗效及预后的肿瘤标志物的问题,至今仍无定论,是很多学者关注的一个热点问题。本研究旨在探讨Tg阴性情况下,单纯TgAb、TgAb的转阴时间及其随时间的变化趋势在监测131I治疗DTC预后中的意义。
1 对象与方法
1.1对象
1.1.1对象 回顾性分析2012年7月-2016年11月经病理证实的116例DTC患者的资料(其中随访时间6~29月的患者有92例)。纳入标准:(1)经甲状腺全切或次全切手术并行131I清除甲状腺(清甲)/清甲及清灶治疗;(2)血清Tg阴性、TgAb阳性;(3)血清Tg,TgAb水平均在同一科室以同一方法进行检测;(4)131I治疗后进行定期规律复查并判断疗效。其中Tg阴性的入选标准为:Tg<2 μg/L(TSH刺激状态下,即血清TSH>30 mU/L)或Tg<1 μg/L(TSH抑制状态下)[2];TgAb阳性的入选标准为:TgAb>115 IU/mL[3]。
1.1.2仪器 SPECT/CT仪(Discovery 670,美国GE公司);PET/CT仪(Discovery LS16,美国GE公司);电化学发光免疫分析仪(cobas 6000,德国Roche公司)。
1.2方法
1.2.1131I治疗方法131I治疗的指征、治疗前准备、治疗的实施及治疗后随访均按照《2015版ATA甲状腺结节和分化型甲状腺癌诊治指南》[2]进行,所纳入研究对象的131I治疗次数为1~6次,治疗剂量为3.7~33.3 GBq(100~900 mCi);131I治疗后5~7 d内行131I全身显像(131I whole-body scan,131I-WBS),对大部分放射性异常浓聚的病灶行SPECT/CT融合显像;血清TSH,Tg及TgAb测定采用电化学发光免疫分析法,Tg及TgAb测定范围分别为0.100~1 000 μg/L,10~4 000 IU/mL;对Tg>1 000 μg/L和(或)TgAb>4 000 IU/mL者则稀释后再测定。
1.2.2评价及分组 根据血清学、影像学(包括131I-WBS、131I SPECT/CT断层融合显像、胸部CT、18F-FDG PET/CT显像、超声)和必要时的手术病理等判断有无复发或转移,将116例患者分为复发或转移组(M1组)和无复发或转移组(M0组)。M1组共44例患者,男性6例,女性38例,年龄(41.2±12.9)岁(20~80岁);M0组共72例患者,男性9例,女性63例,年龄(42.4±13.1)岁(17~71岁)。
1.2.3随访及疗效评价 对131I治疗后的DTC患者规律复查及定期随访,根据血清学、影像学、必要时的手术病理和临床随访资料等进行疗效评价:(1)临床治愈[4]:没有肿瘤存在的临床及影像学证据,131I治疗后的131I-WBS没有发现甲状腺床和床外组织摄取131I且TSH抑制状态下和TSH刺激后,在无TgAb干扰时,测不到血清Tg(<1 μg/L);(2)好转:131I-WBS发现转移灶摄取131I功能明显降低或完全消失或发现的病灶数目比治疗前减少;(3)无效或加重:与治疗前比较有新的病灶显示,或转移灶数目增加,或旧的转移灶增大或摄131I功能增强。以TgAb变化幅度≥20%作为TgAb升高或降低的标准,即TgAb值上升≥20%记作TgAb增高,TgAb值下降≥20%记作TgAb下降,TgAb阳性且值上升或下降<20%记作TgAb长期维持高水平状态。

2 结 果
2.1一般资料 M1,M0组的男女性别比(t=0.31,P=0.860)、年龄(t=-1.709,P=0.091)比较,差别均无统计学意义;M1,M0组TgAb水平[分别为(606.7±570.1) IU/mL,(631.8±606.0) IU/mL]比较,差别无统计学意义(t=0.221,P=0.825,图1)。
2.2TgAb转阴时间与转移灶关系 M1,M0组TgAb阳性率随随访时间的延长渐下降(图2)。M1,M0组患者TgAb的中位转阴时间分别为20.1月及29.0月,但2组转阴时间中位数比较,差别无统计学意义(P>0.05)。
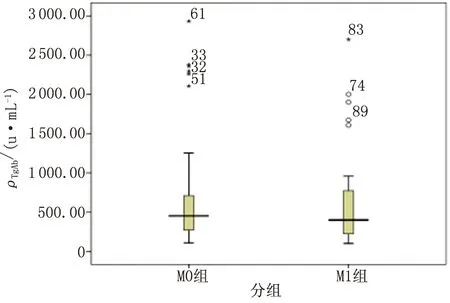
TgAb:抗甲状腺球蛋白抗体.图1 131I治疗前2组患者TgAb水平比较Fig 1 Comparison of the TgAb levels before 131 I radiotherapy between the two groups
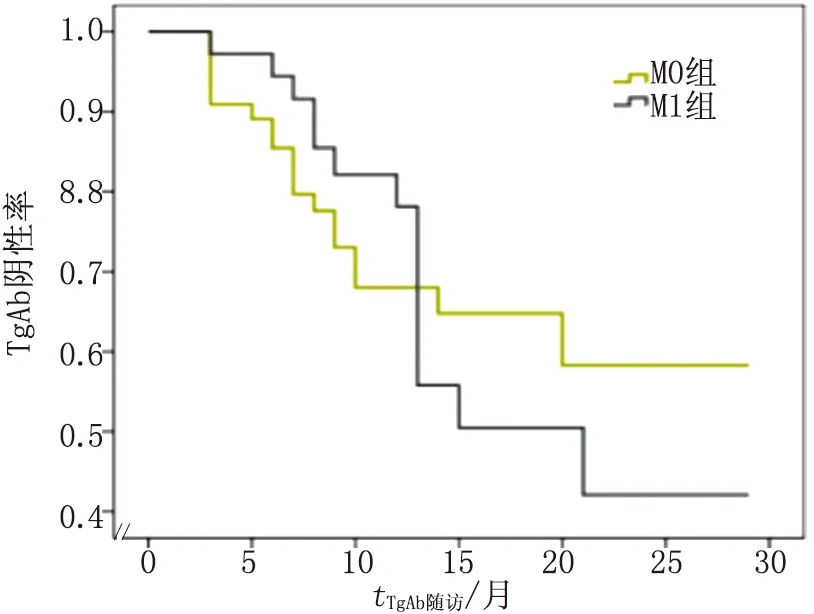
TgAb:抗甲状腺球蛋白抗体.图2 2组患者TgAb阳性率随时间的变化趋势Fig 2 The comparison between the two groups in change pattern of the positive rate of TgAb
2.3TgAb水平动态变化与对应疾病治疗疗效
2.3.1TgAb由高水平逐渐下降或转为阴性患者对应的疾病治疗情况 共63例(转阴者30例),除2例(3.2%)有持续的淋巴结转移状态外,其余61例均为治愈或好转状态(96.8%,图3),其中14例淋巴结转移、2例淋巴结转移并肺转移患者,随访结束时病灶均转为阴性;5例为淋巴结转移并肺转移或肺转移,随访结束时病灶摄131I范围缩小或变少;余40例一直未发现明显病灶。
2.3.2TgAb水平逐渐增高或长期维持高水平状态患者对应的治疗情况 共29例,治愈或好转者20例(69%),其中TgAb水平逐渐增高患者11例,长期维持高水平状态患者9例。所有治愈或好转者中3例由淋巴结转移变为阴性,1例由肺转移转为阴性,余16例一直未发现明显病灶;治疗无效或加重者9例(占31%),其中TgAb水平逐渐增高患者7例,长期维持高水平状态患者2例。所有治疗无效或加重者中5例为淋巴结转移、肺转移、淋巴结转移并肺转移,4例由原来的无病灶进展为淋巴结转移。

A:动态监测22月,TgAb水平由195.5 IU/mL降低至40 IU/mL,Dx-WBS平面显像示原多发放射性异常浓聚影逐渐消失; B:SPECT/CT局部断层融合显像横断位示原双肺多发转移灶转为阴性; C:原淋巴结转移灶转为阴性.图3 TgAb逐渐下降或转为阴性患者3次131I放射治疗后显像图Fig 3 Images of patients whose TgAb levels were gradually decreased or became negative after three times 131I radiotherapies
3 讨 论
在对DTC术后患者的血清学监测中,Tg水平的高低与患者预后情况密切相关[1],对评价肿瘤复发、转移、判断疗效及预后具有重要意义。DTC患者中TgAb的阳性率约为25%~30%[5],血清TgAb的存在是干扰Tg检测结果的最重要因素,严重影响Tg作为DTC患者治疗后检测复发或转移的肿瘤标志物的临床价值。受血清高水平TgAb干扰致Tg检测结果偏高还是偏低主要取决于不同检测方法的选择[6]。当DTC患者体内TgAb阳性时,放射免疫分析法(radioimmunoassay, RIA)多为“高估”Tg水平,而目前大多数实验室采用的比较先进的免疫放射分析法(immunoradiometric assay, IMA)则往往“低估”Tg水平,导致检测结果较实际值偏低,造成Tg的假阴性,从而可能造成患者治疗的延误。目前没有可排除TgAb干扰性的TgAb界定浓度,因为即使非常低的TgAb水平也会导致RIA和IMA的检测结果不一致[7]。
有学者认为,血清TgAb的“定性”(阴性或阳性)决定了Tg的测定是否受TgAb的干扰,TgAb的“定量”即浓度可以作为替代Tg的预示肿瘤复发、转移的肿瘤标志物[7];但另有学者则不认同此观点[8-10],至今争议不断。如Kim等一项包括824例患者在内的研究发现,TgAb阳性或Tg阴性患者有更高的复发风险并且TgAb水平的变化对疾病具有预测价值:TgAb水平显著下降、缓慢下降、上升分别对应的复发率为0%,19%及37%。而Gorges等的一项包括112名患者在内的长达3年的研究则显示,不论是治疗前的TgAb水平、在15~18月随访评估期间出现的TgAb还是TgAb的变化趋势与疾病的进展情况均无相关性[8]。本研究结果显示,M1组与M0组TgAb水平比较,差别并无统计学意义(P<0.05),提示单纯TgAb水平的高低并不能预测肿瘤的复发或转移,与Gorges和Stephanie的研究结果相仿[8-9]。
TgAb也是自身免疫性甲状腺疾病(autoimmune thyroid disease, AITD)的标志性抗体,是公认的甲状腺自身免疫过程中的重要标志物,其出现体现了机体免疫功能紊乱。近年来,DTC合并AITD的患者逐渐增多,尤其是对于TgAb阳性的DTC患者,术后病理提示合并AITD的发生率高达50%以上。TgAb不同检测方法间较大的差别不仅反映了Tg抗原的纯度,还在于Tg抗原决定簇的特异性以及不同患者血液中抗体的遗传异质性。研究显示,存在于正常个体、DTC患者以及AITD患者体内的TgAb抗原决定簇的特异性并不相同,二者对Tg的干扰也不同[11]。由此,笔者推断,对既有单纯的DTC又合并AITD的DTC患者的TgAb水平进行统一分析是不合理的。张文杰等的一项有关Tg及TgAb的相关性分析表明,无论在DTC患者的TgAb阳性还是阴性的情况下,Tg与TgAb的浓度都没有相关性,不能用单纯TgAb水平的高低来预测Tg受干扰的程度[3],故在Tg阴性的情况下,并非TgAb水平越高,复发或转移的可能性越大。
当患者通过甲状腺全切术、清甲治疗后,抗原刺激物的清除会使TgAb在36月的时间内消失[8,12]。本研究结果显示,M1组与M0组TgAb的中位转阴时间分别为20.1月及29月,与大多数报道相符,但2组的差别并无统计学意义(P>0.05),说明是否存在复发或转移对TgAb的转阴时间影响并不显著。笔者分析考虑主要原因有以下几点并有待进一步探讨:(1)DTC患者本身有相对较长的生存期,本研究可能随访时间不足而未能达到TgAb的中位转阴时间;(2)患者131I治疗次数和剂量的差别;(3)部分患者体内可能存在微小DTC复发或转移灶;(4)部分患者体内存在可以产生TgAb的淋巴记忆细胞等[13]。
尽管如此,并非TgAb水平的动态变化与疾病的进展情况无关。本研究在随访过程中对患者TgAb水平的变化趋势及其对应的疾病治疗效果进行动态观察,发现血清TgAb呈逐渐增高或长期维持高水平状态的患者中,约31%的患者131I治疗无效或加重;而血清TgAb由高水平逐渐转为阴性的患者,至随访结束,96.8%均为治愈或好转状态。这与文献结果一致[14,5]。由此可见,TgAb水平的持续降低直至转为阴性可能为一种肿瘤治疗有效的标志,提示有较好的预后转归,而TgAb水平的逐渐增高或长期维持高水平状态则可能预示了较差的疾病进展方向。
综上,本研究认为,DTC术后、Tg阴性的情况下,单纯TgAb水平的高低与疾病的复发或转移并无显著相关性,对TgAb阳性的这部分患者的监测仍将取决于高质量的影像学表现,直到有一个可替代Tg的肿瘤标志物被发现。但对TgAb阳性的这部分患者仍要严密复查,因为TgAb随时间的变化趋势能够提供有关肿瘤对治疗反应的重要信息,对患者病情分析、疾病进展情况推测具有很大的临床参考价值。
