27nt-miRNA对人脐带间充质干细胞定向内皮细胞分化和管腔形成的影响及其分子机制
2018-10-26陶晓静杨鹏沈凤颜渊鸳李丹罗雪兰甘娜覃裕旺欧和生
陶晓静,杨鹏,沈凤,颜渊鸳,李丹,罗雪兰,甘娜,覃裕旺,欧和生,
(1广西医科大学药学院,南宁530021;2广西中医药大学附属广西国际壮医医院)
微小RNA(miRNA)是一类含21~28个核苷酸的单链保守内源性非编码RNA。miRNA在转录后水平通过与信使RNA(mRNA)结合降解mRNA或抑制其翻译来调控靶基因的表达,从而参与组织细胞的正常生理功能,调控某些疾病如肿瘤、心血管疾病的病理生理过程[1]。血管内皮细胞 (vascular endothelial cells, VECs) 功能紊乱是多种心血管疾病发生发展的起始环节。研究[2]发现,miRNA参与内皮细胞的增殖、迁移、分化与凋亡等功能调节。人脐带间充质干细胞(human Umbilical Cord Mesenchymal Stem Cells, hUCMSCs)具有多向分化潜能,可分化为成骨细胞、脂肪细胞及内皮细胞等[3]。血管生成是一个复杂的过程,其中涉及干细胞定向内皮分化。miRNA在干细胞定向内皮分化过程中起着至关重要的作用[4]。我们的前期研究[5]证实,27nt-miRNA与转录因子共同参与调控其宿主基因内皮型一氧化氮合酶( endothelial nitric oxide synthase,eNOS)的表达,进而影响VECs的增殖、迁移和管腔形成能力。此外,间充质干细胞(Mesenchymal Stem Cells, MSCs)定向血管内皮细胞分化后eNOS的表达/活性增加,血管活性分子一氧化氮(nitric oxide,NO)合成与释放增加[6]。因此,27nt-miRNA是否通过调控eNOS表达影响hUCMSCs定向内皮细胞分化过程及分化后细胞的成管能力,值得关注。2017年10月08日~2018年4月25日,我们通过构建27nt-miRNA高表达质粒,慢病毒包装后转染hUCMSCs,观察其对hUCMSCs定向内皮细胞分化及对分化后细胞管腔形成能力的影响,并探讨相关分子机制。
1 材料与方法
1.1 细胞、试剂及仪器 hUCMSCs。血清替代品,培养基,血管内皮生长因子(VEGF)及碱性成纤维细胞生长因子 (bFGF),慢病毒GV367载体及AgeI / NheI酶,四甲基偶氮唑盐(MTT),总RNA提取试剂盒(TRIzol 法),eNOS兔源单克隆抗体,羊抗兔IgG-HRP,NO含量测定试剂盒,人工基底膜(Matrigel)。倒置显微镜,酶联免疫检测仪Model-450,Alpha化学发光凝胶成像系统Fluor Chem HD2。
1.2 目的基因表达质粒构建及慢病毒包装 委托上海吉凯基因化学技术有限公司根据来源于eNOS基因第4内含子中的27碱基重复序列即27nt-miRNA序列5′-GAAGTCTAGACCTGCTGCAGGGGTGAG-3′ 、27nt-miRNA反义序列及随机对照序列5′-GUCAUCAGUCGAGCUAGACGAG-3′分别设计27nt-miRNA过表达、27nt-miRNA抑制物(anti-27nt-miRNA)及对照基因片段。采用PCR技术获取目的基因,通过基因重组技术(AgeI / NheI 酶切)将目的基因分别克隆到GV367慢病毒载体中,进行PCR鉴定及DNA测序比对分析,构建相应的27nt-miRNA、anti-27nt-miRNA及对照慢病毒载体。载体含有增强绿色荧光蛋白(Enhanced Green Fluorescent Protein, EGFP)及嘌呤霉素,转染成功的hUCMSCs可用嘌呤霉素进行筛选,建立稳转细胞株。
1.3 hUCMSCs转染和诱导定向内皮细胞分化 将hUCMSCs用含2%血清替代品、2%谷氨酰胺和1%青霉素/链霉素的培养基培养传代。选择生长状态良好的第3~5代hUCMSCs用于转染。hUCMSCs消化、离心,弃上清后用完全培养基重悬,制备3×104/mL的细胞悬液,取2 mL细胞悬液接种于6孔板,过夜培养约24 h。镜下观察细胞状态,稳定后分为27nt-miRNA组、anti-27nt-miRNA组、对照组,分别转染27nt-miRNA、anti-27nt-miRNA及对照慢病毒载体:首先根据预实验确定的慢病毒转染条件及感染复数(Multiplicity of infection, MOI)=70,配制增强液(ENi.S.)1 mL/孔,Polybrene 5 μg/mL,根据三种病毒的滴度及公式[病毒体积=(MOI×细胞数目)/病毒滴度]来配置三组转染液。弃去原培养液,PBS清洗2次后,每孔分别依次加入1 mL转染液,放回培养箱孵育8~12 h(过程中注意观察细胞形态,发生变化可提前换液),更换为2 mL完全培养基。继续培养至转染48 h后,更换含浓度为8 μg/mL嘌呤霉素的完全培养基筛选。转染约72 h,换液弃去因未转染被嘌呤霉素杀死的细胞,荧光显微镜观察转染效果(观察细胞的绿色荧光效率及强度)。转染成功后分别将三组细胞消化收集,以2×104/孔接种于6孔板中,三组细胞每孔均用2 mL含有1%血清替代品、1%谷氨酰胺、20 ng/mL的VEGF及10 ng/mL的b-FGF培养基诱导分化,隔天半量换液,诱导9 d。镜下观察分化期间细胞形态学变化并拍照。
1.4 各组细胞增殖能力观测 采用MTT法。各组转染并诱导分化后的细胞分别以每孔 5×103个接种到 96孔板,待细胞达到50%融合时更换无血清培养基培养24 h(实现细胞同步生长),每孔加10 μL的 MTT继续孵育4 h。弃去培养液,每孔加入 100 μL的二甲基亚砜,震荡15 min。酶联免疫检测仪在570 nm的波长下测定光密度值(OD值),以此代表细胞增殖能力。
1.5 各组细胞上清液NO检测 采用硝酸还原酶法。 在诱导hUCMSCs分化过程中,分别吸取各组第1、3、5、7、9天的培养基上清,3 500 r/min离心10 min,-80 ℃冻存,检测前37 ℃水浴快速融化,按试剂盒说明书步骤逐一进行,最后使用酶联免疫检测仪在550 nm波长测定各组的OD值。根据测得的OD值计算各组各时间点的NO浓度:NO浓度(μmol/L)=(测定管OD值-空白管OD值)/(标准管OD值-空白管OD值)×标准管浓度(100 μmol/L)×稀释倍数。
1.6 各组细胞管腔形成能力观测 采用Matrigel实验。实验前将Matrigel置于4 ℃解冻,在冰上按17~20 μL/孔将其均匀铺于96孔板(注意不要有气泡),于37 ℃、5% CO2培养箱中放置1 h。各组细胞消化后,无血清培养基重悬,1×104/孔分别种于铺好的Matrigel上,培养箱继续培养12 h,镜下观察管腔形成情况。
1.7 各组细胞的eNOS mRNA检测 采用RT-PCR技术。按TRIzol试剂盒逐步、分别提取每组细胞的总RNA。Primer 5.0软件设计、合成人eNOS引物序列,上游引物序列为5′-AGGAACCTGTGTGACCCTCA-3′,下游引物序列为5′-CGAGGTGGTCCGGGTATCC-3′,GAPDH作内参。先将总RNA逆转录合成 cDNA,经扩增反应,取8 μL的 PCR产物进行1.5%琼脂糖凝胶电泳,凝胶成像系统扫描、计算灰度值,以eNOS灰度值/GAPDH灰度值表示eNOS mRNA的相对表达量。
1.8 各组细胞的eNOS 蛋白检测 ①免疫细胞化学法检测各组细胞的eNOS 蛋白:将已转染的各组hUCMSCs制成均匀的细胞悬液,以2×104/孔接种于预先放置在6孔板内的玻片上,用含1%血清替代品、1%谷氨酰胺、20 ng/mL 的VEGF及10 ng/mL的 b-FGF培养基诱导分化。待分化第9天,细胞长满约80%后,PBS洗涤2次,2 mL的 4%多聚甲醛溶液室温固定15 min后取出玻片晾干。将1滴树脂滴于载玻片上,将细胞玻片无细胞面紧贴树脂固定,晾干待用。首先,用0.5% TritonX-100处理30 min,PBS洗涤2次;3% H2O2溶液处理10 min,PBS洗涤2次;5% BSA室温封闭30 min,PBS洗涤2次。接着eNOS一抗(1∶1 000)4 ℃孵育过夜。次日PBS洗涤2次后,加二抗,37 ℃孵育1 h,PBS洗涤2次。最后DAB室温显色10 min,苏木素复染,烘干后封片,镜下观察eNOS表达情况。②Western Blotting检测各组细胞的eNOS 蛋白:用细胞裂解液RIPA裂解分化后的各组细胞,于4 ℃、12 000 r/min 离心15 min,收集上清液,BCA法检测蛋白浓度。各组分别取蛋白40 μg ,8% SDS-PAGE 上样、电泳分离后,湿转至PVDF膜。5% BSA室温封闭1 h,加入eNOS一抗(1∶500),4 ℃孵育过夜。TBST 缓冲液洗膜3次,各10 min。加入辣根过氧化物酶标记的羊抗兔二抗(1∶2 000),室温条件下孵育2 h后用TBST 缓冲液洗涤3次,各10 min。A、B化学发光检测试剂按1∶1配制混合溶液,与膜反应 2 min。应用凝胶成像系统曝光、显影、分析蛋白电泳条带的灰度值。GAPDH为内参。eNOS蛋白的相对表达量=eNOS灰度值/GAPDH灰度值。

2 结果
2.1 27nt-miRNA慢病毒转染效率及其对hUCMSCs分化形态的影响 各组27nt-miRNA慢病毒转染效率均达到90%以上,见图1A。三组hUCMSCs转染后经同一条件诱导分化,结果见图1B;对照组细胞亮度增强,触角缩短,部分细胞呈多角形,出现内皮样形态改变;27nt-miRNA组细胞分化不明显,细胞体积较大,呈纺锤形,生长速度较慢,细胞数目较少,未形成管腔结构;anti-27nt-miRNA组少数细胞稍细长,呈短梭形,细胞间伸出伪足相连逐渐形成一个或半个管腔结构,管腔周围细胞呈铺路石样排列。
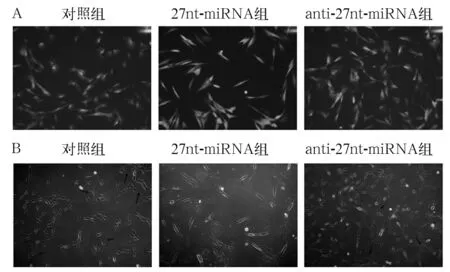
图1 27nt-miRNA慢病毒转染结果及hUCMSCs分化形态
2.2 27nt-miRNA对hUCMSCs分化后细胞增殖的影响 细胞培养24 h后,27nt-miRNA组、anti-27nt-miRNA组、对照组OD值分别为0.50±0.03、0.84±0.02、0.68±0.01;与对照组相比,27nt-miRNA组OD值降低26.47%,anti-27nt-miRNA组OD值增加23.53%;与27nt-miRNA组相比,anti-27nt-miRNA组OD值增加68%;组间两两相比,P均<0.01。
2.3 27nt-miRNA对hUCMSCs分化过程NO产量的影响 细胞分化第5天,27nt-miRNA组、anti-27nt-miRNA组、对照组细胞产生和释放的NO含量分别为(121.25±3.71)、(191.37±2.95)、(182.99±9.12)μmol/L;与对照组相比,27nt-miRNA组细胞产生和释放的NO量降低33.74%;与anti-27nt-miRNA组相比,27nt-miRNA组细胞产生和释放的NO量降低36.64%;27nt-miRNA组与anti-27nt-miRNA组、对照组相比,P均<0.05。
细胞分化第9天,27nt-miRNA组、anti-27nt-miRNA组、对照组细胞产生和释放的NO分别为(203.89±5.63)、(335.93±9.46)、(306.56±5.21)μmol/L;与对照组相比,27nt-miRNA组细胞产生和释放的NO量降低33.49%;与anti-27nt-miRNA组相比,27nt-miRNA组细胞产生和释放的NO量降低39.31%;27nt-miRNA组与anti-27nt-miRNA组、对照组相比,P均<0.05。
2.4 27nt-miRNA对hUCMSCs分化后细胞管腔形成能力的影响 与对照组相比,27nt-miRNA组细胞虽有聚集倾向,但未能形成完整的管腔样网络结构;anti-27nt-miRNA组细胞所形成的管腔数目较多,管腔网状结构较小而紧密;见图2。
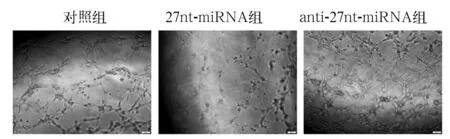
图2 各组hUCMSCs分化后细胞管腔形成情况
2.5 27nt-miRNA 对各组细胞eNOS mRNA表达的影响 27nt-miRNA组、anti-27nt-miRNA组、对照组细胞的eNOS mRNA相对表达量分别为0.48±0.01、0.76±0.02、0.63±0.02;与对照组相比,27nt-miRNA组eNOS mRNA相对表达量降低23.81%、anti-27nt-miRNA组增加20.63%;与27nt-miRNA组相比,anti-27nt-miRNA组的eNOS mRNA 相对表达量增加了58.33%;组间两两相比,P<0.05或P<0.01。
2.6 27nt-miRNA对各组细胞eNOS蛋白表达量的影响 27nt-miRNA组、anti-27nt-miRNA组、对照组细胞的蛋白相对表达量分别为0.43±0.03、 0.67±0.03、0.57±0.04;与对照组相比,27nt-miRNA组eNOS蛋白相对表达量降低24.56%、anti-27nt-miRNA组增加17.54%;与27nt-miRNA组相比,anti-27nt-miRNA组eNOS蛋白相对表达量增加55.81%;组间两两相比,P<0.05或P<0.01。
3 讨论
miRNAs是MSCs外泌体中的重要组分,通过调控MSCs增殖、分化和归巢,维持干细胞的基本特征[7]。研究[8]发现,MSCs成骨分化后提取的外泌体中多种miRNA如let-7a、miR-199b、miR-218等的表达显著增加,而miR-221、miR-155、miR-885-5p等的表达显著降低。此外,有研究[9]发现miRNA let-7f-5p通过抑制靶标Par6α促进MSCs向神经元样细胞分化,miR-410通过下调Wnt3a促进MSCs成软骨分化[10]。令人感兴趣的是,miR-126通过激活PI3K / Akt和MAPK / ERK途径促进MSCs向内皮细胞分化,且分化后特异性的内皮基因包括VEGF、eNOS,KDR和VE-粘附素表达显著增加[11]。这与我们的前期研究即MSCs定向血管内皮细胞分化后eNOS的表达/活性增加的结果相符。eNOS基因第4内含子中的27 碱基重复序列是27nt- miRNA的来源,27nt-miRNA与转录因子共同参与调控其宿主基因eNOS的表达[12]。本研究发现,27nt-miRNA组hUCMSCs分化程度较低、eNOS mRNA及蛋白表达降低,而anti-27nt-miRNA组恰好相反,这一结果强烈提示27nt-miRNA在转录水平下调eNOS蛋白表达,从而抑制hUCMSCs定向内皮细胞分化。
在心肌缺血模型中移植过表达miR-126的MSCs后Dll-4的表达上调,可促进内皮分化、管腔及功能性微血管生成[13]。miR-210通过下调靶基因Efna3发挥其调节MSCs 向VECs分化作用及促血管生成效应[14]。eNOS组织特异性强,高表达于血管内皮细胞,其表达异常与心血管疾病的病理生理过程密切相关。Xia等[15]研究发现,eNOS/F92A-Cav1慢病毒载体转染MSCs后eNOS蛋白表达及NO产量增加,上调的eNOS诱导激活VEGF通路,从而促进MSCs成脂、成骨分化和血管生成。本研究结果表明,27nt-miRNA对hUCMSCs 分化的内皮样细胞的管腔形成有抑制作用。
正常情况下,为维持血管内环境的稳态,血管内皮细胞可分泌多种活性物质。其中,NO由eNOS以L-精氨酸为底物催化产生,是调节血管舒张的重要因子,在内皮细胞增殖、迁移和血管生成等方面起着重要作用[16]。血管生成是多阶段的复杂过程,与内皮细胞功能密切相关。MSCs定向内皮细胞分化,可修复内皮损伤,调节内皮功能,促进血管生成,可能用于肿瘤、糖尿病并发症及心血管相关疾病的治疗。Chen等[17]证实eNOS和MSCs在调节心肌梗死后的心脏再生中有协同作用。该研究认为NO浓度的局部升高是激活血管生成的关键因素,此外eNOS也可能通过刺激促血管生成因子的分泌或增强内皮祖细胞的募集发挥作用。因此,27nt-miRNA极有可能是通过调控eNOS/NO通路对细胞增殖及管腔形成产生调控作用。
总之,本研究主要有以下三个方面的发现:27nt-miRNA抑制hUCMSCs分化、增殖,使其不能形成管腔结构;27nt-miRNA对hUCMSCs定向内皮细胞分化过程中eNOS mRNA及蛋白表达有明显抑制作用;27nt-miRNA明显抑制hUCMSCs定向内皮细胞分化过程中NO的产量。以上发现提示27nt-miRNA抑制hUCMSCs定向内皮细胞分化及管腔形成,而该影响与27nt-miRNA抑制eNOS蛋白表达有关。需要指出的是,MSCs定向内皮细胞分化及血管生成过程受多种因素调节,可能不仅仅受单一miRNA或基因所调控。27nt-miRNA是否与其他miRNA协同参与MSCs定向内皮细胞分化调节,27nt-miRNA对MSCs定向内皮细胞分化过程中eNOS表达的调控是否依赖其他因素如转录因子、VEGF,这些问题有待进一步探讨。
