微沟槽对共培养乳腺癌/上皮细胞迁移及空间分离的调控研究
2018-10-24夏有君陈笑笑陈建锋杜文强褚家如
夏有君,陈笑笑,陈建锋,杜文强,赵 钢,褚家如
(中国科学技术大学 精密机械与精密仪器系,安徽 合肥 230027)
细胞微环境对细胞的分化、生长和迁移等行为具有重要的调控作用。细胞的物理微环境性质主要由细胞外基质决定。细胞外基质是一种错综的蛋白质网络结构,其复杂的拓扑结构和力学性质对细胞的迁移与增殖具有重要影响[1-3]。然而,传统细胞培养是在二维平面玻璃板或者塑料板上进行,这与体内复杂的微环境有很大不同,往往也造成了体外细胞实验无法真实地模拟体内微环境对细胞行为的影响[4-5]。随着微纳米加工技术的发展,研究人员在细胞培养基底上制备出微纳米拓扑结构,以用于研究物理微环境对细胞行为的调控作用。大量研究报道了以一定的有序图案或空间梯度分布的微沟槽、微孔和微柱基底可以对细胞行为进行调控[6-10]。
细胞迁移在癌症转移、伤口愈合和胚胎发育等生理和病理过程中有着重要意义[11-14]。研究表明,细胞的迁移特性有赖于细胞微环境的形貌及几何尺寸,不同种类的细胞对细胞拓扑微环境的响应却不同,例如,胚胎干细胞在高刚度基底上趋向于分化为成骨细胞;而在低刚度基底上趋向于分化为脂肪细胞[15]。尽管有大量研究报道了单一种类细胞对物理微环境的迁移研究,但体内组织是多种类细胞共同生长,因此有必要研究共培养多种类细胞对相同物理微环境的响应,而共培养细胞的相关研究很少被报道。乳腺癌是危害女性健康的恶性肿瘤,而SUM159是一种研究三阴性乳腺癌的重要细胞模型[16-17];同时MCF10A是人类正常乳腺上皮细胞,也是被广泛用作研究的体外细胞模型[18]。
本文加工了一批深为30 μm、顶部宽度为100 μm、底部宽度递增(25、50和100 μm)的沟槽结构,研究了2种不同细胞(SUM159和MCF10A)对于这些拓扑结构基底的响应。首先,将乳腺癌细胞(SUM159)与正常乳腺上皮细胞(MCF10A)分别接种于微沟槽基底上,研究微沟槽拓扑微环境对单一细胞的迁移、取向的调控作用;其次,考虑到在体内环境中是多种细胞紧密接触,本文将2种细胞在基底上进行共培养,研究在乳腺癌细胞和正常乳腺细胞的混合状态下基底接触引导对其影响。研究发现,细胞拓扑微环境可以实现乳腺癌细胞与正常细胞在共培养条件下空间分离。该工作对癌细胞的迁移与空间分离研究具有重要的指导意义。
1 试验与方法
1.1 基底制备
用于细胞培养的微沟槽基底通过微纳米加工工艺制备而成。PDMS基底加工流程示意图如图1所示,具体步骤如下:1)通过等离子体增强型化学气相沉积(PECVD)在硅片表面沉积一层500 nm厚的二氧化硅;2)旋涂AZ6112光刻胶在氧化硅表面,光刻胶图形化后,通过反应离子刻蚀(RIE)将硅片的二氧化硅图形化;3)将二氧化硅作为掩模层,利用电感耦合等离子体刻蚀(ICP)对硅基底进行刻蚀,刻蚀深度为30 μm,最终得到底部宽度为100 μm、不同顶部宽度(25、50和100 μm)的硅片模具;4)将上述硅片的微结构通过软光刻技术转印到聚二甲基硅氧烷(PDMS)基底,首先将PDMS的预固化溶液与固化剂以10∶1的比例充分混合,将混合液置于真空腔体中除气,在混合溶液中的气体全部去除后将混合液倒在上述硅片模具上,并置于65 ℃烘箱中烘烤4 h。

图1 PDMS基底加工流程示意图
为了使细胞能够更好地粘附在PDMS基底,需要对基底进行功能化处理。首先,氧等离子体处理50 s以产生羟基基团;然后,迅速将基底置于I型胶原蛋白溶液(Sigma Aldrich)中,浓度约为7.5 μg/cm2,室温孵育1 h。PDMS基底经过蒸金后放入电子显微镜(ZEISS EVO18)中观察其微观结构,扫描电镜图如图2所示。

图2 扫描电镜图
1.2 细胞培养与免疫荧光染色
人类乳腺癌细胞(SUM159)被培养在含有1%的青霉素/链霉素、5%的胎牛血清、0.5%的胰岛素、0.1%的皮质醇和0.008%的庆大霉素的Ham's F-12 Nutrient Mix培养基(总称培养液)中,人类乳腺上皮细胞(MCF10-A)被培养在含有1%的青霉素/链霉素、5%的马血清、1%的Hepes、0.2%的EGF、0.1%的皮质醇、0.1%的霍乱毒素和0.5%的胰岛素的DMEM/F-12培养基(总称培养液)。细胞在CO2浓度为5%,温度为37 ℃的培养箱(Thermo Fisher Scientific,美国)中培养。试验中,功能化的PDMS基底置于35 mm的培养皿中,细胞接种密度为17 500个/cm2。SUM159乳腺癌细胞分别在培养时间为4、24、48和72 h的时间节点取出,并放置在倒置荧光显微镜上进行观察;MCF10A乳腺上皮细胞分别在4、24、36和48 h培养时间节点进行光学显微镜观察。对于共培养试验,首先在PDMS基底上接种SUM159乳腺癌细胞,而MCF10A乳腺上皮细胞于SUM159细胞接种后24 h进行接种,观察时间节点与单一种类细胞培养方式相同。细胞培养48 h后,使用Hoechst 33342 (Invitrogen)对细胞核进行活细胞染色。
1.3 成像与数据统计
所有的光学显微镜得到的细胞培养图像都是由ImageJ及相关插件(National Institutes of Health, US)进行处理。细胞在沟槽顶/底的数量分布通过统计方式进行量化。试验结果的均值差异的统计显著性差异通过单边方差(ANOVA)和Turkey后处理得到。
2 结果分析
2.1 拓扑微环境的表征
本文研究了PDMS基底的微米尺度的表面形貌和受限环境对于细胞分布的影响。基底由标准的软光刻工艺制备而成。在所有情形下,细胞都是培养在深度为30 μm、顶部宽度为100 μm的PDMS沟槽基底上,底部宽度分别为25、50和100 μm。细胞接种后进行定时观察,以探究微米尺度受限环境如何影响细胞分布。在接种完毕的几分钟后,由于单个细胞密度大于培养基密度,通过简单的摇匀,可使细胞绝大部分受限于30 μm的沟槽底部;之后细胞置于培养箱中培养,按上述给定的时间点观察,首次观察定在4 h,主要因为此时细胞与基底形成稳定粘附,便于成像。
2.2 拓扑微环境对SUM159乳腺癌细胞的分布与取向调控
2.2.1 对细胞的分布进行分析
SUM159乳腺癌细胞在3种不同底部宽度的沟槽基底都表现出明显的响应(见图3)。图3中,图F中标尺同样适用图A~图E。由图3可以看出,SUM159乳腺癌细胞在培养4 h时间节点时主要集中在基底底部,然而当培养时间到达72 h后细胞明显向基底顶部高度聚集,即使基底顶部细胞非常拥挤,基底底部细胞数量依然很少;同时也发现,细胞在基底顶部与顶部之间出现了跨桥现象,类似于之前的工作[19-20]。
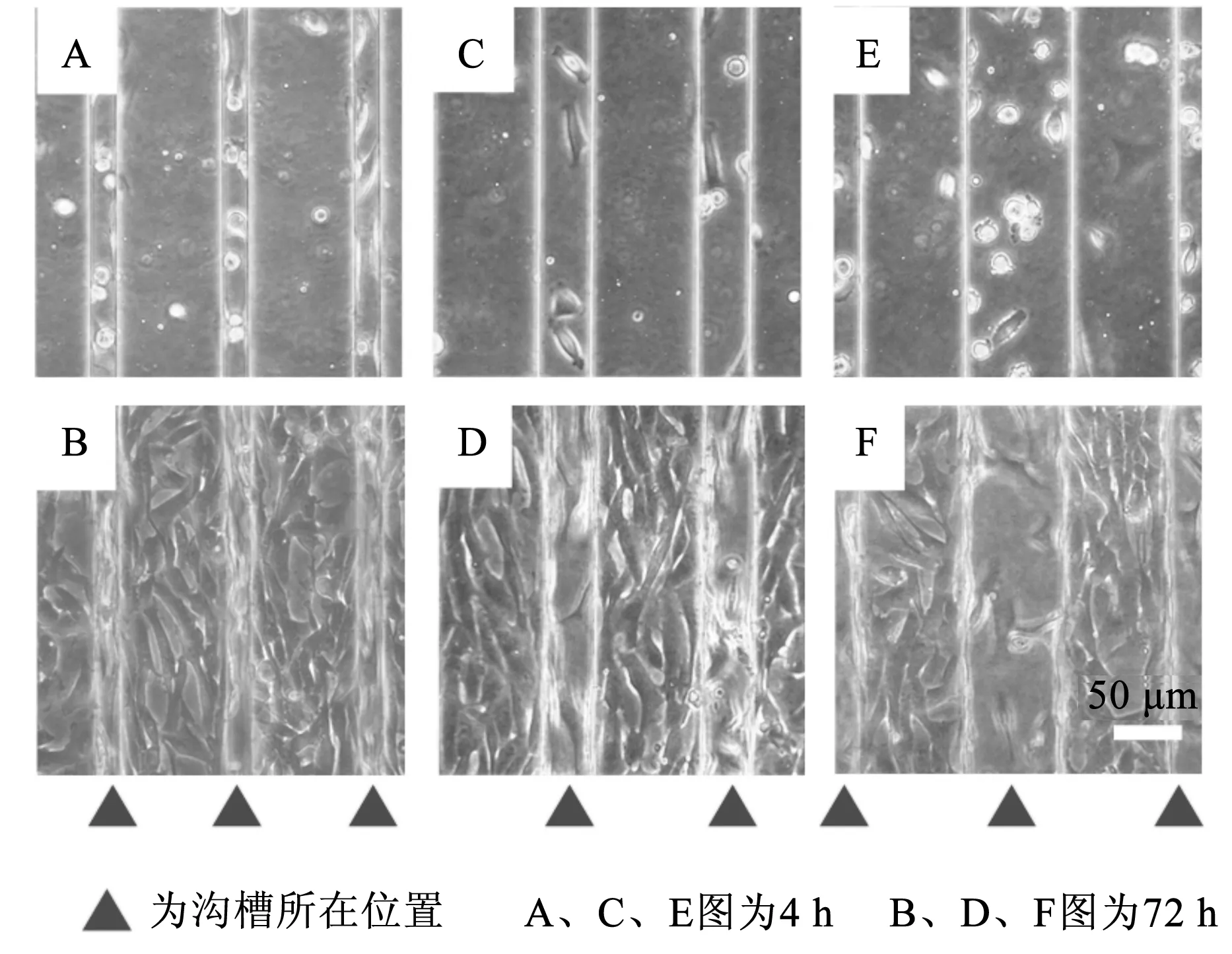
图3 SUM159细胞培养在底部宽度为25 μm(A和B)、50 μm(C和D)、100 μm(E和F)的PDMS沟槽基底上
为了对所观察的现象进行定量化分析,本文通过对沟槽基底顶部和底部细胞数量的统计,计算了各种几何尺寸沟槽基底顶部与底部细胞密度(单位面积上细胞数)之比(用R/G表示),作为随时间而变化的函数(见图4)。图4中,***表示显著性差异p<0.005。结果表明,对于SUM159细胞,经过24 h培养,相比于底部宽度为50 μm(R/G=0.26±0.06)和25 μm(R/G=0.49±0.21)的沟槽基底,在底部宽度为100 μm的沟槽基底(R/G=1.17±0.15)往顶部迁移趋势更强(p<0.005)。当培养时间达到72 h时,SUM159细胞在底部宽度为100 μm的沟槽基底(R/G=1.61±0.09)仍然表现出比底部宽度为50 μm(R/G=1.00±0.06)和25 μm(R/G=0.58±0.13)的沟槽基底更强的往顶部迁移趋势,其统计显著性差异p≪0.005。

图4 SUM159细胞在PDMS沟槽基底上的R/G
2.2.2 对细胞的形态及取向进行分析
本文将细胞长轴方向与垂直于沟槽方向的夹角θ定义为细胞的取向角,当取向角θ接近90°时,说明细胞胞体与沟槽取向一致;当θ接近0°或180°时,说明细胞胞体与沟槽方向垂直。SUM159乳腺癌细胞培养到72 h时,统计分析了上述3种尺寸沟槽基底的顶部细胞胞体取向,以PDMS平面基底上细胞胞体取向作为参照组(见图5),由图5可以看出,相对于其他2种尺寸沟槽基底,底部宽度为25 μm的沟槽基底上的SUM159乳腺癌细胞的胞体更显著地与沟槽方向一致,而在PDMS平面基底上,SUM159乳腺癌细胞胞体取向均没有表现出明显峰值(见图5中Control线)。

图5 SUM159细胞在PDMS沟槽基底上胞体关于沟槽方向的取向分布
2.3 拓扑微环境对MCF10A乳腺上皮细胞的分布与取向调控
2.3.1 对细胞的分布进行分析
在相同的拓扑微环境上,MCF10A细胞的分布与取向结果与上述SUM159乳腺癌细胞的结果明显不同(见图6)。图6中,图F中标尺同样适用图A~图E。在培养4 h后观察MCF10A细胞主要也是集中在基底底部,然而当培养时间达到48 h,MCF10A细胞仍然大量集中在基底底部,只有非常少部分在基底顶部。很明显,乳腺癌与正常乳腺上皮细胞对于拓扑微环境具有截然相反的响应。
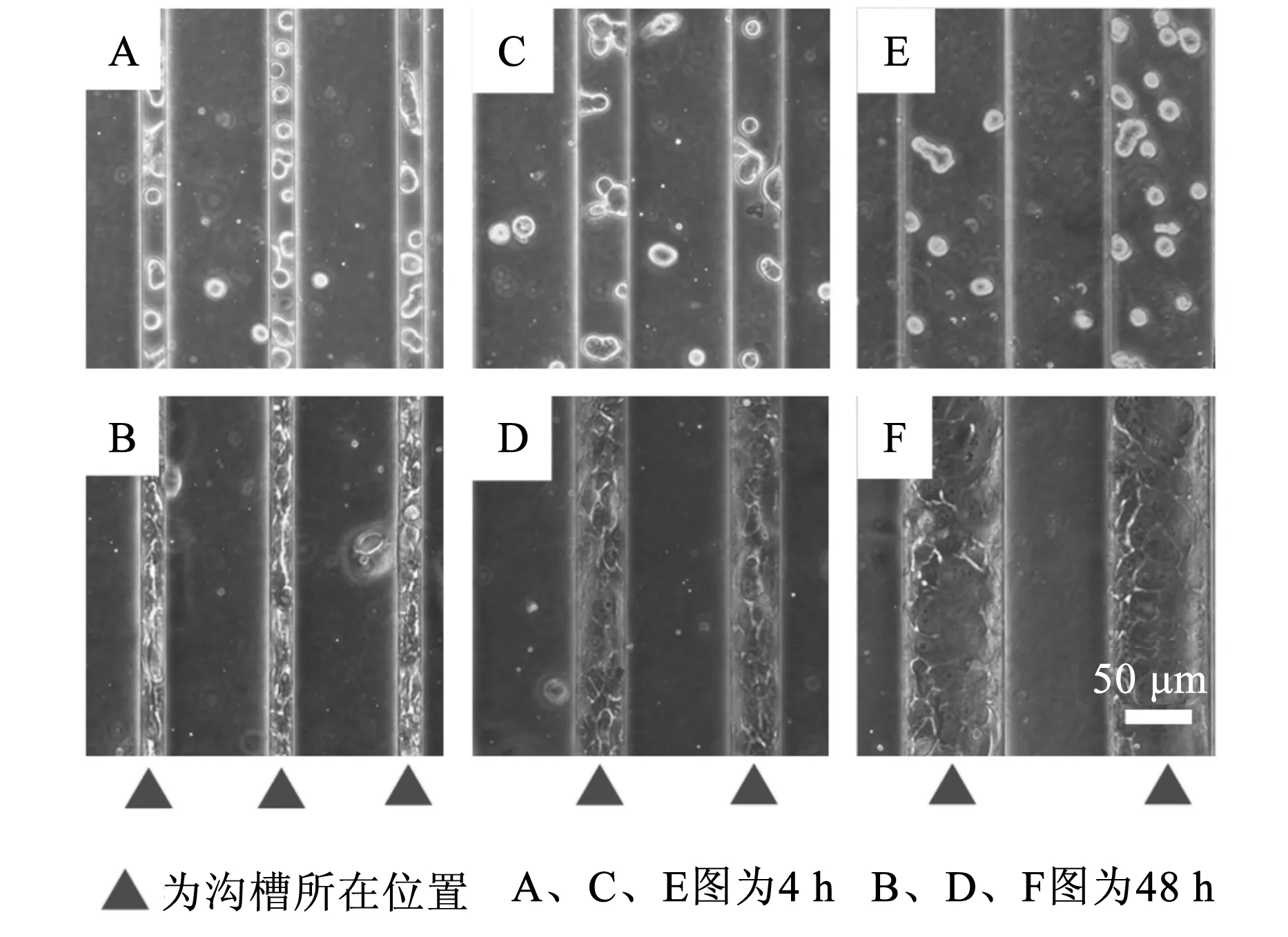
图6 MCF10A细胞培养在底部宽度为25 μm(A和B)、50 μm(C和D)、100 μm(E和F)的PDMS沟槽基底上
本文同样地对微沟槽顶/底的细胞数量进行统计分析。经过48 h培养后,MCF10A细胞在底部宽度为100 μm(R/G=0.09±0.02)、50 μm(R/G=0.05±0.03)和25 μm(R/G=0.02±0.01)的沟槽基底顶部数量稀少,其大部分都留在基底底部生长。因此,对于微沟槽拓扑基底,MCF10A细胞存在保持在底部生长的趋势。SUM159细胞在PDMS沟槽基底上顶部与底部细胞密度之比如图7所示。

图7 SUM159细胞在PDMS沟槽基底上R/G
2.3.2 对细胞的取向进行分析
本文统计分析了上述3种尺寸沟槽基底的底部细胞胞体取向分布,以PDMS平面基底上细胞胞体取向作为参照组(见图8),由图8可以看出,相对于其他2种尺寸沟槽基底,底部宽度为25 μm的沟槽基底上MCF10A细胞更趋于沿着沟槽方向生长;而在PDMS平面基底上,MCF10A细胞胞体取向均没有表现出明显峰值(见图8中Control线)。

图8 SUM159细胞在PDMS沟槽基底上胞体关于沟槽方向的取向分布
2.4 拓扑微环境对共培养SUM159/MCF10A细胞的分布调控
为了进一步研究细胞对受限环境的响应,本文将SUM159细胞和MCF10A细胞在上述基底(底部宽度为100 μm)进行共培养(总培养基为各自培养基1∶1配比)72 h,结果如图9所示。2种细胞都是通过Hoechst 33342对细胞核进行染色,从而可以更好地识别单个的SUM159细胞或MCF10A细胞。试验表明,在共培养的条件下,SUM159细胞和MCF10A细胞依然表现出各自单独培养时的特性。荧光和相差照片显示,SUM159细胞倾向于沟槽基底顶部,其细胞核之间距离较大(见图9中图A和图B);MCF10A细胞倾向于沟槽基底底部,其细胞核之间距离更小,胞间连接更紧密(见图9中图C和图D)。同时将2种细胞共培养于PDMS平面基底时,2种细胞处于随机分布状态(见图9中图E)。图9中,图A和图B聚焦在沟槽基底顶部,图C和图D聚焦在沟槽基底底部;图A和图C为荧光模式,图B和图D为相差模式;图D中100 μm标尺同样适用于图A~图C;图E为SUM159细胞和MCF10A细胞共培养在PDMS平面基底,虚线范围内为单个MCF10A细胞或MCF10A细胞团簇,其余的是SUM159细胞。

图9 SUM159细胞(A和B)和MCF10A细胞(C和D)在底部宽度为100 μm的PDMS沟槽基底共培养72 h
3 讨论
细胞的迁移和取向对于伤口愈合和癌症转移起着非常重要的作用[21-22]。本文研究了SUM159人类乳腺癌细胞和MCF10A人类乳腺上皮细胞在2.5维的微米尺度形貌基底上的空间分布与取向。其中,基底为PDMS沟槽基底,具有固定的深度(30 μm)和顶部宽度(100 μm),而底部宽度分别为25、50和100 μm。SUM159人类乳腺癌细胞表现出明显的趋顶性,即向微沟槽的顶部迁移并增殖;而MCF10A人类乳腺上皮细胞则表现出趋底性,即仍在沟槽底部生长并增殖。通过比较沟槽基底顶部和底部细胞密度比,证实了SUM159乳腺癌细胞倾向于往顶部迁移(底部宽度为100、50和25 μm的沟槽基底R/G随着培养时间增大),并且底部宽度为100和50 μm的沟槽基底对于引导SUM159细胞往顶部生长趋势更强(R/G >1)。而MCF10A细胞倾向于在底部生长(R/G≪1),虽然R/G并没有表现出明显地随着培养时间增加而降低,实际由于接种顶部细胞密度过低,R/G起始值很低。
通过试验分析可知,不同的拓扑微环境结构参数对细胞的取向性具有调控作用。底部宽度为25 μm的沟槽基底对2种细胞取向影响效果更明显。本文对PDMS沟槽基底使用I型胶原蛋白溶液进行功能化,虽然这种胶原蛋白能够促进细胞取向、迁移和接触引导,但是本文使用的是标准的功能化工艺,使胶原蛋白能够随机粘附在PDMS基底上,因此可以排除由胶原蛋白引起接触引导。另外,在PDMS平面基底上,细胞的取向都是随机的。最后本文将2种细胞在PDMS沟槽基底进行了共培养,同样2种细胞继续保持之前各自的特性,试验中得到了很好的空间分离效果,而当2种细胞共培养在平面基底时,其分布是随机的。
大量研究工作已经表明细胞行为受到基底形貌的影响,但是细胞对基底形貌产生感知并响应的内在机理目前还不清楚。由于肌动球蛋白的收缩参与细胞迁移调控,因此细胞牵引力形成部分感知机制[23-25]。有文献报道称纤维细胞也出现类似的趋顶性,其驱动力来源于沟槽基底顶部与底部的氧气浓度差[26],假如乳腺癌细胞和正常乳腺上皮细胞对于氧气的需求相同,乳腺癌细胞出现了趋顶性,而正常乳腺上皮细胞却出现了相反的结果;并且,在试验过程中,在基底表面有几毫米厚的液体,在沟槽基底只有30 μm距离的顶部与底部产生氧气浓度差足以驱动细胞产生不一致迁移特性的可能性很小,本文认为造成癌细胞与正常细胞空间分离的主要驱动力为乳腺癌细胞与上皮细胞的细胞功能不同。相对于正常乳腺上皮细胞,乳腺癌细胞能动性更强,其相应的肿瘤易转移;因此,往往是细胞的生理功能对感知具有表面形貌特征的微环境具有决定性作用。
4 结语
本文研究了2种细胞对PDMS微沟槽基底的响应。人类乳腺癌细胞表现出更倾向于在微米尺度的沟槽基底顶部生长,而人类乳腺上皮细胞则是倾向于在基底底部生长,当2种细胞共培养时同样保持原有的特性。物理受限环境在引导特定细胞对微米尺度形貌做出响应有着很重要的作用,能够将2种及以上的细胞在三维空间按照特定形式排布也许在细胞分布和增殖机理研究中有着重要意义。由于这2种细胞为研究乳腺癌的重要细胞模型,其迁移特性在癌症转移方面有潜在应用。
