胰腺囊性病变的诊治
2018-10-22孙聪慧沈柏用
孙聪慧 沈柏用
随着影像学技术手段的广泛应用,胰腺囊性病变的诊断率不断增加[1],无临床症状病人的胰腺囊性病变的检出率为2.4%~13.5%,并有随年龄的增加,40%的70岁以上病人在进行非胰腺适应证的腹部磁共振成像(MRI)时发现胰腺囊性病变[2]。相对胰腺囊性病变的高检出率,在25 195个研究对象中,仅有0.8%的病人囊肿>2 cm[3]。胰腺囊性病变可以是肿瘤性的(例如导管内乳头状黏液性肿瘤)或非肿瘤性的,非肿瘤性囊肿仅在有症状表现时才需要进行治疗,而一些胰腺囊性肿瘤因具有恶性潜能应予以切除,所以对囊肿进行病理学分类十分重要[4]。本文旨在回顾胰腺囊肿的分类,并基于2018年美国胃肠病学院(ACG)指南[5],讨论胰腺囊性肿瘤的诊断方法、治疗原则以及随访情况。
一、胰腺囊性病变
病理学上将胰腺囊性病变分为炎性积液、非肿瘤性胰腺囊肿(non-neoplastic pancreatic cysts, NNPCs)以及胰腺囊性肿瘤(pancreatic cystic neoplasms, PCNs)[6]。一些胰腺实性肿瘤也可以表现为囊肿(如胰岛素瘤)。胰腺囊性病变可以为单一疾病,也可伴发于基础性疾病,如与von Hippel-Lindau或多囊肾病相关。在一项针对158例von Hippel-Lindau的研究中发现77%的病人胰腺异常,70%的病人存在囊性病变,其中包括9%的浆液性囊腺瘤及9%的神经内分泌肿瘤[7]。常染色体显性多囊肾病病人中有7%~10%发现胰腺囊肿。
(一)炎性积液
炎性积液并不是真正的上皮囊肿,而是急性胰腺炎的局部并发症,曾经归类于胰腺假性囊肿。 2013年亚特兰大急性胰腺炎分类修订版更新了用于描述胰腺积液的术语,更好地反映其内在的病理生理学基础[8]。根据修订后的亚特兰大分类标准,炎性积液包括急性胰周积液、假性囊肿、急性坏死性积聚以及包裹性胰腺坏死。急性胰周积液常出现于急性间质性胰腺炎发生后4周。积液通常位于胰腺外,没有实性成分,不存在胰腺坏死,也没有囊壁对积液形成包裹。假性囊肿通常发生于急性胰腺炎发作4周以后,也可能发生于胰腺创伤之后,是更为成熟的胰周积液。一般位于胰腺外,也可能位于胰腺内,积液同样不存在实性成分或胰腺坏死,但不同于急性胰周积液,假性囊肿有边界明确的囊壁。急性坏死物积聚发生于坏死性胰腺炎,可能靠近胰腺或直接累及胰腺,没有明确的囊壁,可能含有液体和实性成分。包裹性胰腺坏死性是发生于急性胰腺炎发作4周以后,更为成熟的坏死物积聚。位于胰腺内或胰腺外,可能含有液体和实性成分,可伴有小腔形成。PCNs有时会引起急性胰腺炎,而患有急性胰腺炎的病人也可能同时存在PCNs。因此,急性胰腺炎发作时发现的囊肿并不可以均认为是炎性病变。
(二)NNPCs
NNPCs包括各种非常罕见的囊肿,一般无症状且不需要切除,但通常因术前被认为是PCNs,手术切除后才得以诊断。其中包括真性囊肿、潴留囊肿、非肿瘤性黏液性囊肿(mucinous non-neoplastic cysts,MNNCs)和淋巴上皮囊肿(lymphoepithelial cysts, LECs)[9]。真性囊肿,也称为良性上皮囊肿,仅有少数案例报道。这些囊性病变的囊壁可见立方上皮细胞排列,其发生机制尚不清楚。胰腺潴留囊肿是由于阻塞导致的胰管小分支扩张,梗阻的原因包括胰腺上皮内瘤变,慢性胰腺炎或囊性纤维化所导致的蛋白质产物凝结等。MNNCs近期才被提出来,这类囊肿与PCNs一样,内衬黏蛋白层,并且很难与PCNs区分。但它们没有任何肿瘤形成的特征(如异型性),也不与胰管相通。LECs是罕见的无症状良性囊性病变,无临床症状不需要切除[10]。通常位于胰周,由成熟的角化鳞状上皮细胞组成,周围有特殊的淋巴组织层[11]。可能需要超声内镜下细针抽吸活检(endoscopic ultrasound with fine needle aspiration, EUS-FNA)来鉴别诊断LECs和PCNs,在角蛋白碎片、无核鳞状细胞和多核组织细胞的背景中可以发现特征性的上皮细胞和小的成熟淋巴细胞[12]。
(三)PCNs
根据世界卫生组织的组织学分类标准[13-14],PCNs分为4种亚型:浆液性囊性肿瘤、黏液性囊性肿瘤(mucinous cystic neoplasm, MCN)、胰腺导管内乳头状黏液性肿瘤(intraductal papillary mucinous neoplasm, IPMN)和实性假乳头状肿瘤(solid pseudopapillary neoplasm, SPN)。
1.浆液性囊性肿瘤 其占胰腺囊性病变的16%,绝大多数为无症状的良性病变,称为胰腺浆液性囊腺瘤(serous cystadenoma, SCA),常见于50岁以上女性(75%)[15]。近期一项包含2 500多名病人的多中心研究发现SCAs恶变为浆液性囊腺癌的风险极低,为0.1%[16]。SCA从影像形态学上分为多囊型(或微囊型)、蜂巢型、寡囊型及实性型四种类型[17]。微囊型也称为多囊型,最为常见,70%的SCA为微囊型,占胰腺外分泌肿瘤的1%~2% 。通常由多个 (通常大于6个)囊壁菲薄的小囊组成,小囊的直径可以从几毫米到最大直径2 cm,30%的此型病人可见中央瘢痕。20%的SCAs为蜂巢型,由许多内含浆液的小囊泡叠加排列形成,剖面形似蜂巢型结构[18]。
50%的病人可根据EUS-FNA细胞学检查进行确诊,穿刺液中出现黏液和癌胚抗原>192 μg/L可以特征性排除黏液性囊腺瘤(mucinous cystadenoma, MCA)[19],穿刺液淀粉酶<250 U/L排除胰腺假性囊肿。含丰富糖原的扁平立方细胞及细胞染色的特征性变化均为确诊SCA的重要依据[20]。如果确诊为浆液性囊性肿瘤且病人没有症状,无需进行额外治疗和评估。只有当认为囊肿引起症状时,才需进行手术。如果之前没有症状的病人出现症状,需重复进行横断面成像检查[21]。
2.MCN 其几乎全部发生于女性病人,并且在中年时期最为常见。通常位置为胰腺的体部或尾部[22]。MCA为癌前病变,有可能发展成MCN伴浸润性癌[23]。近期一项包含90例MCNs的回顾研究发现10%的肿瘤表现为高度不典型增生或胰腺癌[24]。另外一项包含344例MCNs的报道表明,如果MCN小于3 cm,血清CA19-9正常且无“令人困扰特征”,则为不存在MCN表现的高度不典型增生或胰腺癌的病例。
3.IPMN 临床上根据IPMN在导管内发生位置的不同,分为主胰管型、分支胰管型及混合型[25]。病理学根据IPMN上皮细胞的异型性分为 IPMN伴低-中、高度异型增生和IPMN伴浸润性癌[6]。最常见IPMN为分支胰管型,实际也是最常见的PCNs。40%的IPMN表现为多病灶,然而,并没有证据表明多病灶性IPMN恶变风险增高[26]。尽管这些产生黏蛋白的囊肿有恶变潜能,但绝大多数分支胰管型IPMN不会进展为胰腺癌。主胰管型IPMN恶变风险相对较高,38%~68%的主胰管型IPMN的切除标本中存在高度不典型增生或胰腺癌[6]。绝大多数IPMN都根据临床和影像学进行诊断,而不是根据组织学诊断[27]。
4.SPN 其在女性中更常见(女∶男为10∶1)[28],年龄范围可以很广,在儿童和50岁以上的成年人中均有相关报道,但最常见于20多岁的女性。SPN可以发生在胰腺的任何部位。Law等[29]对484项研究进行了回顾性分析,结果表明SPNs最常见的临床表现是腹痛(63%),无症状及偶然发现(38%)。较小的肿瘤多为实性,较大的肿瘤为实性和囊性的混合病灶。病理学检查表明10%的SPNs具有侵袭性肿瘤行为。与胰腺导管腺癌不同,SPNs的预后非常好,5年生存率超过98%[30]。
5.囊性胰腺神经内分泌肿瘤 胰腺神经内分泌肿瘤很少见,通常无功能。可能是实性、囊性或混合形态。 可能偶尔发生或1型多发性内分泌腺瘤的个体发生。60岁以上女性和男性病人出现高峰期的情况同样常见。 需要EUS-FNA才能进行准确的诊断[31]。
二、诊断、处理和随访
大多数胰腺囊性病变无特异性临床症状[32],MRI或磁共振胰胆管造影术(MRCP)是首选的检查技术,二者无创、无辐射,并且在评估主胰管和囊肿之间的关系上具有更高的准确性(分支胰管型IPMN的特征性表现)[33]。对于无法接受MRI检查的病人,计算机断层扫描(CT)或EUS是最佳选择。如果不能准确判断囊肿性质,则可以补充进行第二种影像学技术检查,或者进行EUS-FNA 囊液分析及细胞学检查[34]。使用影像学诊断囊肿类型或判断肿瘤良恶性时,需谨慎评估。MRI或MRCP诊断囊肿类型的准确性为40%~50%,确定良性与恶性的准确性为55%~76%[35]。无FNA的CT和EUS检查准确性相似[36]。
如果病人无法耐受手术,对于偶然发现的胰腺囊肿,无论其大小,都不应该进行进一步的评估(图1)[5]。对于无临床症状并且通过影像学和病史诊断为假性囊肿或恶性风险非常低(如浆液性囊腺癌)的病人不需要治疗或者进一步评估。如果无法判断囊肿的性质,由于不同的囊液分析结果对应不同的治疗方式,则应考虑进行EUS-FNA和囊液分析。囊液癌胚抗原含量分析可以鉴别IPMN和MCN与其他囊肿类型,但不能区别具有高度不典型增生或恶性的IPMN和MCN。如果影像学特征不足以确定手术方式,应进行囊液细胞学检查以评估是否存在高度不典型增生性病变或胰腺癌。分子标记也可以帮助识别IPMN和MCN[37]。
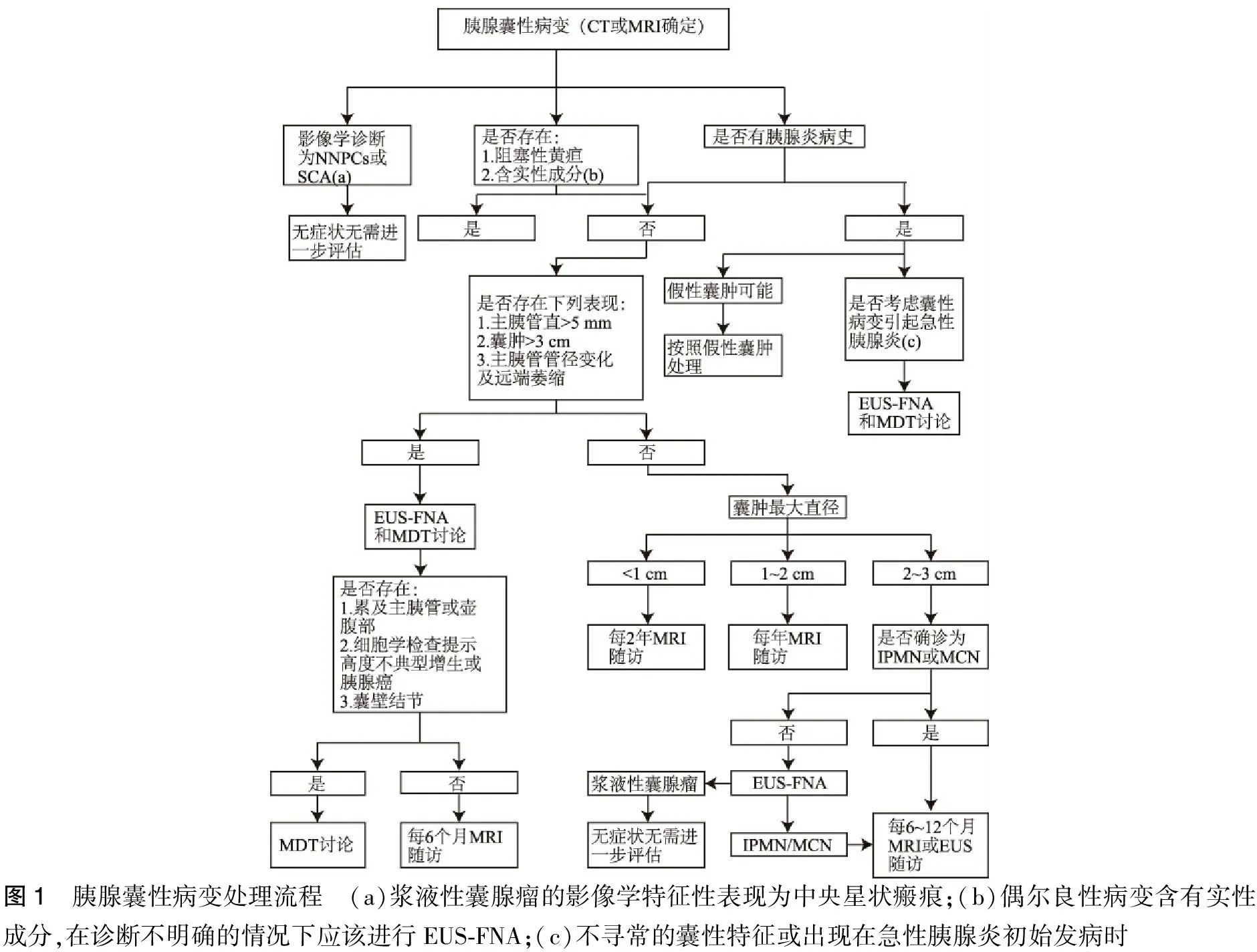
图1 胰腺囊性病变处理流程 (a)浆液性囊腺瘤的影像学特征性表现为中央星状瘢痕;(b)偶尔良性病变含有实性成分,在诊断不明确的情况下应该进行EUS-FNA;(c)不寻常的囊性特征或出现在急性胰腺炎初始发病时
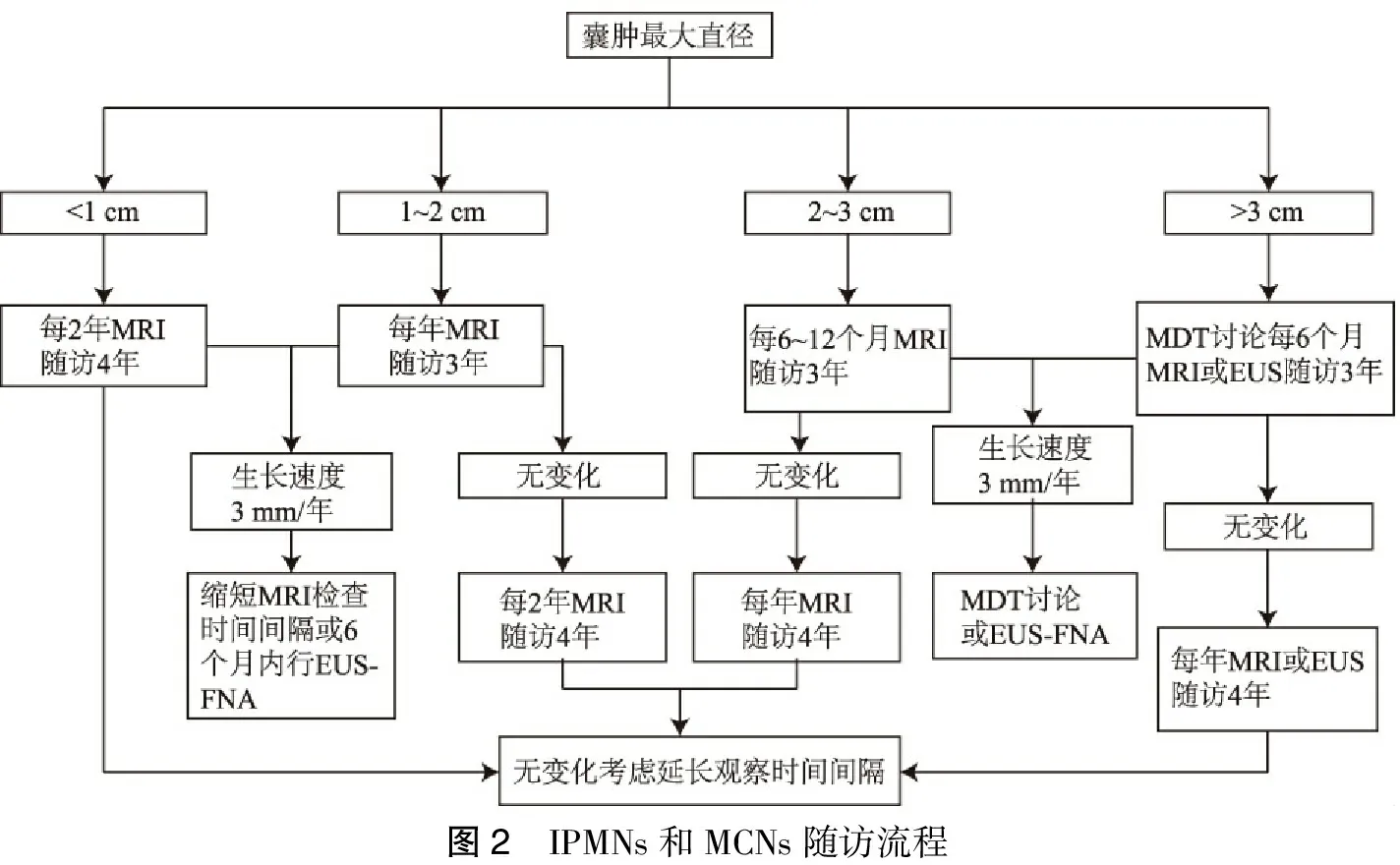
图2 IPMNs和MCNs随访流程
可以耐受外科手术诊断为IPMNs或MCNs的无症状病人应进行定期随访监测。伴有新发或恶化的糖尿病,以及囊肿大小(>3 mm/年)迅速增加的IPMN或MCN病人可能会增加恶性风险,因此应该进行短时间间隔的MRI或EUS-FNA检查随访。具有以下任何特征的IPMNs或MCN病人应接受EUS-FNA及MDT进行进一步评估[38-39]:①以下任何症状或体征:继发于囊肿的黄疸,继发于囊肿的急性胰腺炎,血清CA19-9显著升高[40];②以下影像学表现:囊肿或胰腺实质存在结节或实质性成分,主胰管扩张>5 mm,主胰管型IPMN或阻塞性病变导致的局部主导管胰管扩张,直径≥3 cm的产黏蛋白囊肿;③细胞学检查发现高度不典型增生或胰腺癌。
如果不存在以上需要增加监测或进一步评估的相关特征,则根据IPMNs和MCNs的囊肿大小规定随访时间(图2)[5]。
MRCP检查可以清楚显示主胰管结构且无辐射,所以是胰腺囊肿监测随访的首选检查方式,对于不能或选择不进行MRI扫描的病人,EUS是主要的监测方式。SPN病人应考虑手术切除。对75岁以上病人进行持续监测是有效和合理的,应充分考虑病人情况进行个体化诊疗。
三、结语
胰腺囊性病变的病理类型丰富且诊治极为复杂,包含从良性肿瘤到某些具有恶性潜能或恶性肿瘤的多种变化。目前,胰腺囊肿唯一可行的治疗方法是手术切除,然而,即使是具有恶性潜能类型的囊肿也很少会进展至胰腺癌。恶性转化的风险很小,手术治疗的高风险以及缺乏高质量的前瞻性研究导致了手术治疗和观察随访选择的相互矛盾。
