糖肾1号方含药血清对高糖环境下培养的HK-2细胞中 TGF-β1、α-SMA、FN mRNA和蛋白水平的影响*
2018-10-22王丽君杨熙凯王耀光
王丽君,杨熙凯,徐 冰,赵 晰,王耀光
(1.天津中医药大学,天津 300193;2.天津中医药大学第一附属医院,天津 300073)
随着糖尿病肾病(DN)的患病率越来越高,DN进入终末期肾病(ESRD)的人数逐渐上升,DN给个人、家庭、社会都带来了沉重负担[1-2]。肾纤维化几乎是所有慢性肾脏病进展为ESRD的共同途径,其中以DN肾纤维化最为显著[3]。随着对DN研究的不断深入,发现肾小管间质纤维化在DN进展中发挥着重要作用,延缓肾小管间质纤维化的研究对改善患者预后有重要意义[4]。目前干预DN肾纤维化主要从原发病入手,如控制血糖、调节血脂、改善肾脏血流动力学、保护肾功能等,而抗肾纤维化方面尚缺乏靶向药物。传统医学注重整体观念,在治疗上主张“分期辨治,辨证论治,综合治疗”,中医药干预、治疗DN具有较好疗效,近年来越来越多的学者开始把研究方向指向中医学。
糖肾1号方是王耀光教授治疗DN的经验方,在改善DN患者临床症状、调节糖脂代谢、降低尿白蛋白方面具有良好的疗效[5]。糖肾1号方早期动物实验研究发现糖肾1号方对早期DN大鼠的尿蛋白及尿微量白蛋白有明显改善作用,可增强机体氧自由基的清除能力,调节血清中炎症介质,进而延缓肾小球硬化程度,减轻脂质过氧化程度而改善血管内皮细胞功能[6]。为了进一步探究糖肾1号方的作用机制,本实验以高糖环境下诱导的人肾小管上皮细胞(HK-2)为研究模型,运用蛋白免疫印迹(Western blot)法和逆转录-聚合酶链反应(RTPCR)方法检测了转化生长因子-β1(TGF-β1)、α-平滑肌蛋白(α-SMA)、纤维连接蛋白(FN),及调控基因的mRNA表达量。以期通过现代实验室检测手段,揭示糖肾1号方可能的作用机制。
1 实验材料
1.1 实验细胞 本实验所用的HK-2细胞购自武汉普诺赛生命科技有限公司。
1.2 实验动物 SPF级SD雄性大鼠12只,体质量(250±10)g,购于北京维通利华实验动物技术有限公司,大鼠饲养于中国医学科学院放射医学研究所,普通饲料喂养。
1.3 实验药物 糖肾1号方:黄芪30 g,白术15 g,丹参 15 g,山药 30 g,鬼箭羽 15 g,川芎 12 g,防风15 g,防己 15 g,萆薢 15 g,生地 12 g,石菖蒲 15 g,地龙12 g,天津中医药大学第一附属医院国药堂提供,用时旋蒸浓缩,批号:2018002。
1.4 主要实验试剂与仪器 MEM ALPHA细胞培养基(批号C12571500BT,Gibco公司);胎牛血清(批号 sv30087.03,HyClone公司);胰蛋白酶 1∶250(Genview,货号:GP3108);4-甲基偶氮唑蓝(MTT,Beyotime公司),货号/批号:C0009/081817171103);TGF-β1、α-SMA、FN 抗体(Abcam 公司);葡萄糖(批号201710102,天津市风船化学试剂科技有限公司),配制为30 mmol/L的溶液。FORMA3111 CO2恒温培养箱(美国Thermo Fisher公司);AIRTECH生物安全柜(产地:中国);Nikon TE 300倒置相差显微镜(日本Nikon公司);Osterode离心机(德国Thermo Fisher公司);酶标仪(美国Thermo公司);电泳仪(北京六一仪器厂)。
2 实验方法
2.1 细胞培养 将HK-2细胞置于MEM ALPHA培养基中,并加入10%青霉素及链霉素100 μg/mL,在 95%O2、5%CO2、37 ℃条件下传代培养。
2.2 含药血清的制备 取健康SD雄性大鼠12只,测体质量,根据体质量分层随机分为空白血清组、糖肾1号方低剂量组、糖肾1号方高剂量组,每组4只,依据人临床用药剂量,计算出大鼠的等效剂量,本实验中糖肾1号低剂量组为等效剂量,高剂量组为等效剂量的5倍,低剂量组用药剂量18 g/kg,高剂量组用药剂量90 g/kg,灌胃给药;空白血清组使用生理盐水灌胃。灌胃剂量10 mL/kg,1次/日,共7 d。于第7天灌胃后30 min经大鼠股动脉取血10 mL,离心制备血清,56℃灭活,-20℃冻存备用。
2.3 细胞实验分组 1)空白组:MEM ALPHA培养基;2)高糖组:MEM ALPHA培养基+30 mmol/L葡萄糖;3)空白血清对照组:MEM ALPHA培养基+30 mmol/L葡萄糖+10%空白血清;4)糖肾1号方低剂量组:MEM ALPHA培养基+30 mmol/L葡萄糖+10%低剂量含药血清;5)糖肾1号方高剂量组:MEM ALPHA培养基+30 mmol/L葡萄糖+10%高剂量含药血清。
3 RT-PCR实验方法
3.1 引物设计 在NCBI基因库中查询所需要的相关基因序列,然后通过Primer 5引物设计软件来设计引物序列,设置好后与blast网站中的基因序列进行对比,最后确定目的基因的序列,具体信息见表1。
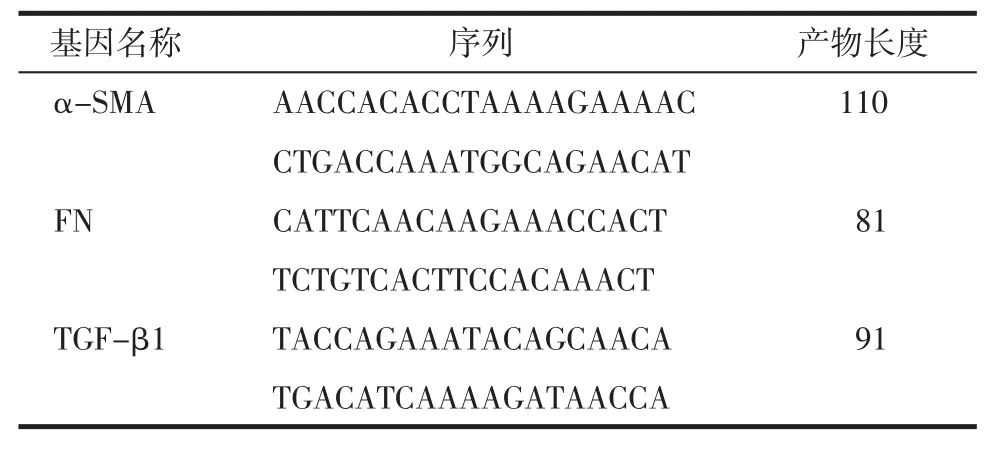
表1 引物序列列表Tab.1 List of primer sequences
3.2 实验方法 用Trizol提取肾HK-2细胞总RNA后,采用TIANScript RT KIT逆转录试剂盒进行反转录得到所需cDNA,选择β-actin为内参基因,用荧光定量PCR仪,进行定量PCR扩增,采用2-△△CT法进行数据的相对定量分析,具体实验步骤及添加试剂按照试剂说明书进行,所设置的反应体系 20 μL,反应条件为:95 ℃、15 min、1 个循环,95 ℃、10 s、40 个循环,58 ℃、30 s,72 ℃、30 s。
4 Western Blot实验方法
提取总蛋白后用考马斯亮蓝法测定各细胞样本蛋白含量。根据蛋白定量的结果,于离心管中加入相应体积的总蛋白样品和蛋白质凝胶电泳上样缓冲液并轻轻混匀,置于95℃加热片中进行蛋白变性处理10 min,然后迅速插入冰中冷却待用;将变性后的蛋白样品轻轻用加样器小心加至凝胶孔中,设置电泳仪参数为稳压状态并接通电源,将电压调至80 V进行电泳;裁剪好PVDF膜并置于100%甲醇中浸泡2~3 min使其活化,然后用水和电转液分别漂洗2 min;同时剪裁与胶同样大小的6层滤纸,并用转移缓冲液浸泡备用。电泳结束后取下电泳板,小心剥离夹板中的垫片并去掉上层玻璃板,切除浓缩胶部分,用电转液将含样品胶漂洗1次;按照从黑色负极开始依次为海绵垫片、3层滤纸、样品胶、PVDF膜、3层滤纸、海绵垫片,排列整齐后用玻璃棒轻压以排除多余的气泡,固定好放入含有转膜缓冲液的转移电泳槽中;设置电流130 mA,电压20 V左右,转膜时间为30 min。转膜结束后,逐层掀去各层,小心取出PVDF膜标记好正反面及样品顺序后放入封闭液中,水平摇床上缓慢震荡室温封闭1 h;将一抗用封闭液稀释;将封闭后的膜直接放入一抗工作液中,置于水平摇床上缓慢振荡室温孵育4 h;回收一抗,用TBST洗膜3次,将洗涤后的一抗反应膜以1∶3 000的比例放入二抗工作液中,室温、避光放摇床上缓慢摇动作用60 min;回收二抗,用1×TBST洗膜3次,用凝胶成像系统曝光及洗片,用Image J软件分析灰度值。
5 数据分析
实验数据用软件SPSS 22.0进行分析处理,以均数±标准差(±s)表示,多组间的比较采用单因素方差分析,组间两两比较若方差齐采用LSD法,若方差不齐采用Dunnett’s T3法,以P<0.05为差异有统计学意义。
6 实验结果
6.1 RT-PCR检测HK-2细胞中TGF-β1、α-SMA、FN mRNA的表达
6.1.1 TGF-β1 mRNA表达 与空白组相比,高糖组TGF-β1 mRNA表达明显增加,差异具有统计学意义(P<0.05);与高糖组相比,空白血清组 TGF-β1 mRNA表达量较多,但差异无统计学意义(P>0.05)。与高糖组相比,糖肾1号方低剂量组和糖肾1号方高剂量组TGF-β1 mRNA表达量均减少,差异具有统计学意义(P<0.05);与糖肾1号方低剂量组比较,糖肾1号方高剂量组TGF-β1 mRNA表达减少,差异具有统计学意义(P<0.05)。见表2。
6.1.2 α-SMA mRNA表达 与空白组相比,高糖组α-SMA mRNA表达明显增加,差异具有统计学意义(P<0.05);与高糖组相比,空白血清组α-SMA mRNA表达增多,但差异无统计学意义(P>0.05)。与高糖组相比,糖肾1号方低剂量组和糖肾1号方高剂量组α-SMA mRNA表达量均减少,差异具有统计学意义(P<0.05);与糖肾1号方低剂量组相比,糖肾1号方高剂量组α-SMA mRNA表达量减少,但差异无统计学意义(P>0.05)。见表2。
6.1.3 FN mRNA表达 与空白组相比,高糖组FN mRNA 表达增加,差异具有统计学意义(P<0.05);与高糖组相比,空白血清组FNmRNA表达无明显变化,差异无统计学意义(P>0.05)。与高糖组相比,糖肾1号方低剂量组和糖肾1号方高剂量组FN mRNA表达量均减少,差异具有统计学意义(P<0.05)。与糖肾1号方低剂量组相比,糖肾1号方高剂量组FN mRNA表达减少,差异具有统计学意义(P<0.05)。见表2。
表2 RT-PCR检测检测肾小管上皮细胞TGF-β1、α-SMA、FN mRNA的表达(相对β-actin的相对表达量,±s)Tab.2 RT-PCR detection of tubular epithelial cells TGF-β1,α-SMA,FN mRNA expression(relative to β-actin relative expression,±s)
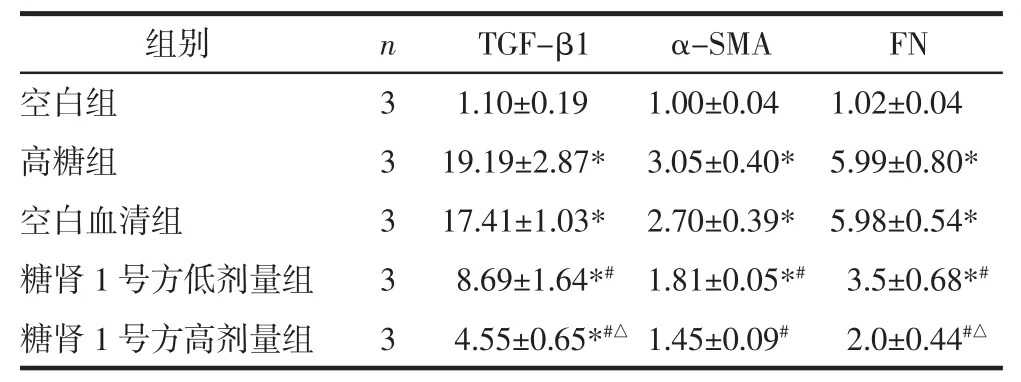
表2 RT-PCR检测检测肾小管上皮细胞TGF-β1、α-SMA、FN mRNA的表达(相对β-actin的相对表达量,±s)Tab.2 RT-PCR detection of tubular epithelial cells TGF-β1,α-SMA,FN mRNA expression(relative to β-actin relative expression,±s)
注:与空白组比较,*P<0.05;与高糖组比较,#P<0.05;与糖肾 1 号方低剂量组比较,△P<0.05。
组别 n TGF-β1 α-SMA FN空白组 3 1.10±0.19 1.00±0.04 1.02±0.04高糖组 3 19.19±2.87* 3.05±0.40* 5.99±0.80*空白血清组 3 17.41±1.03* 2.70±0.39* 5.98±0.54*糖肾 1 号方低剂量组 3 8.69±1.64*# 1.81±0.05*# 3.5±0.68*#糖肾 1 号方高剂量组 3 4.55±0.65*#△ 1.45±0.09# 2.0±0.44#△
6.2 WesternBlot法检测肾小管上皮细胞中TGF-β1、α-SMA、FN蛋白的表达
6.2.1 TGF-β1蛋白表达 与空白组相比,高糖组TGF-β1蛋白表达增加,差异具有统计学意义(P<0.05);与高糖组相比,空白血清组TGF-β1蛋白表达量减少,但差异无统计学意义(P>0.05);与高糖组相比,糖肾1号方低剂量组和糖肾1号方高剂量组TGF-β1蛋白表达量无明显变化,差异无统计学意义(P>0.05);与糖肾1号方低剂量组相比,糖肾1号方高剂量组TGF-β1蛋白表达量无明显变化,差异无统计学意义(P>0.05)。见表3和图1。
6.2.2 α-SMA蛋白表达 与空白组相比,高糖组α-SMA蛋白表达明显增加,差异具有统计学意义(P<0.05);与高糖组相比,空白血清组α-SMA蛋白表达减少,但差异无统计学意义(P>0.05)。与高糖组相比,糖肾1号方低剂量组α-SMA蛋白表达量减少,但差异无统计学意义(P>0.05);与高糖组相比,糖肾1号方高剂量组α-SMA蛋白表达量减少,差异具有统计学意义(P<0.05)。与糖肾1号方低剂量组相比较,糖肾1号方高剂量组α-SMA蛋白表达减少,但减少的灰度值无统计学差异(P>0.05)。见表3和图1。
6.2.3 FN蛋白表达 与空白组相比,高糖组FN蛋白表达增加,差异具有统计学意义(P<0.05);与高糖组相比,空白血清组FN蛋白表达减少,但差异无统计学意义(P>0.05);与高糖组相比,糖肾1号方低剂量组和糖肾1号方高剂量组FN蛋白表达量减少,差异具有统计学意义(P<0.05)。与糖肾1号方低剂量组比较,糖肾1号方高剂量组FN蛋白表达减少,但差异无统计学意义(P>0.05)。见表3和图1。
表3 Western blot法检测肾小管上皮细胞TGF-β1、α-SMA、FN蛋白的表达(相对 β-actin的灰度值,±s)Tab.3 Western blot to detect the expression of TGF-β1,α-SMA and FN in renal tubular epithelial cells(relative to the gray value of β-actin,±s)
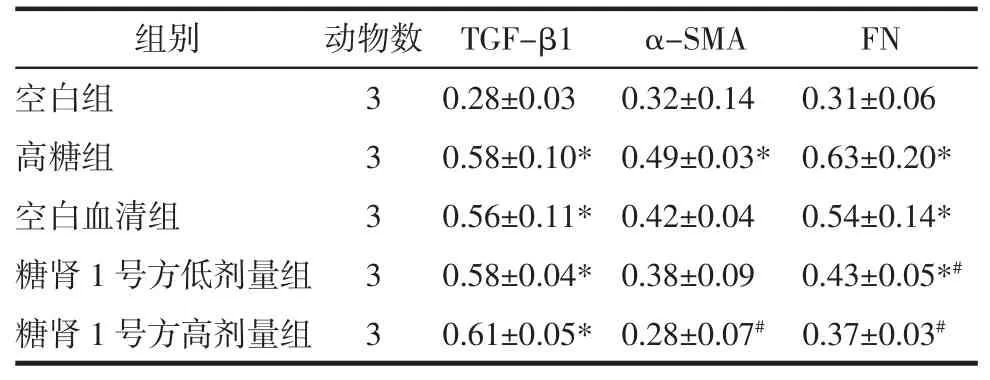
表3 Western blot法检测肾小管上皮细胞TGF-β1、α-SMA、FN蛋白的表达(相对 β-actin的灰度值,±s)Tab.3 Western blot to detect the expression of TGF-β1,α-SMA and FN in renal tubular epithelial cells(relative to the gray value of β-actin,±s)
注:与空白组比较,*P<0.05;与高糖组比较,#P<0.05。
组别 动物数 TGF-β1 α-SMA FN空白组 3 0.28±0.03 0.32±0.14 0.31±0.06高糖组 3 0.58±0.10* 0.49±0.03* 0.63±0.20*空白血清组 3 0.56±0.11* 0.42±0.04 0.54±0.14*糖肾 1 号方低剂量组 3 0.58±0.04* 0.38±0.09 0.43±0.05*#糖肾 1 号方高剂量组 3 0.61±0.05* 0.28±0.07# 0.37±0.03#

图1 各组TGF-β1、α-SMA、FN蛋白表达的比较Fig.1 Comparison of TGF-β1,α-SMA and FN proteinexpression in treatment groups of each group
7 讨论
DN是糖尿病最常见的并发症之一,早期临床表现为微量白蛋白尿,病理表现上表现为肾小球肥大、细胞外基质(ECM)增多、肾小球硬化和间质纤维化[7]。本病属于中医“关格”、“水肿”、“肾消”、“内消”、“下消”等范畴,中医学认为其病因主要与先天禀赋不足、后天饮食不节、平素情志失调、房劳过度、六淫邪毒等密切相关,病位主要在肺脾肾三脏。基本病机为本虚标实,早期多为气阴两伤,瘀血阻络,肾失封藏;日久脾肾俱损,阴阳两虚,夹有瘀血和水湿潴留,泛溢肌肤;病变晚期,肾阳衰惫,水湿泛滥,浊毒内停,上凌心肺。治疗上,因病机多为气阴亏虚,瘀血阻络,脾肾亏虚,故治以益气养阴,活血化瘀,健脾益肾。王耀光教授总结多年治疗DN的临床经验,认为DN的基本病机为本虚标实,虚实夹杂,本虚以脾肾亏虚、气阴两虚为主,以血瘀、痰浊、水湿为标,故提出健脾补肾、益气养阴、活血祛浊法为治疗DN的基本原则,自拟“糖肾1号方”。其主要药物组成为:黄芪、生地、白术、山药、丹参、鬼箭羽、川芎、石菖蒲、防己等。方中黄芪、生地、白术、山药益气养阴,健脾补肾;鬼箭羽、丹参、川芎、石菖蒲、防己破血通经、养血活血、祛风通络、化湿祛浊、利水消肿,标本兼治,共奏益气养阴、健脾补肾、活血化浊法。此外,继承黄文政教授活血通络、散结通络思想,认为DN肾纤维化属于湿浊瘀毒互织之“微型癥瘕”,因此临床上多配伍虫蚁搜剔之品以破血逐瘀通络,祛顽痰、破死血。瘀阻轻者可用蝉蜕、白僵蚕、地龙,稍重者可加用全蝎,瘀阻严重者可加用蜈蚣、乌梢蛇等[8]。
DN肾纤维化的发病机制比较复杂,与氧化应激、糖脂代谢紊乱、炎症反应等有关,还涉及多种信号转导通路、细胞因子、炎症介质等。目前干预DN肾纤维化主要从原发病入手,如控制血糖、调节血脂、改善肾脏血流动力学、保护肾功能等,经过前期临床观察,发现“糖肾1号方”可以控制血糖、调节血脂、降低24 h尿蛋白定量保护肾功能[5]。TGF-β1是目前公认的致纤维化细胞因子,在肾纤维化中发挥着关键作用,可调节肾小管上皮细胞向间充质转化(EMT)[9]。EMT是肾小管间质纤维化的关键环节之一。α-SMA是EMT的主要标记蛋白,是肌成纤维细胞产生的标志[10]。α-SMA表达的增多,说明成纤维细胞被活化,分泌和增殖胶原的能力增强,细胞外基质形成增多,促进纤维化的形成。因此,TGF-β1和α-SMA的表达对于EMT和ECM的进展及预后具有重要意义[11]。FN异常增高提示细胞外基质过度积聚,是糖尿病肾病肾间质纤维化的主要表现之一[12]。因此肾病纤维化的进程可以通过TGF-β1、α-SMA、FN的表达水平来反应。HK-2细胞自身具有非常强的可塑性,为适应不同的生存环境,可针对外来不同刺激作出相应的自身调节反应。高糖培养HK-2细胞24 h时出现细胞形态改变,细胞伸长呈梭形,轮廓界限不清晰。高糖培养短时间刺激其增殖,刺激ECM的分泌,促进表达,长时间刺激诱导HK-2细胞大量凋亡,并可诱导小鼠肾小管上皮向肌成纤维细胞转分化[13]。本实验以高糖环境下培养的HK-2细胞为模型,经糖肾1号方含药血清干预后,TGF-β1、α-SMA、FN mRNA 表达水平明显被抑制(P<0.05),相应的 α-SMA、FN 蛋白的表达水平也出现了明显的下调(P<0.05),这说明糖肾 1号方抗肾病纤维化的作用机制可能与其能够影响肾纤维化环路中关键基因及蛋白的表达水平有关。在高浓度含药血清与低浓度含药血清的比较中发现不同浓度对于TGF-β1和FN mRNA的表达有明显的差异,且高浓度含药血清功效明显优于低浓度含药血清。说明药量的不同,其药物效应也会产生一定的变化。
综上所述,糖肾一号方可治DN纤维化的作用机制可能为:该方可干预高糖环境下HK-2细胞TGF-β1、α-SMA、FN mRNA 及蛋白表达水平,通过下调TGF-β1、α-SMA及FN mRNA表达,进而下调α-SMA及FN蛋白表达,从而抑制肾间质纤维化过程中关键的EMT和ECM过度沉积过程,在一定程度上达到抑制肾间质纤维化过程的目的。故糖肾I号方或可在DN治疗中具有一定意义,有助于延缓DN进展至ESRD的进程。
