高寒湿地和草甸退化及恢复对土壤微生物碳代谢功能多样性的影响
2018-10-18刘振恒贾甜华李珊珊白彦福郭灿灿王惟惟AwaisIqbal周华坤尚占环
李 飞,刘振恒,贾甜华,李珊珊,白彦福,郭灿灿,王惟惟,孔 猛,张 涛,Awais Iqbal,周华坤,贾 宇,尚占环,,*
1 兰州大学生命科学学院,草地农业生态系统国家重点实验室,兰州 730000 2 甘肃省玛曲县畜牧林业局草原站,玛曲 747300 3 兰州大学草地农业科技学院,兰州 730070 4 青海省寒区恢复生态学重点实验室,中国科学院西北高原生物研究所,西宁 810008
土壤微生物是土壤营养转化、能量代谢的重要参与者,其群落多样性变化受到土壤肥力[1]及植被特性(组成、生物量)[2]的影响。其中,土壤因素是土壤微生物群落变化的主要影响因素,其次是生物(地上生物量、植物物种丰富度)和环境(年降雨量)因素[3]。植物从土壤中摄取养分,同时又通过残体及分泌物作用于土壤,而土壤微生物又是土壤养分循环的重要参与者,因此植被-土壤-土壤微生物三者间的相互作用,对于维持生态系统平衡十分重要[4]。土壤退化过程中,土壤肥力、植被性质的改变,必然影响土壤微生物群落多样性的变化。因此,土壤微生物群落结构变化可作为土壤及植被变化的指示因子。
青藏高原高寒湿地,对全球生态系统平衡具有重要意义。近年来,由于全球变暖和人为干扰等因素的影响,湿地干化程度加剧,湿地向草甸演替。加之高强度的放牧进一步造成草甸退化、生产力降低,荒漠化、沙化程度加深,鼠害泛滥[5-6],而草甸退化导致土壤碳损失、营养降低、含水量降低,土壤肥力下降等一系列问题的出现,进一步加剧了土壤退化。土壤微生物对气候及环境变化十分敏感,其群落结构变化也一定程度上反映了土壤营养状况[7],因此土壤微生物群落结构差异可指示土壤环境的变化。
BIOLOG Eco作为一种研究微生物群落功能多样性的方法,其通过土壤微生物对不同单一碳源的利用情况,直接获得土壤微生物整体活性[8]及代谢功能的差异[9],是研究土壤微生物群落功能多样性的主要方法[10]。目前针对草甸利用微生物碳代谢功能多样性的研究主要集中在不同植被类型、恢复措施、干扰(放牧、鼠害、围封、施肥)等方面,但目前尚未有综合分析高寒湿地、草甸变化过程中土壤微生物碳代谢功能多样性差异的研究。本文利用BIOLOG Eco研究退化及恢复干扰等因素作用下高寒湿地、草甸土壤微生物碳代谢功能多样性的变化规律,探究高寒地区土壤微生物多样性变化与土壤及植被性质的互作关系,为高寒地区生态系统退化和恢复及其评价提供依据。
1 材料与方法
1.1 样地概况
研究地点位于若尔盖湿地玛曲县范围,玛曲县位于甘肃省甘南藏族自治州(100°45′45″—102°29′00″E,33°06′30″—34°30′15″N),海拔3300—4806 m,属高寒湿润型气候,年平均气温1.2℃,降水量615 mm,年蒸发量1352.4 mm[11]。玛曲地区牧草资源丰富,素有“亚洲第一优质牧场”之称,同时也是黄河上游重要的水源涵养区,在畜牧业生产及生态系统服务功能方面具有重要价值。在全球变暖等自然及人为因素干扰下,玛曲地区出现湿地萎缩、草场退化、水源涵养能力下降、土壤沙漠化等一系列环境问题[12]。针对这些问题,国家提出退牧还草、鼠害防治、防沙治沙等措施,但这些措施并未使退化趋势得到有效遏制[13]。湿地不断退化,减少面积大部分转变为草甸,部分草甸也呈现退化趋势,土地沙漠化面积得到有效控制[14-15]。
实验按照玛曲湿地、草甸变化序列,从湿地到沼泽化草甸、退化草甸,及人工恢复设置研究样地。样地有湿地(MQ- 1、MQ- 2)、沼泽化草甸(MQ- 3、MQ- 4)、高寒草甸(MQ- 5、MQ- 6、MQ- 7)、退化草甸(MQ- 10→MQ- 11→MQ- 12→MQ- 13→MQ- 14)、人工恢复草甸(MQ- 8、MQ- 9)。其中,MQ- 1、MQ- 2分别为两种类型湿地,MQ- 3和MQ- 4均为沼泽化草甸,高寒草甸中包含两种草甸(灌丛草甸MQ- 5和草甸(MQ- 6和MQ- 7))、退化草甸按退化强度进行分类,人工恢复草甸MQ- 8和MQ- 9分别为混播和单播人工草甸。各样地基本情况见表1。土壤以泥炭土、草甸土为主。样地植被以湿地、草甸植被为主,湿地主要优势植被种分别为:碱毛茛(Halerpestesruthenica(Jacq.) Ovcz.)、两栖蓼(PolygonumamphibiumL)、海韭菜(Triglochinmaritimum)、水麦冬(Triglochinpalustre)等。草甸主要优势植被种分别为:青藏苔草(CarexmoorcroftiiFalc. ex Boott)、矮嵩草(Kobresiahumilis(C. A. Mey. ex Trautv.) Sergiev.)、雪蒿(ArtemisiaroxburghianaBess.)、黄帚橐吾(Ligulariavirgaurea(Maxim.) Mattf.)、金露梅(Potentillafruticosa)、披碱草(ElymusdahuricusTurcz.)、早熟禾(PoaannuaL.)、华扁穗草(BlysmussinocompressusTang et Wang)、长毛风毛菊(SaussureahieracioidesHook.f.)、异针茅(StipaalienaKeng)等。
1.2 土壤和植物样品采集
于2015年8月,在甘肃省玛曲县境内,选取14种不同类型样地,调查植物覆盖度并采集植物和土壤样本。植物样品采用“0.5 m×0.5 m”样方,齐地刈割后带回实验室,105℃杀青30 min,65℃烘干至恒重,测定地上生物量,粉碎后测定氮磷含量,3次重复(灌丛草甸采用“1 m×1 m”样方[16])。根样采集使用土钻钻取土芯,去除表面凋落物[17],3次重复,各重复间相距至少10 m,自封袋带回实验室清洗干净,65℃烘干至恒重,粉碎后测定氮磷含量,3次重复。土壤样品采用“三点混合法”取样,3次重复,各重复间相距至少10 m,并剔除土壤样品中石块及植物残体,装入自封袋中,用冰袋将样品运回实验室,过2 mm筛(湿地样品剔除植物残体及碎石),部分4℃冰箱保存备用,其余风干测定土壤理化性质。
1.3 土壤和植物样品理化性质测定
土壤基本理化性质见表2,pH采用pH计(Sartorius PB- 10,德国)测定,土壤有机碳采用重铬酸钾-内稀释热法测定,土壤、植物及根的全氮、全磷采用流动注射分析仪(FIAstar 5000 Analyzer,瑞典)测定,土壤含水量采用烘干法测定,土壤容重采用环刀法测定[18- 19]。
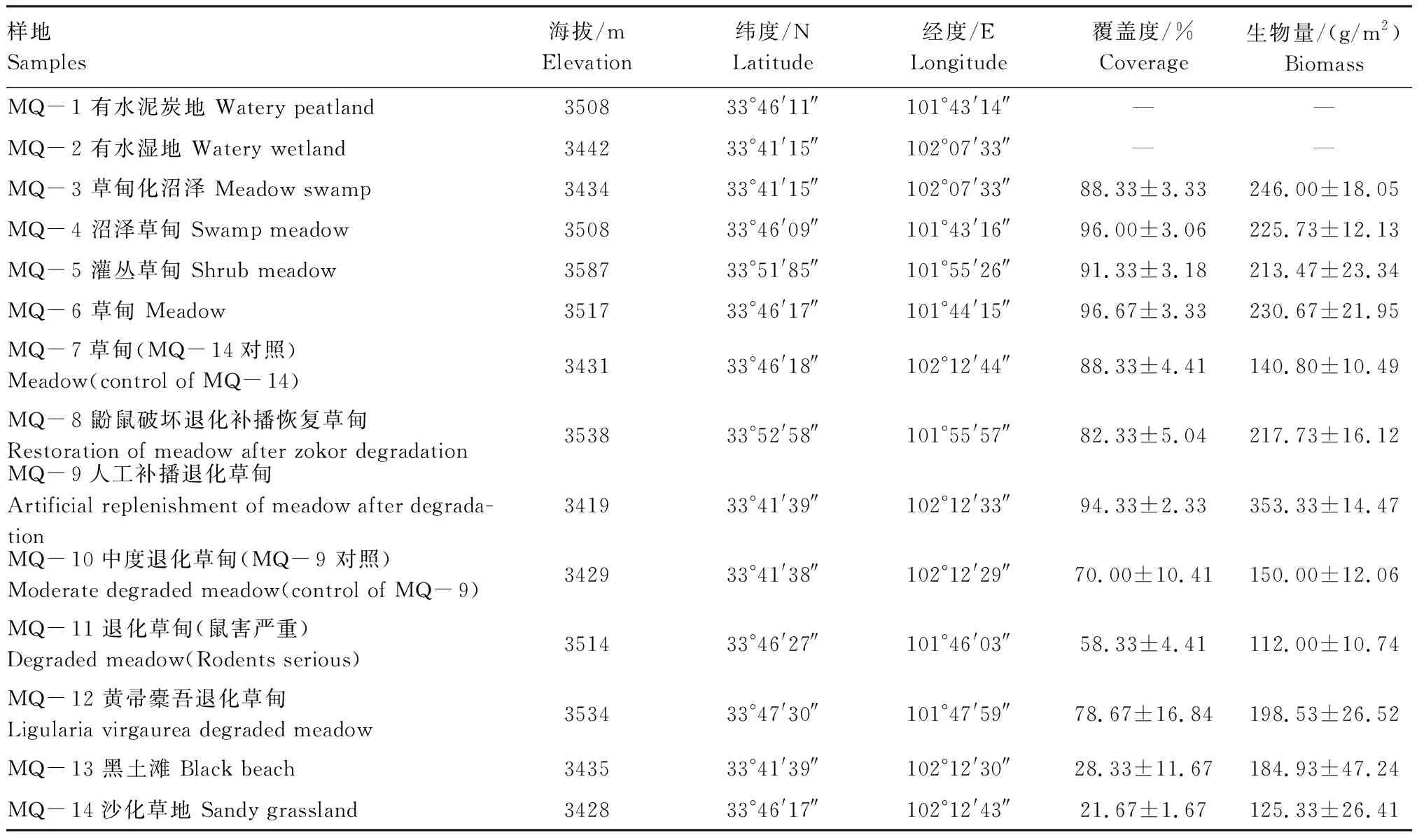
表1 各样地基本概况
由于MQ- 1与MQ- 2为湿地,植物样品采集困难,故没有覆盖度及生物量数据

表2 土壤基本理化性质
同列不同字母表示差异显著(P<0.05); 由于MQ- 1为湿地,样品采集困难,故没有容重数据。TOC:总有机碳,total organic carbon; TN:全氮,total nitrogen; TP:全磷,total phosphorus
1.4 土壤微生物群落碳代谢功能多样性测定
本实验采用美国BIOLOG Eco Microplate测定土壤微生物群落碳代谢功能多样性。BIOLOG Eco微平板为96孔板,板内包含3次重复,每个重复中含六大类(碳水化合物类(7种)、氨基酸类(6种)、羧酸类(10种)、胺类(2种)、磷酸化物质类(2种)、聚合物类(4种))[20]共31种不同单一碳源和一个空白对照,且其中多种碳源为根系分泌物。将土壤稀释液接种于孔内进行培养,土壤微生物利用板内碳源使其发生颜色反应,利用酶标仪(Thermo Multiskan FC,芬兰)读数,获得土壤微生物特征参数,从而很好的反映土壤微生物群落水平碳代谢功能多样性。
称取10 g混合均匀的新鲜土壤于250 mL锥形瓶中,在超净工作台中加入90 mL无菌生理盐水(0.85% NaCl),封口膜封口,置于200 r/min的摇床上震荡20 min,4 ℃静置。取上清液,加入无菌生理盐水稀释103倍。将BIOLOG Eco板预热至25 ℃,用8通道移液枪吸取150 μL稀释液加入96板中,25℃恒温培养箱培养7天[20],每隔24 h用酶标仪读取595 nm吸光值数据[21-22]。
计算公式如下:
式中,AWCD(average well color development)为平均颜色变化率(微生物碳代谢活性);Ci表示反应孔对应的吸光值;R表示对照孔的吸光值;n表示碳源数量。
式中,U为McIntosh均匀度指数;ni为第i孔的相对吸光值(ni=Ci-R)。
H′=-∑Pi·lnPi
式中,H′为Shannon丰富度指数;Pi为第i孔的相对吸光值ni除以总的相对吸光值。
1.5 数据统计分析
利用Excel对样地基本数据进行计算和作图,数据采用均值±标准误进行统计。利用SPSS 21.0对数据进行单因素方差分析、Duncan多重比较。利用Pearson相关分析比较培养144 h时的AWCD值、均匀度指数U、丰富度指数H′和土壤及植被理化性质间的相关关系。利用Canoco for windows 4.5对土壤微生物碳代谢功能多样性数据与理化性质进行除趋势对应分析(DCA),确定排序方式为冗余分析(RDA),对结果进行Monte Carlo检验,并使用CanoDraw for windows进行绘图。
2 结果
2.1 土壤微生物群落整体活性
平均颜色变化率(AWCD)表示土壤微生物群落的整体活性,也表示对碳源的整体利用情况。随着培养时间的增加,AWCD值迅速升高,144 h后数值变化趋于平缓,生长趋势呈“S型”增长,表明土壤微生物在不断利用碳源。整体而言,不同类型样地土壤微生物活性有差异。其中,沼泽草甸和草甸化沼泽AWCD值最大,沙化草地AWCD值最小。
利用微生物活性变化趋于平缓的144 h AWCD值对玛曲地区不同类型样地进行分析(图1)。144 h AWCD值随退化及干扰强度增加呈 “先上升后下降”的趋势,表明随退化程度的加深,土壤微生物总体活性先升高后逐渐降低。有水泥炭地和有水湿地均属于湿地,但其微生物活性上也存在差异。沼泽草甸微生物活性最高。人工补播后的退化草甸AWCD升高,表明补播一定程度上提高了微生物总体活性。黄帚橐吾退化草甸由于毒杂草的侵入,AWCD值明显下降,表明毒杂草侵入降低了微生物整体活性。黑土滩及沙化草地相比于草甸,AWCD值降低,表明草甸退化使得微生物活性显著降低。
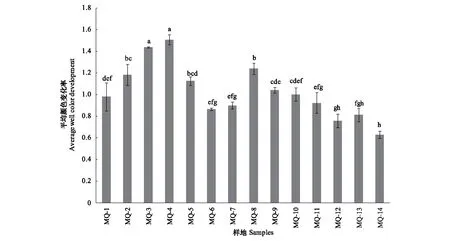
图1 调查样地144 h AWCD值比较Fig.1 Comparison of 144 h AWCD values of samples不同字母表示差异显著(P<0.05)
2.2 土壤微生物多样性指数
土壤微生物多样性指数结果如图2所示。McIntosh均匀度指数变化趋势与AWCD(平均颜色变化率)相似,整体呈现 “先上升后下降”。沼泽草甸和草甸化沼泽McIntosh指数最高,沙化草地McIntosh指数最低。MQ- 9补播草甸相比于MQ- 10草甸,McIntosh指数有所增加,但不显著。沙化草地McIntosh指数显著低于对照草甸。MQ- 8补播草甸McIntosh指数显著升高。Shannon丰富度指数表示群落差异度,反映群落丰富度。草甸化沼泽Shannon丰富度指数最高,沙化草地、有水泥炭地和有水湿地Shannon丰富度指数最低,其余样地差异并不显著。
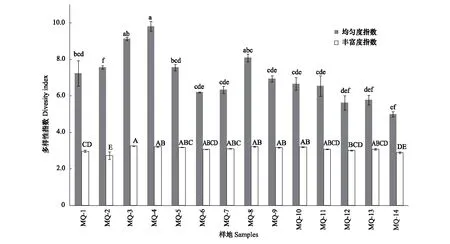
图2 不同类型样地土壤微生物多样性指数Fig.2 Soil microbial diversity indexes of different types of samples不同字母表示差异显著(P<0.05)
2.3 相关性分析
AWCD与土壤pH、有机碳、全氮、TOC/TN、TN/TP、含水量、容重、覆盖度都有显著相关性,McIntosh均匀度指数(U)与有机碳、全氮、TOC/TN、含水量、容重、覆盖度均有显著相关性,而Shannon丰富度指数(H′)与土壤理化性质无显著相关性,却与植物覆盖度、氮磷含量有显著相关性,AWCD、McIntosh均匀度指数(U)和Shannon丰富度指数(H′)之间存在极显著正相关关系(表3)。由此可知,土壤微生物群落碳代谢活性(AWCD)较其均匀度和丰富度对植被与土壤性质响应更为敏感;均匀度较丰富度对土壤性质敏感,而后者较前者对植被地上部分氮磷含量更敏感,说明土壤微生物碳代谢功能多样性可指示土壤及植被理化性质的变化,且微生物群落碳代谢丰富度主要依赖地上植被氮磷含量,而其代谢活性及均与度主要依赖土壤性质的变化。
2.4 土壤微生物碳代谢功能多样性冗余分析
首先对土壤微生物碳代谢功能多样性数据进行DCA分析,确定排序方式为RDA。不同样地土壤微生物碳源利用率与环境变量的关系如图3所示。图中第一、二轴对变量的解释率分别为54.2%、16.6%,共解释变量的70.8%(Monte Carlo permutation 999,P=0.001)。第一轴解释了大多数变量,其中各环境对土壤微生物碳代谢功能多样性的影响(表4)如下:碳氮比>含水量>总有机碳>全氮>容重>覆盖度>氮磷比>pH>植物含磷量>植物含氮量。其中,碳氮比、含水量、有机碳、全氮对土壤微生物碳代谢功能多样性有极显著影响(P<0.01),容重、覆盖度、氮磷比、pH对土壤微生物碳代谢功能多样性有显著影响(P<0.05),植物氮磷含量对土壤微生物无显著影响(P>0.05)(表4)。

表3 植物及土壤理化性质对土壤微生物碳代谢功能多样性的贡献率
*,P<0.05;**,P<0.01.TOC/TN:总有机碳与全氮的比值,the ratio of total organic carbon to total nitrogen; TOC:总有机碳,total organic carbon; TN:全氮,total nitrogen; TN/TP:全氮与全磷的比值,the ratio of total nitrogen to total phosphorus; TP(Grass):地上部分全磷含量,total phosphorus of aboveground; TN(Grass):地上部分全氮含量,total nitrogen of aboveground

表4 AWCD、U、H′与植物及土壤理化性质之间的相关性分析
*,P<0.05;**,P<0.01

图3 不同类型样地土壤微生物碳源利用率与环境变量的冗余分析Fig.3 Redundancy analysis of soil microbial carbon source utilization and environmental variables in different types of samples冗余分析表示土壤微生物碳代谢情况(符号)与环境变量(箭头)间的关系;TP(Grass):地上部分全磷含量,total phosphorus of aboveground; TN(Grass):地上部分全氮含量,total nitrogen of aboveground; Coverage:植被覆盖度,the coverage of plants; Moisture:土壤含水量,the moisture of soil; TN:土壤全氮含量,the total nitrogen of soil; TOC:土壤有机碳含量,the total organic carbon of soil; TOC/TN:总有机碳与全氮的比值,the ratio of total organic carbon to total nitrogen; TN/TP:全氮与全磷的比值,the ratio of total nitrogen to total phosphorus; pH:土壤pH值,pH value of soil; Bulk density:土壤容重,the bulk density of soil
3 讨论
AWCD(平均颜色变化率)通过土壤稀释液对碳源利用的吸光值变化来表示土壤微生物活性,其变化能很好地反映整体微生物功能多样性[23]。湿地干化并逐渐向沙漠化转变的退化过程中,土壤微生物活性先升高后降低。其中草甸化沼泽(MQ- 3)、沼泽草甸(MQ- 4)是湿地向草甸演替的中间过程,其微生物活性最高。相比于湿地,沼泽化草甸含水量、有机碳含量适当,利于微生物生长。有水泥炭地(MQ- 1)和有水湿地(MQ- 2)均为湿地,但MQ- 1土壤微生物活性显著低于MQ- 2(P<0.05),主要是因为MQ- 1的土壤营养状况及含水量均低于MQ- 2。灌丛草甸MQ- 5相比于沼泽化草甸,其土壤微生物活性显著下降(P<0.05),而相比于草甸(MQ- 6、MQ- 7),其土壤微生物活性显著增加(P<0.05)。主要是因为随着退化程度的加剧,草甸荒漠化加深,土壤理化性质明显改变,土壤肥力下降,植被类型减少,毒杂草逐步成为优势种,微生物多样性呈下降趋势。人工补播草甸(MQ- 8、MQ- 9)通过影响植物覆盖度,进而对微生物多样性产生影响[24],且混播(MQ- 8)比单播(MQ- 9)显著提高了土壤微生物活性(P<0.05)。
冗余分析结果表明,不同类型样地对碳源的利用情况存在差异。碳源利用率结果显示,聚合物类、氨基酸类、碳水化合物类是各样地土壤微生物主要利用的碳源,其次为羧酸类、胺类,磷酸化物质类利用率最低。聚合物类中含有糖类及氨基酸的中间代谢物[21];氨基酸类为土壤有机氮的主要来源,是植物根系分泌到土壤的有机化合物之一[25];碳水化合物类为土壤中最重要的有机成分之一[26]。
土壤微生物群落碳源利用差异主要受土壤营养状况[27]、物理特性及植被[28]的影响。本研究结果表明,土壤有机碳、全氮、含水量、C/N、N/P、植物覆盖度与微生物功能多样性呈显著正相关(P<0.05),而土壤pH与土壤微生物功能多样性呈显著负相关(P<0.05)。前人研究也发现,土壤微生物多样性主要受pH[29]、有机碳[30- 31]、全氮[30,32]、碳氮比[33]、氮磷比[31]、含水量[30]、容重[34]、植物覆盖度[31]等因素的影响。土壤容重通过影响土壤孔隙度、通气状况直接对土壤微生物(特别是好氧微生物)产生影响[34]。地上植被覆盖度影响土壤含水量[35],土壤含水量、氮磷比又通过限制植物生长,影响植物覆盖度、生物量及丰富度[31,36],进而间接影响土壤微生物活性。土壤含水量又是影响土壤碳氮循环过程中相关微生物的关键因素,其通过影响土壤有机碳、全氮,进而对土壤微生物活动尤其是碳氮循环产生影响[37]。
湿地由于气候变暖及人为干扰等因素的影响,逐渐演替为沼泽化草甸,而人为排干进一步促使向高寒草甸演替,加之放牧等因素的影响,高寒草甸不断退化并不断向荒漠化演替。随湿地退化程度的加剧,土壤营养状况下降,影响植物生长,进而对土壤微生物产生影响,而土壤微生物又是参与矿化、有机质分解、养分循环的重要因子,因而导致三者处于恶性循环,退化程度加剧。补播使得土壤微生物群落功能多样性有所增加,主要是人工补播使得土壤理化性质及植被性质改变[38],土壤营养状况有所改善,因而人工补播对于高寒退化草地恢复十分重要[39]。因而,维持“植物-土壤-微生物”三者间的平衡,对于湿地恢复十分重要。
4 结论
不同类型样地土壤微生物在对单一碳源利用上存在显著差异。其中,草甸化沼泽对碳源的利用率最高,其次是湿地;随退化程度加剧,草甸对碳源利用率降低,沙化草地利用率最低;人工补播草甸能一定程度的改善土壤微生物活性,提高碳源利用率;湿地、草甸退化及恢复对土壤微生物碳代谢功能多样性造成了显著的影响(P<0.05)。土壤微生物对6大类碳源代谢能力表现为:聚合物类利用效率最高,其次为氨基酸类、碳水化合物类、羧酸类、胺类,聚合物类利用效率最低。RDA分析发现,土壤微生物群落结构有明显的差异。土壤微生物群落结构的差异主要受土壤、植被理化性质的影响,其中碳氮比、含水量、有机碳、全氮对土壤微生物多样性有极显著影响,而容重、氮磷比、pH、植物覆盖度对其有显著影响。
