食管鳞癌中CDK16的表达及其临床病理意义
2018-10-16景嘉楠李铁鹏董子明
郑 皓,景嘉楠,李铁鹏,夏 鑫,轩 阁,董子明
(1.郑州大学 基础医学院,河南 郑州 450001;2.河南省肿瘤医院,河南 郑州 450008;3.郑州大学 公共卫生学院,河南 郑州 450001;4.生物芯片上海国家工程研究中心,上海,201203)
0 引言
细胞周期分为G1、S、G2和M期,细胞周期由细胞周期素(Cyclins)、细胞周期素依赖性激酶(Cyclin Dependent Kinases, CDKs)、细胞周期素依赖性激酶抑制蛋白(Cyclin Dependent Kinase Inhibitor, CDKI)共同调节[1-3].细胞呈现自主且无节制的增殖,即细胞周期调节失控可以导致肿瘤的发生[4-6].食管癌(Esophageal Cancer, EC) 在全球范围内的发病率在恶性肿瘤中位居第8位,死亡率居第6位[7,8].我国是世界上食管癌高发国家,每年食管癌新发病例超过22万例,死亡超过20万例[9].人类CDK16基因定位于染色体Xp11.23.由CDK16基因编码的细胞周期素依赖性激酶16 (Cyclin Dependent Kinase 16, CDK16)也被称为PCTAIRE1或PCTK1[10].CDK16是一种丝氨酸/苏氨酸蛋白激酶,可在终末分化细胞的信号转导通路中,以及在胞吐分泌和分泌型蛋白从内质网上运输的过程中发挥作用[11-13].
研究表明,细胞周期素依赖性激酶16(Cyclin Dependent Kinase 16, CDK16)在多种肿瘤中高表达,并在肿瘤细胞增殖、侵袭、迁移以及凋亡的过程中发挥着重要的作用[14-17].对食管鳞癌的诊断标志物已经有一些研究[18],但是CDK16在食管癌中的表达情况目前尚不明晰.食管癌患者预后差,死亡率高[19].因此研究CDK16在食管癌中的表达及临床病理意义,可为阐明CDK16参与食管癌发生发展的分子机制,以及为食管癌的诊断和防治提供新的依据.另外使用组织芯片技术可以同时研究某个蛋白在几十个或上百个病例样本中的表达.由于实验条件一致,可以最大限度地降低实验误差,提高实验结果的可信度[20,21].
本研究利用组织芯片研究CDK16在各类型食管癌(鳞癌、基底细胞样鳞癌、梭形细胞鳞癌、腺癌、腺鳞癌、未分化癌)以及15例原发型食管鳞癌(每1例包括癌/癌旁/淋巴结各1点)组织样本中的表达,以探讨CDK16在食管癌中的表达及其临床病理意义.
1 材料与方法
1.1 材料
1.1.1 芯片
本次研究中所使用的两张组织芯片均由生物芯片上海国家工程研究中心(Biochip Shanghai National Engineering Research Center)提供.为了便于研究,分别将这两张组织芯片命名为hESCC-TMA050和hESCC-TMA045.这两张组织芯片上所有组织标本点所对应的病患在手术前均未进行过放疗或化疗,且均具有详细的临床病理资料.
编号为hESCC-TMA050的组织芯片上共有50个组织标本点,有5例食管鳞状细胞癌(癌/癌旁各1点)、8例基底细胞样鳞状细胞癌(癌/癌旁各1点)、4例梭形鳞状细胞癌(2例癌/癌旁各1点)、6例食管腺癌(4例癌/癌旁各1点)、5例食管腺鳞癌(1例癌/癌旁各1点)、1例食管未分化癌(癌/癌旁各1点).所有50个组织标本点均匀的排布于载玻片上,没有脱片,没有明显的位移或扭曲.组织芯片经苏木精-伊红(Hematoxylin-eosin Staining, HE)染色病理诊断证实,并附有HE染色结果.
编号为hESCC-TMA045的组织芯片上共有45个组织标本点,共包括15例原发食管鳞状细胞癌,每例包括癌/癌旁/淋巴结各1点.45个组织标本点均匀排布于载玻片上,没有脱片,没有明显的位移或扭曲.组织芯片经HE染色病理诊断证实,并附有HE染色结果.
1.1.2 试剂
SP-9000免疫组织化学试剂盒(包括封闭用山羊血清、生物素、标记二抗和辣根酶标记链霉卵白素),北京中杉生物技术有限公司;DAB显色液和EnVisionTM试剂盒,福州迈新生物技术公司,具体操作步骤参照试剂盒说明书;兔抗人CDK16多克隆抗体,英国Abcam公司.
1.2 方法
1.2.1 免疫组织化学(Immunohistochemistry, IHC)
首先,进行切片的脱蜡水化,接着用浓度为3%的H2O2封闭切片10 min,然后,将切片放置于pH6.0~6.2的0.1%枸橼酸缓冲液中微波修复20 min.随后使用山羊血清封闭切片15 min,最后将切片放置于4 ℃冰箱中一抗过夜.
第二天,从冰箱中取出切片,待切片恢复室温后,依次加入生物素化的二抗和辣根酶标记链霉卵白素,放置于37 ℃的烘箱中孵育30 min.然后依次进行DAB显色、苏木素复染、梯度酒精脱水、二甲苯透明,最后使用中性树胶封片.
1.2.2 结果判定
由经验丰富的病理学专家独立阅片,然后讨论分析,最终确定免疫组织化学结果.CDK16阳性染色以细胞浆或细胞核出现黄色或棕褐色为准.随机选取10个视野(400×),每个视野中约含100个肿瘤细胞.采用半定量计分方法判定染色结果,根据免疫组化的染色强度和染色细胞所占比例这二者的乘积来判定.
2 结果
2.1 组织芯片HE染色及IHC染色的有效性
编号为hESCC-TMA050的组织芯片上共有50个组织标本点,经HE染色后,残缺点数为0,有效信息量为100%;经IHC染色后,残缺点数为0,有效信息量为100%,见图1.
编号为hESCC-TMA045的组织芯片上共有45个组织标本点,经HE染色后,残缺点数为1,有效信息量为97.8%;经IHC染色后,残缺点数为1,有效信息量为97.8%,见图1.
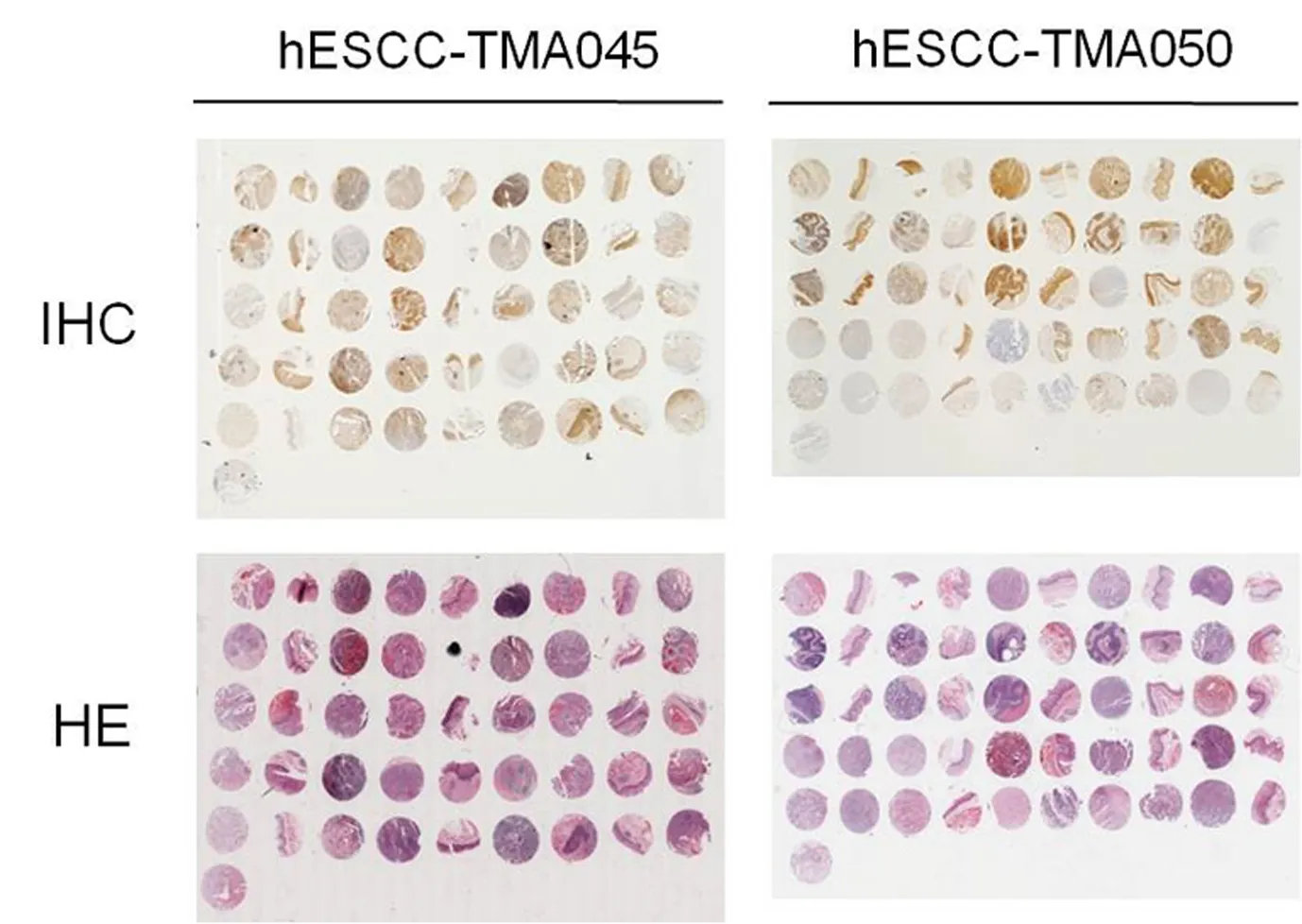
图1 两张组织芯片的IHC染色结果及HE染色结果Fig. 1 IHC staining results and HE staining results of two tissue microarrays
2.2 CDK16在不同类型食管癌中的表达
IHC染色结果可见,在食管鳞癌中,CDK16为强阳性表达;在食管腺癌中,CDK16弱阳性表达;在食管腺鳞癌中,CDK16中阳性表达;在食管未分化癌中,CDK16强阳性表达,见图2和图3.
2.3 CDK16在食管鳞癌及其组织亚型中的表达
食管鳞癌的组织亚型主要包括基底样食管鳞状细胞癌和梭形食管鳞状细胞癌这两种.在本次研究中,CDK16在食管鳞状细胞癌中呈现强阳性表达;同时,实验结果表明CDK16在食管鳞癌的两个组织亚型基底样食管鳞状细胞癌和梭形食管鳞状细胞癌中也呈强阳性表达,见图2.
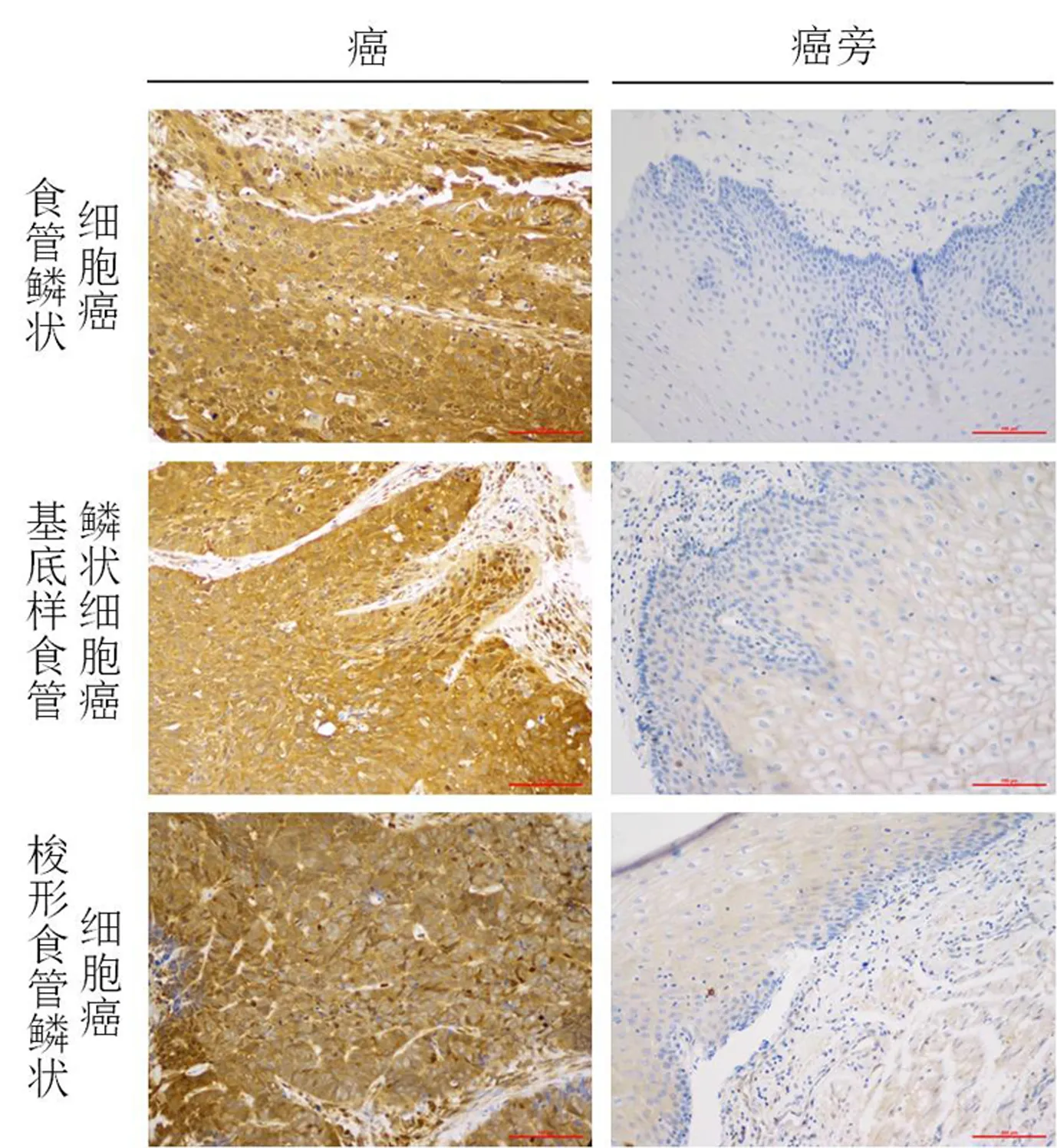
图2 CDK16在食管鳞癌及其组织亚型中的表达(原始放大倍数×200)Fig. 2 Expression of CDK16 in esophageal squamous cell carcinoma and its histological subtypes (Original magnification×200)

图3 CDK16在其他类型食管癌中的表达(原始放大倍数×200)Fig. 3 Expression of CDK16 in other types of esophageal cancer (Original magnification×200)
2.4 CDK16在不同分化程度食管鳞癌中的表达
实验结果显示,在食管鳞癌的高分化癌组织中,CDK16呈现弱阳性表达;在食管鳞癌的中分化癌组织中,CDK16为中阳性表达;而在食管鳞癌的低分化癌组织中,CDK16呈强阳性表达,见图4.
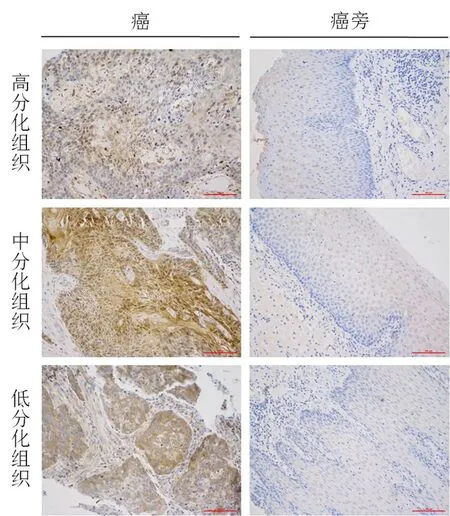
图4 CDK16在不同分化程度食管鳞癌中的表达(原始放大倍数×200)Fig. 4 Expression of CDK16 in esophageal squamous cell carcinoma with different degrees of differentiation (Original magnification×200)
2.5 CDK16在不同临床分期淋巴结中的表达
在阴性淋巴结(N0期)中,CDK16呈现为阴性染色,见图5A;在阳性淋巴结N1期中,CDK16阳性染色呈弱阳性,见图5B;在阳性淋巴结N2期中,CDK16阳性染色为中阳性,见图5C;在阳性淋巴结N3期中,CDK16阳性染色为强阳性,见图5D.
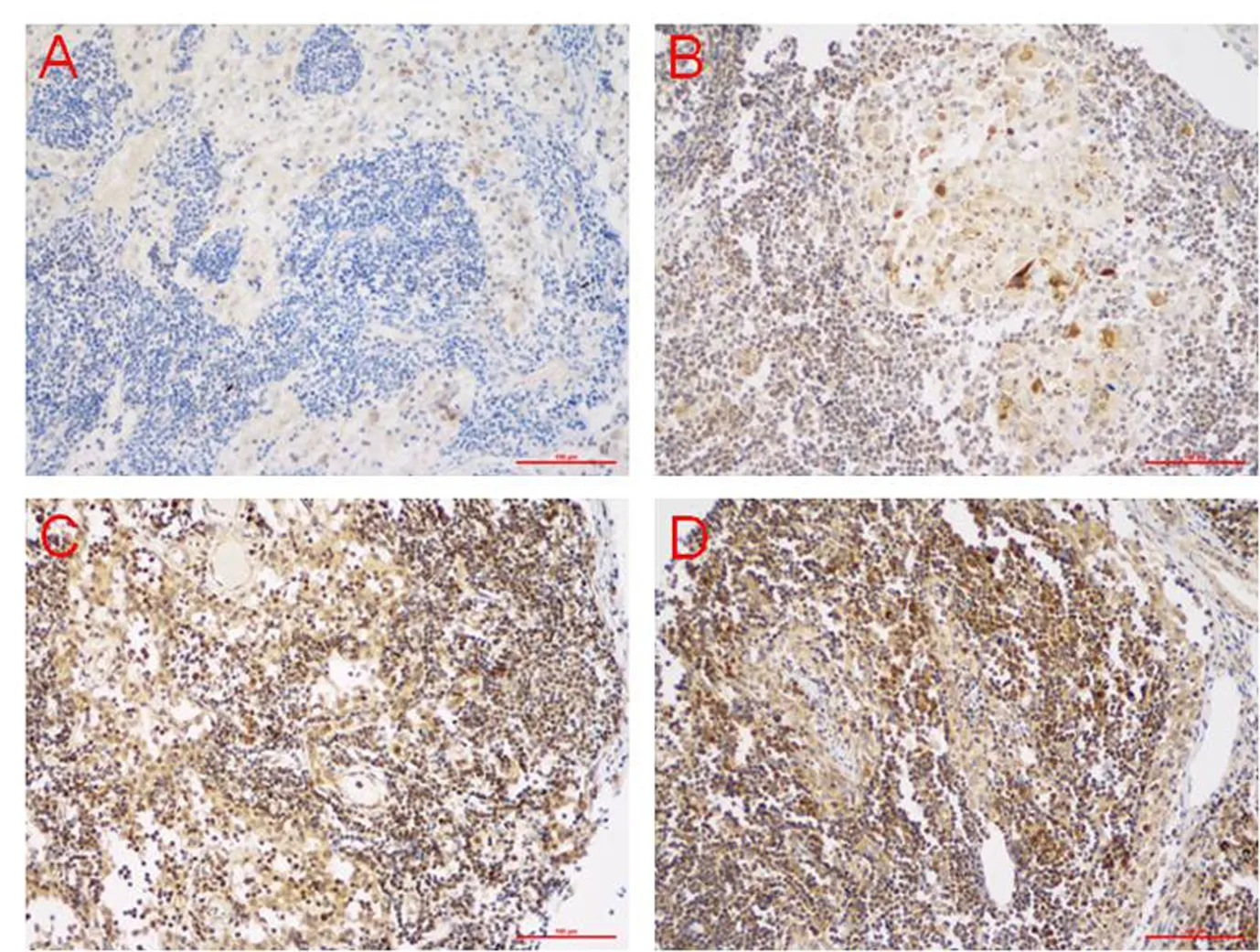
图5 CDK16在不同临床分期淋巴结中的表达(原始放大倍数×200)Fig. 5 Expression of CDK16 in lymph nodes of different clinical stages (Original magnification×200)
注:A.阴性淋巴结(N0期),B.阳性淋巴结N1期,
C.阳性淋巴结N2期,D.阳性淋巴结N3期
2.6 CDK16在食管鳞癌细胞及淋巴结细胞中的定位
免疫组化染色结果显示,在食管鳞癌的癌旁组织中,CDK16呈现出阴性染色,CDK16在细胞质和细胞核中均未见表达,见图6A;在食管鳞癌的高分化癌组织中,CDK16在细胞质和细胞核中均有表达,但细胞核中的表达要远远的强于在细胞质中的表达,见图6B;在食管鳞癌的中分化癌组织中,CDK16在细胞质和细胞核中均有表达,且表达水平相差不大,见图6C;在食管鳞癌的低分化癌组织中,CDK16在细胞质和细胞核中均有表达,但在细胞质中的表达要强于在细胞核中的表达,见图6D.在食管鳞癌的阴性淋巴结(N0期)中,CDK16染色为阴性,在细胞质和细胞核中均无表达,见图6E.在食管鳞癌的阳性淋巴结中,CDK16阳性表达,且表达强度与肿瘤的临床分期呈正相关;另外,在阳性淋巴结中,CDK16在细胞质和细胞核中均有表达,但以核表达为主,见图6F~H.

图6 CDK16在食管鳞癌细胞中的定位(原始放大倍数×400)Fig. 6 Localization of CDK16 in esophageal squamous cell carcinoma cells (original magnification×400)
注:A.癌旁组织,B.高分化癌组织,C.中分化癌组织,
D.低分化癌组织,E.阴性淋巴结(N0期),
F.阳性淋巴结N1期,G.阳性淋巴结N2期,
H.阳性淋巴结N3期
3 讨论
CDK16在前列腺癌、乳腺癌、宫颈癌等多种肿瘤中具有较高的表达,而在这些肿瘤细胞中,研究者通过实验发现,RNAi介导的CDK16的基因沉默可以引发细胞里中心体的动力学缺陷,从而引起有丝分裂的异常,并最终抑制肿瘤细胞生长.另外,研究者还证实肿瘤抑制因子p27可以与CDK16相互作用.体外激酶实验也表明CDK16可以在Ser10磷酸化p27.沉默CDK16可以调节p27的Ser10位点的磷酸化水平,并导致p27在肿瘤细胞中的表达量上升.研究者在宫颈癌HeLa细胞中的机理研究表明CDK16在细胞周期的S期和M期磷酸化p27,在一个小鼠的前列腺癌移植瘤模型中,条件性的沉默CDK16可以恢复p27的蛋白表达并抑制肿瘤生长.这表明,CDK16可以调节p27的稳定性、有丝分裂和肿瘤的生长,CDK16可以作为一个候选的癌症治疗靶点[22,23].
已有的文献报道表明,CDK16在卵巢癌、前列腺癌、宫颈癌、乳腺癌、鼻咽癌中具有较强的表达,并通过影响肿瘤细胞的增殖、侵袭或凋亡等调控肿瘤的发生及发展.但是CDK16是否也参与调控食管癌的发病,目前未见有相关的文献报道.
本次研究结果初步揭示了CDK16与食管鳞癌之间的关系.研究结果显示,CDK16的表达与食管癌的组织学类型密切相关.CDK16在食管腺癌及食管腺鳞癌中为弱阳性表达,但在食管鳞癌及其两个组织亚型基底样食管鳞状细胞癌及梭形食管鳞状细胞癌中则为强阳性表达.具体到食管鳞癌,进一步的研究结果显示:CDK16在食管鳞癌中的表达强度与肿瘤的分化程度负相关,并与食管鳞癌淋巴结的临床分期正相关.这提示CDK16与食管鳞癌的淋巴结转移有着紧密的联系.
另外,CDK16在食管鳞癌细胞核中的表达强度随着肿瘤的恶性程度呈依次递减趋势,而在细胞质中的表达强度随着肿瘤的恶性程度呈依次递增趋势.我们推测,随着肿瘤恶性程度的增强,CDK16在细胞质中表达增强,这可能与肿瘤的侵袭或迁移相关.
但是,本次研究还存在着诸多的不足之处,首先,样本例数的不足.本次实验所收集的各个类型食管癌的组织样本均存在着例数不足的情况.当然,这也与某些类型的食管癌的病例较少有关系.第二,实验方法的不足.本次研究主要使用的就是组织芯片结合免疫组化的技术方法,而这对实验结论的得出稍显不足.
接下来,将进一步深入研究本课题.一方面,扩大样本量,重点便是食管鳞癌的组织样本.在保证例数增加的同时也要尽量保证每个病例的各项临床病理参数的完整,包括患者的生存期.这样便可以通过数据的统计分析来探究CDK16的表达与食管鳞癌的各项临床病理参数及病患生存期之间的关系.另一方面,通过细胞学实验来研究CDK16对食管鳞癌的各项细胞学功能的影响,包括细胞生长及增殖、细胞迁移与侵袭以及细胞凋亡等,从而进一步地研究并阐明CDK16与食管鳞癌的发生发展之间的关系.
