木霉菌对土壤微生物多样性及草莓生长和发病的影响
2018-10-16靳亚忠咸洪泉
王 宁,刘 铜,靳亚忠,咸洪泉
(1.青岛农业大学,山东青岛266109;2.黑龙江八一农垦大学,黑龙江大庆163319)
木霉菌是优良的生防真菌,在应用真菌防治土传病害的研究中,应用最广泛的真菌杀菌剂便是木霉菌[1]。土壤微生物群落结构失衡是造成土传病害发生的主要原因[2-3],其多样性高低是衡量土壤健康与否的一项重要指标[4]。施用木霉菌后,通过对土壤微生物多样性产生影响来达到防治病害、改良土壤的作用,因此,研究土壤微生物多样性意义重大。目前微生物多样性的研究方法多为活菌培养,局限在部分微生物总体数量研究,对种类的研究比较少,而土壤中的大多数微生物是无法进行培养的,可培养率只有 0.1% ~1.0%[5-6]。高通量测序具有无需培养、能够客观还原菌群结构和数据量大等优点[7],近年来,高通量测序技术不断发展,尤其是第二代测序方法,即Illumina 454和SOLiD Ion Torrent具有诸多优点[8-10]。这些测序平台最大数据产出通量高,在土壤微生物多样性的研究中可以获得丰富的信息[11-12]。因此,笔者试图通过对土壤微生物基因组进行高通量测序,研究木霉菌施用后对土壤微生物多样性的影响,为进一步揭示木霉菌和土壤微生物多样性之间的关系提供依据。
1 材料与方法
1.1 试验材料
供试菌剂为青岛农业大学研发的木霉菌可湿性粉剂,棘孢木霉(Trichoderma asperellum)的孢子浓度为1×109CFU/g,草莓品种为红颜。
1.2 试验方法
1.2.1 田间试验设计 试验在黑龙江省大庆市萨尔图区春雷农场塑料大棚内进行,木霉菌可湿性粉剂于苗期施用。设木霉菌可湿性粉剂、对照2个处理,小区面积为0.02 hm2,共3次重复。木霉菌可湿性粉剂处理为将木霉菌可湿性粉剂稀释300倍进行灌根,灌根量为300 mL/株,对照用等体积的水灌根。灌根时间为2016年11月4日,21 d后采用对角线五点取样法取草莓根际土。
1.2.2 土壤微生物测序 微生物多样性研究主要基于编码核糖体RNA的核酸序列,其中细菌多样性研究主要是基于16SrDNA V3+V4区,真菌多样性研究主要基于内转录间隔区ITS1区。提取样品总DNA,细菌V3+V4扩增采用的引物如下:F,5'-ARACTYCTACGGRAGGCWG -3';R,5'-GACTACNVGGGTATCTAATCC-3'。真菌 ITS1扩增引物如下:ZF,5'-AACCTGCGGAAGGATCATT -3';ZR,5'-GARCCAAGAGATCCRTTG-3'。进行PCR扩增并对其产物进行纯化、定量和均一化形成测序文库,对于建好的文库先进行文库质检,质检合格的文库用Illumina HiSeq 2500进行测序。测序由北京百迈客生物科技有限公司完成。
1.2.3 信息分析流程 利用双末端测序(paired-end)的方法,构建小片段文库进行测序。通过对reads(读长)拼接过滤,得到优化序列(tags)。将优化序列进行操作分类单元(operational taxonomic units,简称OTUs)聚类,并进行物种注释及丰度分析,以揭示样品的物种构成。进一步进行α多样性分析(alpha diversity),研究单个样品内部的物种多样性,统计各样品在97%相似度水平下的 Ace、Chao1、Shannon及Simpson指数。
1.2.4 草莓生长指标测定 施用木霉菌可湿性粉剂50 d后,测定单株叶片数及单张叶面积,测定数量为10株。单张叶面积的测定参考乔宝营等的方法[13]。
1.2.5 草莓灰霉病的调查 施药后在生育期内定期观测连作草莓土传病害的发生情况,主要调查整个试验处理草莓灰霉病的病株数,并参照朱虹等方法计算防效[14]。
2 结果与分析
2.1 样品测序结果评估
通过数据统计软件处理各阶段样品序列数,评估数据质量。各样品测序数据评估结果如表1、表2所示。
稀释性曲线(rarefaction curve)用于验证测序数据量是否足以反映样品中的物种多样性,并间接反映样品中物种的丰富程度[15]。由图1可以看出,在一定范围内,随着测序数的增多,若曲线表现为急剧上升,则表示群落中有大量物种被发现;当曲线趋于平缓时,则表示此环境中的物种并不会随着测序数量的增加而明显增多。稀释曲线可以作为对各样本测序量是否充分的判断,如果曲线急剧上升,表明测序量不足,需要增加序列数;反之,则表明样品序列充分,可以进行数据分析。样品稀释曲线分别在测序数为10 000、20 000条处逐渐趋向平坦,而表1显示,细菌的优化测序数量超过60 000条,表2显示,真菌的优化序列超过40 000条,说明样品序列充分,测序数量合理。
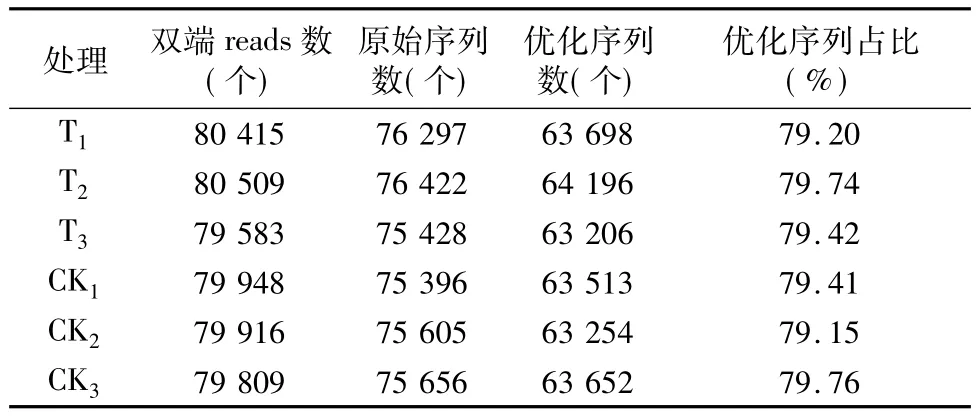
表1 样品细菌测序数据结果统计

表2 样品真菌测序数据结果统计
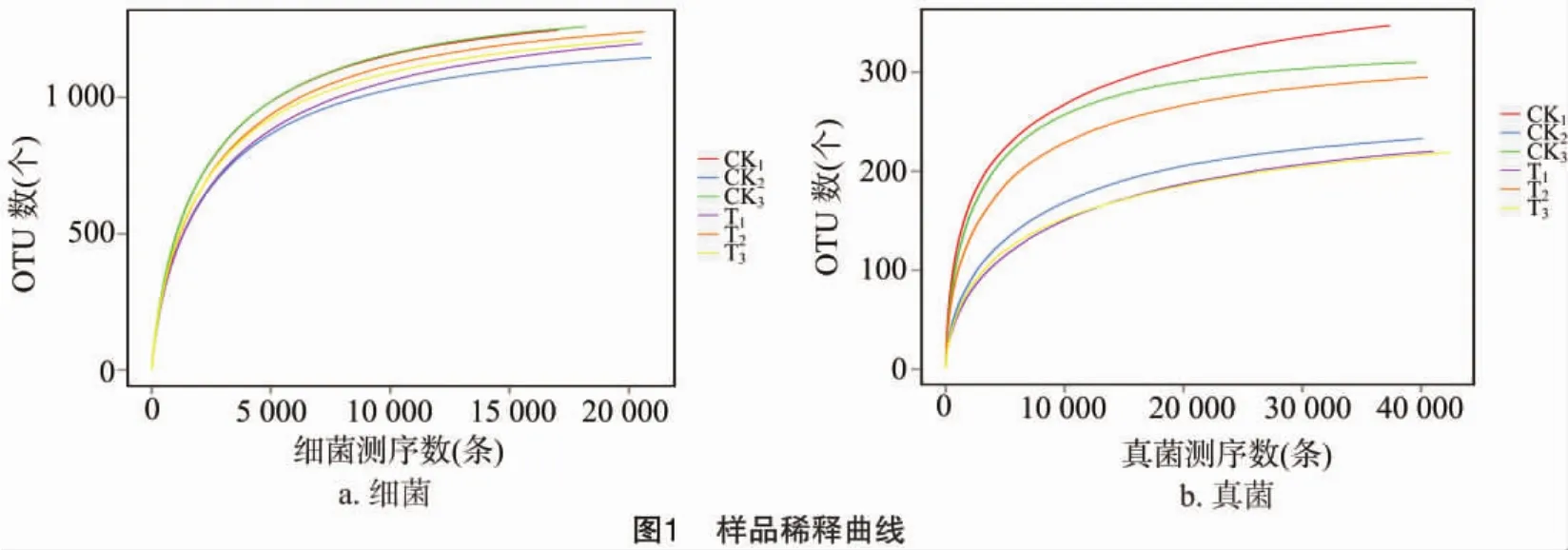
2.2 OTU 划分结果
6个样品测序共获得479 966对reads,双端reads拼接、过滤后共产生301 529条tags,平均每个样品产生 43 076 tags。根据不同的相似度水平,对所有序列进行OTU划分,在一般情况下,如果序列之间的相似性高于97%就可以把它定义为1个OTU,每个OTU对应1种代表序列[16]。使用QIIME(version 1.8.0)软件中的UCLUST对tags在97%的相似度水平下进行聚类,获得OTU,并基于Silva(细菌)和UNITE(真菌)分类学数据库对OTU进行分类学注释。由表3看出,各处理组和对照组细菌的总种类数变化非常小,而真菌种类的数量差异较大,处理组较对照组真菌种类总数明显减少,降低了 17.57%。

表3 通过聚类得到的不同处理土壤中的OTU数量
2.3 属水平丰度变化
由图2可以看出,细菌属水平的丰度变化表现如下:在土壤中,特吕珀菌属(Truepera)、Chryseolinea、藤黄单胞菌属(Luteimonas)、铁矿沙单胞菌属(Arenimonas)、鞘鞍醇单胞菌属(Sphingomonas)、冷菌属(Algoriphagus)和热单胞菌属(Thermomonas)丰度较高,处理组和对照组相比没有明显变化。处理组的假单胞菌属(Pseudomonas)丰度所占比例比对照增加45.8百分点。假单胞菌属是土壤中病原菌的拮抗菌,其种类和数量增多有利于土壤健康[17]。
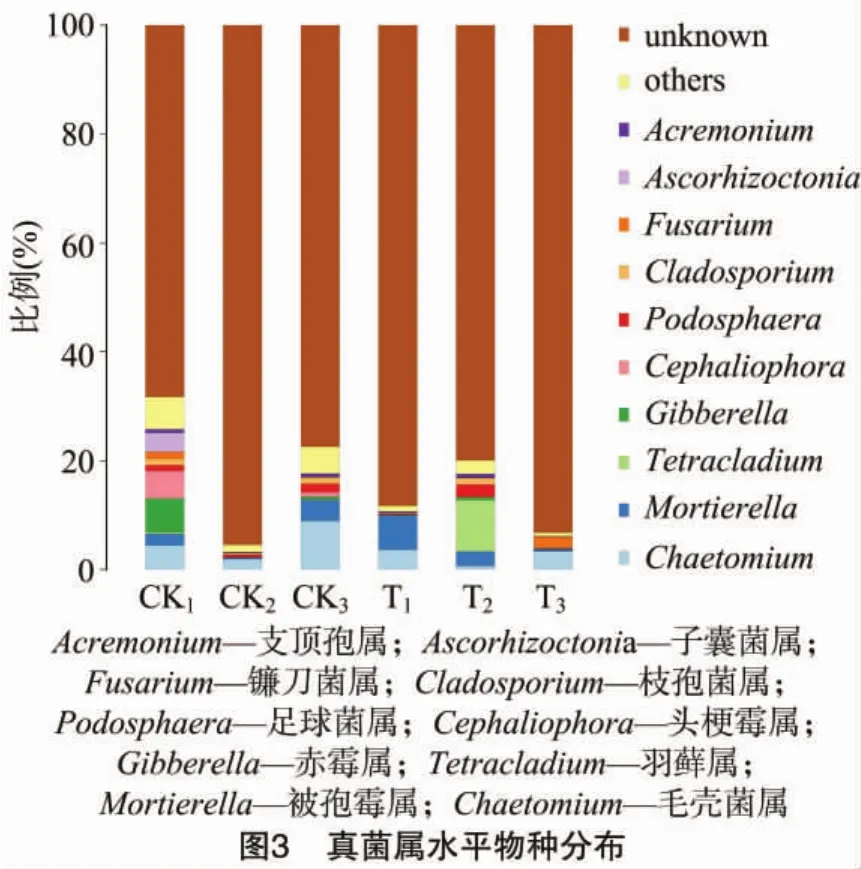
由图3可以看出,真菌属水平丰度的变化表现如下:镰刀菌属(Fusarium)在T3处理中丰度占比2.41%,T3处理中其他种类真菌数量较少,镰刀菌占据绝对优势,与往年T3处理是根腐病严重区有关。大棚内有相同根腐病发生区的土壤中,镰刀菌丰度占比达3.35%,木霉菌处理后下降28.06百分点。丰度占比前10的头梗霉属(Cephaliophora)、赤霉菌属(Gibberella)、毛壳菌属(Chaetomium)相对丰度明显减少,分别降低245.20、322.53、38.46 百分点,羽藓属(Tetracladium)相对丰度明显增多,增加348.29百分点。毛壳菌广泛存在于土壤中,它可以有效降解纤维素和有机物,对微生物产生拮抗作用,是广泛应用的生防菌[18]。而木霉菌和毛壳菌互相拮抗,所以会造成毛壳菌丰度的减少[19]。
2.4 物种丰度聚类热图

Heatmap是以颜色梯度来代表数据矩阵中数值的大小并根据物种或样品丰度相似性进行聚类的一种图形展示方式。将高丰度和低丰度的物种分块聚集,通过颜色梯度及相似程度来反映多个样品群落组成的相似性和差异性。在热图聚类结果中,颜色代表物种丰度;纵向聚类表示不同物种在各样品间丰度的相似情况,2个物种间距离越近,枝长越短,说明这2个物种在各样品间的丰度越相似;横向聚类表示不同样品的各物种丰度的相似情况,与纵向聚类一样,2个样品间距离越近,枝长越短,说明这2个样品的各物种丰度越相似。
从图4可以看出,木霉菌制剂处理的土样真菌丰度明显降低,尤其是处理1和处理3。处理2和对照2横向聚类丰度相近,纵向聚类丰度差异较大。头梗霉属、赤霉菌属等一些土壤致病菌明显减少,而圆酵母属(Torula)、摩西管柄囊霉(Funneliformis)、羽藓属(Tetracladium)丰度增加,其中摩西管柄囊霉和羽藓属均是菌根真菌,对土壤健康的保持非常重要。21 d后木霉菌的数量会明显降低。
2.5 Alpha多样性分析
Alpha多样性有 Chao1、Ace、Shannon、Simpson 等多种衡量指标[20]。其中Chao1和Ace指数能简单地反映群落中物种的数量,而不表示群落中每个物种的丰度信息。Shannon和Simpson指数用于衡量群落多样性,受样品群落中物种丰度和物种均匀度的影响。Chao1、Ace、Shannon指数越大,Simpson指数越小,说明样品的物种多样性越高[21]。另外,本研究还统计了样本文库的覆盖率(Coverage),其数值越高,则表明样本中序列被测出的概率越高,而没有被测出的概率越低。该指数可以反映测序结果是否能够代表样本中微生物的真实情况。
从表4、表5可以看出,经过木霉菌处理后,土壤微生物多样性指数整体上变低,细菌多样性指数变化不大,Ace和Shannon指数变化较小,Chao1和Simpson指数略微下降。真菌的多样性指数明显降低,对照Ace、Chao1、Shannon指数分别比处理增加 18.51%、18.81、31.03%;对照 Simpson 指数比处理降低50.96%。分析原因,可能是由于木霉菌对细菌的拮抗性较小,主要拮抗真菌。
2.6 木霉制剂对草莓植株生长及灰霉病发生的影响
施入可湿性粉剂后,分别在生育期内进行草莓叶片数量、面积测定。表6结果表明:处理组的草莓叶片数量、叶面积均比对照组明显增加。施药后50 d时,处理组叶片数量、叶面积分别比对照组增加10.78%、10.94%,对草莓灰霉病的相对防效达65%。结果说明,施入木霉菌对草莓植株具有明显的促生长作用,并对草莓灰霉病有很好的预防和治疗作用。
3 结论与讨论
本试验采用土壤宏基因组高通量测序的方法研究木霉菌制剂施用后对土壤微生物多样性的影响,结果表明,施用木霉菌对土壤中细菌多样性影响较小,但会使真菌多样性明显降低。木霉菌对细菌多样性的影响主要表现为假单胞菌属数量明显增多;对真菌多样性的影响主要表现为头梗霉属、赤霉菌属和毛壳菌属等数量明显减少,酵母菌、羽藓属等数量明显增多。木霉菌的施用会造成很多病原菌含量减少,也会造成一些有益菌含量减少,从而重新塑造土壤的微生态系统,间接改良土壤,增强植株长势,并减轻灰霉病等土传病害的发生程度[22]。
马建华等报道,在土壤中施入深绿木霉后细菌增长速度缓慢,而真菌数量显著降低[23]。古丽君等研究发现,施入深绿木霉17 d后,真菌的数量比对照减少了4×103CFU/g,土壤中细菌的数量增加了1.27×1010CFU/g,放线菌数量没有明显变化[24]。另有报道显示,木霉菌和假单胞菌属可以协同作用,从而提高生防效果[25]。毛壳菌属是优良的生防菌,但木霉菌施用后会造成其数量下降,已有报道显示两者互相拮抗[19]。
有关木霉菌在土壤中存活时间的问题,当前研究结果不一,康萍芝等研究发现,施用木霉菌后11 d,木霉菌含量达到高峰,之后开始降低,55 d后土壤中几乎检测不到木霉菌[26]。杜婵娟等发现,施用木霉菌后35 d,木霉菌含量达到高峰,之后开始下降[27]。古丽君等发现,木霉在施入25 d时,相对含量达到最低值[24]。本研究发现,施用木霉制剂21 d后根际土壤中木霉菌含量已经很低,其原因有待进一步研究。
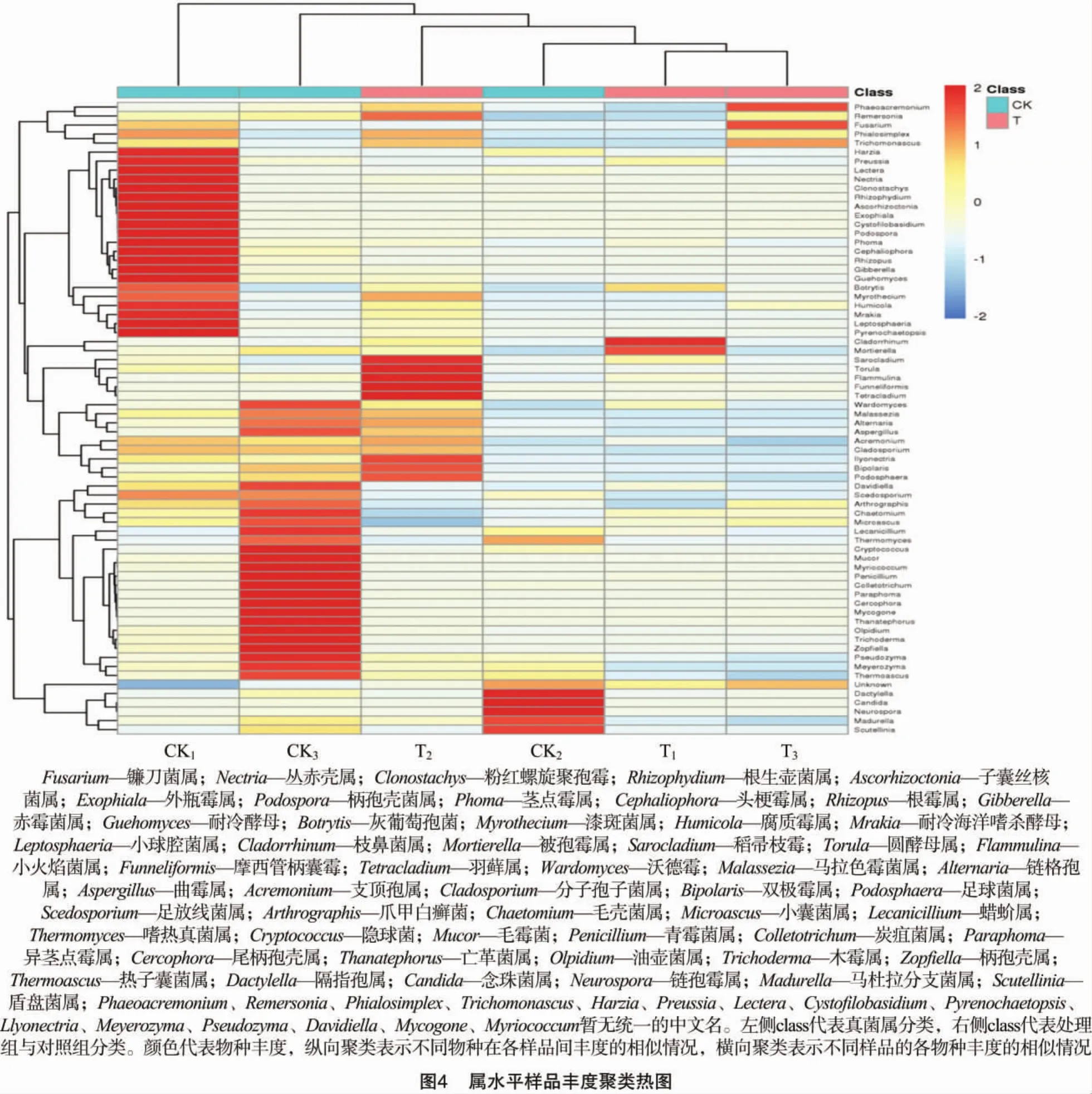
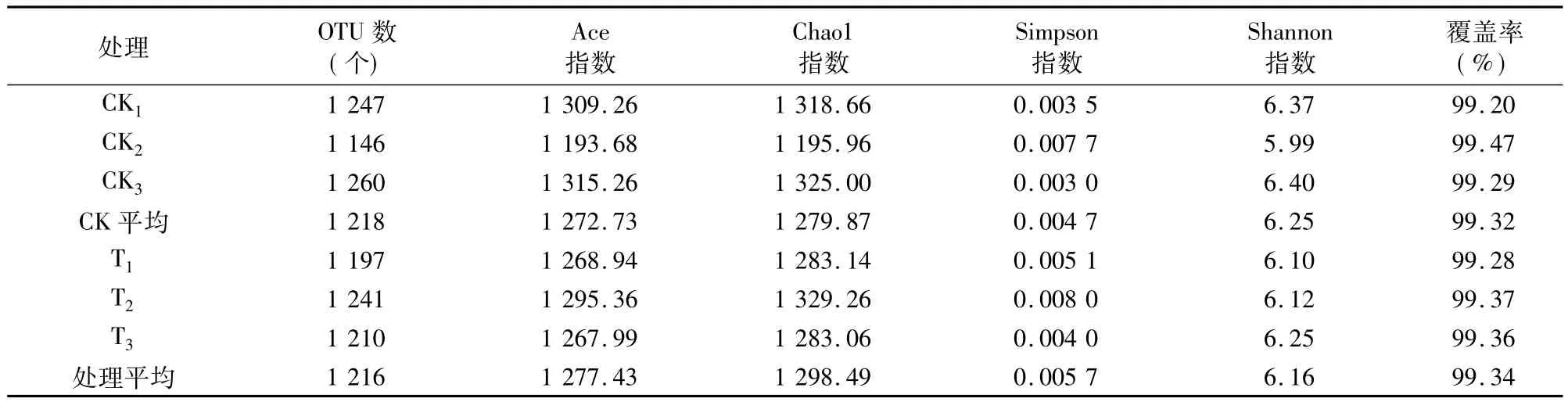
表4 细菌Alpha多样性指数统计
土壤微生物多样性是衡量土壤健康与否的重要指标。木霉菌的施用会改变土壤中的微生态系统,往往使一些土传病害真菌种类和数量减少,而土壤中有许多真菌往往是重要的病原菌[28],从而使土壤有益菌和病原菌保持一种动态平衡,达到抑制病害发生和促进作物生长的目的。
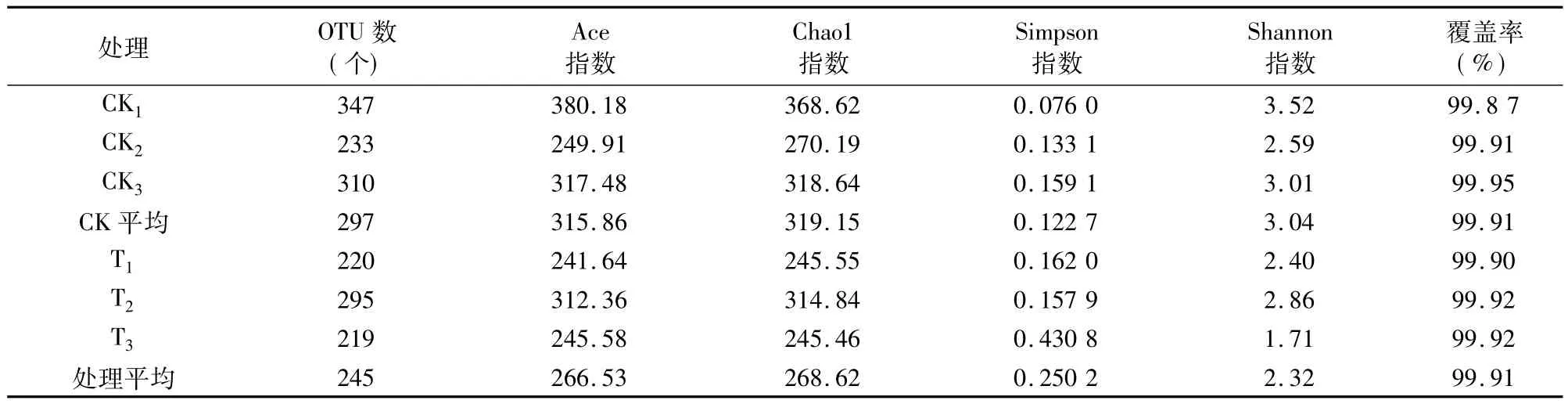
表5 真菌Alpha多样性指数统计

表6 木霉制剂对草莓生长和灰霉病发生的影响(施药后50 d)
