拟南芥自噬蛋白ATG8e的原核表达及多克隆抗体制备
2018-10-16李远凤齐亚飞
刘 希,李远凤,齐亚飞,郁 飞
(旱区逆境生物学国家重点实验室/西北农林科技大学生命科学学院,陕西杨凌712100)
自噬(autophagy)是真核生物中进化保守的、对细胞内物质如蛋白质或细胞器进行降解、促进物质循环利用的重要过程[1-2]。在自噬发生的过程中,生物体先形成1个自噬吞噬泡(phagophore),将细胞质物质包裹起来,吞噬泡逐渐形成1个双层膜自噬体(autophagosome),其外膜会与液泡膜融合,内膜及其包裹物(autophagic body)进入到液泡腔被水解酶分解[3]。研究表明,一系列自噬基因(autophagy-related genes,简称ATG)会组成功能单元参与自噬进程,如其中参与成膜过程的2个类泛素化系统——ATG8耦合系统[4]和ATG12耦合系统[5-6]。ATG8蛋白在自噬中发挥作用是一个类泛素化的过程,ATG8蛋白前体的C端被ATG4剪切,使其C端甘氨酸残基暴露,接着被剪切后的ATG8会在ATG7(E1类似酶)催化下结合 ATG3(E2类似酶),然后在 ATG12-ATG5·ATG16(“-”代表共价结合,“·”代表非共价结合)复合物(E3类似酶)作用下,ATG8可以与磷脂酰乙醇胺(PE)连接组成ATG8-PE[4]。ATG8-PE锚定于自噬体膜上,参与自噬体膜的形成[7]。因此可根据ATG8-PE的积累量来衡量植物的自噬程度,从而比较不同基因型植物之间自噬发生的差异,筛选能参与自噬调控途径的新基因,对于揭示植物自噬的分子途径具有重要意义。
自噬在植物的生长发育和胁迫响应中发挥重要作用。研究表明,拟南芥中至少有36个基因与酵母ATG基因同源且具有相似作用,参与植物的免疫反应[8]、叶片衰老及环境胁迫应答等[9]。为了研究植物自噬,以 ATG8家族9个成员(ATG8a~ATG8i)[10]之一的 ATG8e作为切入点,构建 ATG8e基因的原核表达载体,转化大肠杆菌BL21(DE3),用异丙基硫代半乳糖苷(isopropylβ-D-thiogalactoside,简称IPTG)诱导产生融合蛋白GST-ATG8e,最后用切去谷胱甘肽S移换酶(glutathione S-transferase,简称 GST)标签并纯化过的ATG8e免疫家兔,心脏采血后收集血清,制备多克隆抗体。为证明制备的多克隆抗体的有效性,构建重组质粒pBI111LATG8e,利用花序侵染法[11]转化野生型拟南芥,得到ATG8e超表达植物,提取野生型拟南芥和ATG8e超表达植物叶片总蛋白,用于免疫印迹检测。
1 材料与方法
1.1 试验材料
1.1.1 植物、细菌和载体 野生型拟南芥Columbia(Col)、大肠杆菌TOP10菌株、大肠杆菌BL21(DE3)菌株、野生型拟南芥 cDNA、农杆菌 GV3101菌株、二元载体 pBI111L[12]、原核表达载体pGEX-4T-1均由笔者所在实验室留存。
1.1.2 试剂 高保真 DNA聚合酶(PrimeSTAR®HS DNA Polymerase),Bam H I和Eco R I内切酶、T4DNA连接酶购于TaKaRa公司;DNA纯化回收试剂盒(Universal DNA Purification Kit)、质粒小提试剂盒(TIANprep Mini Plasmid Kit)购于天根生化科技(北京)有限公司;异丙基-β-D-硫代半乳糖苷(IPTG)、弗氏完全佐剂(Freund's adjuvant complete)和弗氏不完全佐剂(Freund's adjuvant incomplete)购于Sigma公司;GST标签蛋白纯化柱填料protein Glutathione Sepharose 4 Fast Flow、凝血酶(Thrombin)、表面活性剂(SILWET®L -77)、0.45μm硝酸纤维素(Nitro Cellulose)膜购于GE Healthcare Life Science;辣根过氧化物酶(HRP)标记的羊抗兔免疫球蛋白G(immunoglobulin G,简称IgG)购于北京康为世纪生物科技有限公司;尿素购于Amresco公司;ECL工作液(Detection reagent 1,Detection reagent 2)购于 Bio-Rad公司;特异性引物由上海立菲生物技术有限公司合成。
1.2 试验方法
1.2.1 原核表达载体pGEX-4T-1-ATG8e的构建 根据拟南芥官方网站TAIR(https://www.arabidopsis.org/)公布的ATG8e基因序列,设计引物:
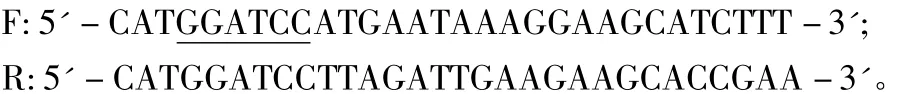
F和R中下划线的碱基序列为Bam HⅠ的酶切位点。以野生型拟南芥cDNA为模板,以F和R为上下游引物扩增ATG8e片段。PCR程序:94℃ 2 min;98℃ 10 s,53℃ 15 s,72℃ 30 s,40个循环;72℃ 2 min。将PCR扩增产物ATG8e用Bam H I酶切后连至原核表达载体pGEX-4T-1,用转化CaCl2法制备大肠杆菌感受态细胞TOP10,挑取生长正常的单菌落摇菌,提质粒进行酶切验证,将鉴定结果正确的质粒送华大基因测序。
1.2.2 融合蛋白GST-ATG8e的诱导表达和纯化 将测序正确的重组质粒pGEX-4T-1-ATG8e转化大肠杆菌BL21(DE3),挑取生长正常的单克隆于含有100μg/mL氨苄青霉素的2×YT(16 g/L胰蛋白胨,10 g/L酵母提取物,15 g/L NaCl)液体培养基中,37℃、220 r/min培养至菌液D600nm约为0.8时,加诱导剂IPTG,使其在菌液中的终浓度为1 mmol/L,20℃、220 r/min诱导表达约20 h;4℃、8 000 r/min离心10 min收菌,菌体沉淀用磷酸缓冲盐溶液(phosphate buffer saline,简 称 PBS)(140 mmol/L NaCl,2.7 mmol/L KCl,10 mmol/L Na2HPO4·7H2O,1.8 mmol/L KH2PO4,pH 值7.3)重悬;超声破菌后,4℃、12 000 r/min离心30 min,分别收集上清液和沉淀,后者用PBS重悬。取诱导前菌液、诱导后菌液、破菌后上清液、破菌后沉淀各50μL,十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfatepolyacrylamide gel electrophoresis,简称SDS-PAGE)检测融合蛋白GST-ATG8e的表达情况。电泳结束后,用半干转膜仪将蛋白样品转到0.45μm NC膜上并用丽春红对膜瞬时染色,之后用 TBST 缓冲液(20 mmol/L Tris-HCl,pH 值 7.5,150 mmol/L NaCl,0.1%Tween -20)洗去浮色,室温条件下用封闭液(含0.05 g/mL脱脂奶粉的TBST缓冲液)封闭1 h,加入用封闭液稀释的Anti-GST(1∶5 000)4℃过夜孵育,次日用TBST缓冲液洗膜3次,每次5 min,加入用封闭液稀释的羊抗兔IgG(1∶10 000)室温孵育1 h,用TBST缓冲液洗膜3次,每次10 min,加入ECL显色液用化学发光凝胶成像系统成像。
收集同样条件下用 IPTG诱导的菌液400 mL,4℃、8 000 r/min离心10 min;菌体沉淀用20 mL PBS重悬;超声破菌后,4℃、12 000 r/min离心 30 min,收集上清液并用0.45μm滤膜过滤;将过滤后的上清液与1 mL GST标签蛋白纯化柱填料protein Glutathione Sepharose4 Fast Flow于室温孵育1 h,4℃、3 000 r/min离心10 min;用10个柱体积的PBS洗涤柱上杂蛋白,4℃、3 000 r/min离心10 min;加入50μL凝血酶(1 U/μL)于950μL PBS中,柱上切除标签蛋白(室温12~16 h),4℃、3 000 r/min离心10 min收集酶切后的蛋白;用1 mL还原型谷胱甘肽(20 mmol/L)洗脱液洗脱标签蛋白。收集每步样品50μL进行SDS-PAGE鉴定[13]。为了得到更纯净的目的蛋白,后续对ATG8e进行SDS-PAGE割胶纯化,并以牛血清白蛋白(BSA,质量浓度梯度依次为 1.0、0.5、0.25、0.125 mg/mL)为对照,对其浓度进行分析评估[14]。
1.2.3 ATG8e抗血清的制备及验证 购买3只饲养2个月的健康成年家兔,初免家兔的抗原是等体积ATG8e蛋白与弗氏完全佐剂的混合物,免疫剂量为200μg/只。第14天后进行第2次免疫,第28、第42天分别进行第3、第4次免疫,第2、3、4次加强免疫家兔所用抗原是等体积ATG8e蛋白与弗氏不完全佐剂的混合物[15],免疫剂量为100μg/只。3次加强免疫之后,对家兔心脏采血,将其血液于37℃放置1 h,4℃冰箱过夜,4℃、14 000 r/min离心10 min,收集血清并分装,于 -80℃ 储存备用。
分别吸取0.3、3、30 ng纯化后的ATG8e蛋白进行SDSPAGE。以ATG8e兔抗血清(1∶1 000)为一抗,羊抗兔IgG(1∶10 000)为二抗,进行免疫印迹检测。
1.2.4 纯化 ATG8e兔抗血清 取约 0.6 mg纯化后的ATG8e进行SDS-PAGE;电泳结束以后,用半干转膜仪将蛋白样品转到 0.45μm NC膜上;在室温条件下,用含0.05 g/mL 脱脂奶粉的 TBS缓冲液(20 mmol/L Tris-HCl,pH值 7.4,500 mmol/L NaCl,0.05%Tween -20)将抗原结合区域封闭1 h;之后将膜切成约为2 mm2小方块,装入含有ATG8e抗血清的离心管中,4℃过夜孵育;次日用TBS缓冲液洗膜3 次,每次 5 min;用PBS(20 mmol/L Na3PO4,pH 值 7.2,150 mmol/L NaCl)洗膜3次,每次5 min;加入500μL洗脱液(100 mmol/L甘氨酸,pH值2.5),室温孵育10 min;吸取洗脱液甘氨酸于新的1.5 mL离心管中,加入50μL 1 mol/L Tris-HCl(pH值8.0),弹甩混匀,测浓度并分装后于-80℃储存备用。
1.2.5 ATG8e超表达植物的获得
1.2.5.1 构建pBI111L-ATG8e重组载体 用限制性内切酶Bam HⅠ从pGEX-4T-1-ATG8e上切下ATG8e基因片段,连接到同样用Bam HⅠ酶切的载体pBI111L上,用转化CaCl2法制备大肠杆菌感受态细胞TOP10,挑取生长正常的单菌落摇菌,提质粒酶切验证。
1.2.5.2 花序侵染法转化野生型拟南芥植株 将重组质粒pBI111L-ATG8e电击转化农杆菌GV3101菌株,挑取单克隆于加入50μg/mL庆大霉素、50μg/mL卡那霉素、25μg/mL利福平的LB液体培养基中,28℃、220 r/min培养,至D600nm约为1.2时收菌;菌体用500 mL渗透缓冲液[5%蔗糖(质量浓度),0.05%(体积分数)SILWET®L -77]重悬;将侧枝丰富的野生型拟南芥植株进行蘸花,时间约为45 s;蘸花后植物上收取的种子为转基因T1代。
1.2.5.3 ATG8e超表达T3代植物的获得 T1代植株用含有50μg/mL卡那霉素的MS培养基初筛,将挑出的绿色植物移栽到基质土上继续生长,待植物果荚成熟后,单颗收取T2代种子;T2代转基因植株的鉴定主要从蛋白水平上检测ATG8e的表达,挑选出ATG8e高表达植株单株收取T3代种子;对T3代植株分别从ATG8e RNA转录水平以及蛋白表达水平进行检测。
1.2.6 ATG8e多克隆抗体特异性检测 取在基质土上生长3周龄的野生型拟南芥和ATG8e超表达T3代植株叶片于1.5 mL离心管内并称质量。将各组植物样品研磨成粉末,1 mg植物量加入10μL蛋白提取液(125 mmol/L Tris-HCl,pH 值6.8,20%甘油,4%SDS,1% β - 巯基乙醇),65 ℃干浴处理2 h,14 000 r/min离心10 min,吸上清液于新的1.5 mL离心管内,-80℃储存备用。取10μL植物蛋白样品进行尿素-SDS-PAGE(6 mol/L尿素),用已制备的ATG8e多克隆抗体进行免疫印迹检测。
2 结果与分析
2.1 鉴定pGEX-4T-1-ATG8e原核表达载体
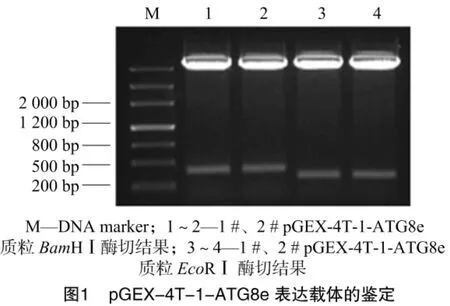
将构建的原核表达载体pGEX-4T-1-ATG8e用Bam HⅠ酶切鉴定插入,得到5 000 bp的载体骨架和约为370 bp的目的片段(图1的泳道1和泳道2)。之后用Eco RⅠ鉴定插入方向,琼脂糖凝胶电泳呈现5 000 bp的载体骨架以及为约为300 bp的片段插入(图1的泳道3和泳道4),对插入方向为正向的2号重组质粒测序。测序结果完全准确,表明成功构建了pGEX-4T-1-ATG8e载体。
2.2 重组蛋白的诱导表达和纯化
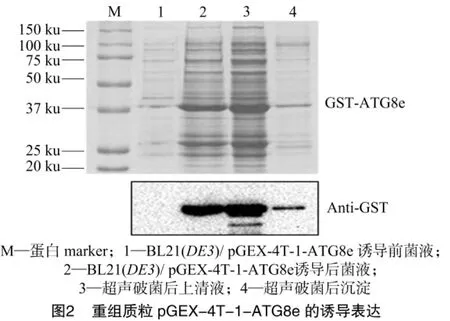
对诱导前菌液、诱导后菌液、破菌后上清液、破菌后沉淀4个样品进行SDS-PAGE(图2)。在诱导后菌液和破菌后的上清液样品中均检测到高表达量的蛋白条带(37~50 ku)(图2的泳道2和泳道3),说明该蛋白在试验条件下是可诱导的,且大部分是以可溶性形式存在的。已知GST-ATG8e分子量理论值为40 ku,根据胶图结果推测极有可能成功诱导表达了融合蛋白GST-ATG8e;为进一步确定诱导高表达的为融合蛋白GST-ATG8e,用Anti-GST做免疫印迹,检测到大小和融合蛋白GST-ATG8e分子量吻合的特异性条带,说明融合蛋白GST-ATG8e在大肠杆菌中成功表达。
将融合蛋白GST-ATG8e经谷胱甘肽琼脂糖凝胶树脂亲和纯化,用凝血酶酶切去除GST标签,之后对ATG8e进行SDS-PAGE割胶再纯化。用 BSA(质量浓度依次为1.0、0.5、0.25、0.125 mg/mL)定量,测得 ATG8e 质量浓度约为0.3 mg/mL(图3)。
2.3 ATG8e多克隆抗体的效价检测和制备
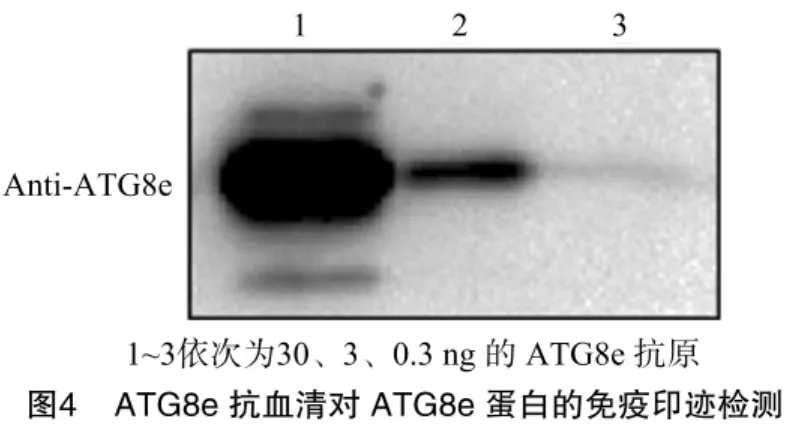
用分离纯化得到的ATG8e蛋白免疫家兔,收集免疫4次后的兔抗血清做免疫印迹检测。结果显示,1∶1 000稀释后的ATG8e兔抗血清能清晰检测到3 ng ATG8e蛋白(图4)。证明兔抗血清效价比较高,后续可以纯化抗血清制备高质量的ATG8e多克隆抗体。

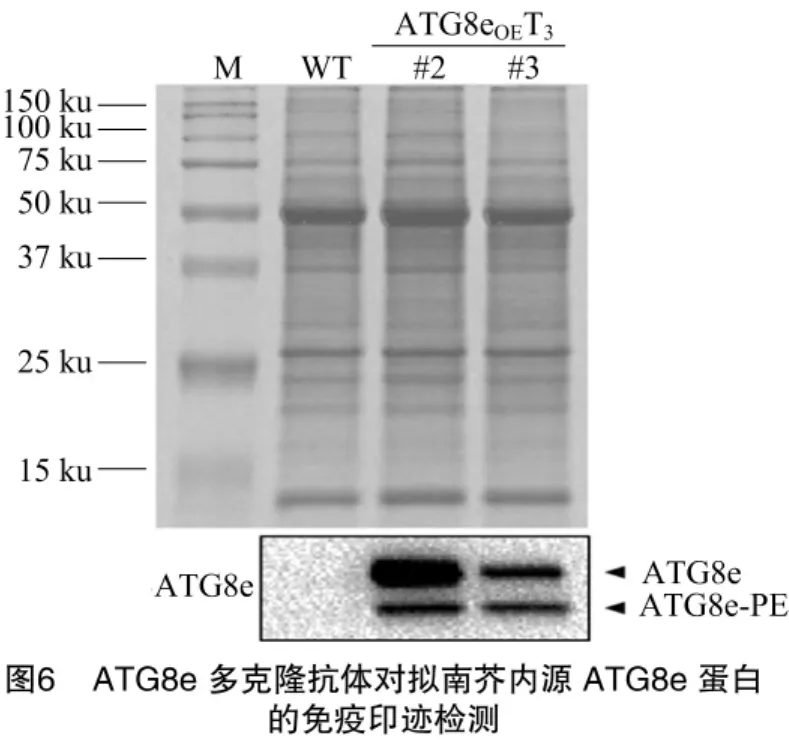
2.4 ATG8e多克隆抗体对拟南芥内源ATG8e蛋白的特异性检测
提取3周龄野生型拟南芥和2#、3#ATG8eOE(OE表示基因过表达)T3代植株叶片cDNA,做半定量PCR检测ATG8e在2种基因型植株中的表达水平(图5),以UBQ10作为内参。结果显示,2#、3#ATG8eOET3代植株ATG8e的表达量相较于野生型拟南芥植株明显增多。之后提取野生型拟南芥和2#、3#ATG8eOET3代植株叶片蛋白,每孔上样10μL进行Urea-SDS-PAGE(6 mol/L Urea)电泳,Anti-ATG8e多克隆抗体免疫印迹检测结果如图6所示。以野生型拟南芥为对照,2#、3#ATG8eOET3代植株叶片蛋白样品中 ATG8e和ATG8e-PE的积累量明显上调,尽管ATG8e-PE分子质量比ATG8e大,但是由于ATG8e-PE疏水性极强,其迁移率较ATG8e快[16];对应的是其考马斯亮蓝染液染胶结果,表明样品上样量一致性很高。这说明制备的ATG8e多克隆抗体能够特异性识别拟南芥内源ATG8e。
3 讨论与结论

已有报道表明,自噬相关基因在真核生物进化中高度保守[10],说明自噬对于机体正常有序的生命活动具有重要意义。在动物中,自噬与癌症、神经衰退型疾病、长寿有关[17]。在植物体中,自噬与胁迫响应[8]、病原体侵害[18]、衰老[19]相关。ATG8基因在细胞自噬过程中发挥了重要作用,由于ATG8家族的ATG8e在细胞内主要以ATG8e和ATG8e-PE这2种形式存在,后者可以通过PE基团锚定在自噬体膜上,参与自噬体成膜过程[7],ATG8e-PE的积累量能够表征植物个体自噬发生的程度。通常检测植物体自噬的分子标记有2种,一是单丹磺酰尸胺染色[20],它的缺点是可以使自噬体及所有酸性液泡都被染色,属于非特异性的,不是最佳自噬检测方法。二是ATG8蛋白的N端加绿色荧光蛋白GFP[20-22],可以在荧光显微镜下观察ATG8的定位,也可以利用GFP多克隆抗体做免疫印迹检测GFP-ATG8和剪切后游离的GFP积累量,间接估计自噬的程度,还可以用ATG8e蛋白多克隆抗体检测植物内源ATG8e和ATG8e-PE积累量,这对于研究自噬很有价值。另外,利用制备的ATG8e多克隆抗体做免疫印迹,可检测不同基因型拟南芥植株在非生物胁迫响应,如营养饥饿、氧胁迫、干旱等条件下,不同药物如刀豆素 A(concanamycin A)、E-64d、BTH 等处理时 ATG8e和ATG8e-PE的积累量,从而表征植物自噬发生的程度,是研究植物体自噬的有效工具。
本研究构建重组质粒pGEX-4T-1-ATG8e,在大肠杆菌系统下诱导表达融合蛋白GST-ATG8e,但引进标签GST所占比例过大,可能会影响目的蛋白活性,决定用切除标签GST的ATG8e蛋白免疫健康成年家兔制备多克隆抗体。本试验采用凝血酶酶切40 ku融合蛋白GST-ATG8e,将其分为14 ku的ATG8e和26 ku的GST 2个部分,14 ku的ATG8e因无GST结合位点,故从GST柱上流穿,而带有26 ku GST标签的融合蛋白会结合在柱子上,这样就可以将目的蛋白ATG8e与融合蛋白GST-ATG8e成功分离[23]。为了得到高效价的ATG8e蛋白,不仅先用GST柱亲和纯化,还将凝血酶处理的目的蛋白进行SDS-PAGE割胶再纯化。最后在检测植物内源ATG8e表达量时,不仅用了野生型拟南芥植株,还采用ATG8e过表达材料ATG8eOET3代充分证实制备的ATG8e多克隆抗体有效。
