绵羊卵母细胞3种体外培养方式下外源添加血管内皮生长因子对FLT-1表达的影响
2018-10-15邹云龙陆会宁高丹丹石国庆杨具田
曹 忻,邹云龙,陆会宁,高丹丹,周 平,石国庆,杨具田*
(1. 西北民族大学实验教学部,兰州 730030; 2. 西北民族大学生命科学与工程学院,兰州 730030;3. 新疆农垦科学院畜牧兽医研究所,石河子 832000)
Senger等[1]和Sirois和Edelman[2]在豚鼠、仓鼠和小鼠中发现血管内皮生长因子(vascular endothelial growth factor,VEGF),是一种具有促进血管通透性增加、细胞外基质变性、血管内皮细胞迁移、增殖和血管形成等作用的高度特异性生长因子,当血液循环不足,如在缺氧条件下,是将氧气供应恢复到组织中系统的一部分[3]。多集中于小鼠、大鼠和人医学研究,而关于绵羊方面的研究报道很少[4-16]。血管内皮生长因子受体1(fms-like tyrosine kinase-1,FLT-1)是VEGF的受体[17]。Terman等[18]证实,血管内皮生长因子受体2(kinase insert domain receptor,KDR)亦是VEGF的受体。除了与VEGF受体结合外,VEGF还与由神经皮素(neuropilins,NRP)和VEGF受体组成的受体复合物结合,这种受体复合物能增加VEGF信号活性[19-20]。而NRP是种优势多形性受体,因此其他分子可能干扰NRP/VEGFR受体复合物的信号。例如,第3类信号素与VEGF165竞争NRP结合,从而调节VEGF介导的血管生成[21]。本课题组的前期研究发现,VEGF在绵羊卵丘-卵母细胞复合体(cumulus-oocytes complexes,COCs)体外成熟过程中同时促进卵母细胞核成熟和细胞质成熟,以提供高质量的成熟卵母细胞[22-25]。VEGF是通过存在于卵母细胞和颗粒细胞中的两个受体FLT-1和KDR相结合而发挥其生物学作用[26]。本研究是对前期研究的持续,属于系列研究。本试验针对3种不同卵母细胞体外培养方式下,外源添加VEGF作为试验组,未添加VEGF作为对照组,利用qPCR和Western blot测定不同培养时间FLT-1 mRNA和蛋白分别在绵羊卵母细胞和颗粒细胞中表达变化。首次探究绵羊卵母细胞不同体外成熟培养方式下,VEGF对FLT-1分别在卵母细胞和颗粒细胞中的表达变化和具体影响,为后期明确VEGF在绵羊卵母细胞体外成熟和胚胎发育中的作用机制及路径研究奠定基础。
1 材料与方法
1.1 绵羊卵巢采集
新疆石河子市牛羊定点屠宰场屠宰的母绵羊,无菌手术剪剪下双侧卵巢,保存于25~30 ℃生理盐水中,3~4 h内带回实验室[27]。
1.2 3种不同培养方式及试验分组
采用剖切法采集卵母细胞,选取A、B级COCs,成熟液中清洗数遍后备用[27]。3种不同的体外成熟培养方式:①用移液器吹打COCs使颗粒细胞与卵母细胞分离,用口吸管将卵母细胞吸出,作为裸卵单独培养;②用移液器吹打COCs使颗粒细胞与卵母细胞分离,用口吸管将卵母细胞吸出备用,将含有颗粒细胞的成熟液2 500 r·min-1离心5 min,将颗粒细胞转移至培养皿中,随即将之前准备好的裸露卵母细胞转移至颗粒细胞上,作为颗粒细胞与裸卵共培养;③COCs直接转移至培养皿中,作为COCs培养。3种不同培养方式中,所有试验组添加5 ng·mL-1VEGF,对照组则不添加。5 ng·mL-1VEGF添加剂量根据前期研究结果确定[22-23]。
1.3 RNA提取与cDNA合成
用试剂盒对颗粒细胞和卵母细胞进行RNA提取并反转录成cDNA[27]。
1.4 实时定量PCR
根据NCBI提供的mRNA序列,采用Primer premier 5.0设计引物。FLT-1(114 bp)上游引物:5′-TGGCACAAAGACCCAAAAGA-3′;下游引物:5′-GGCGTTGAGCGGAATGTAG-3′。GAPDH(119 bp)上游引物:5′-CCTGCCAAGTATGATGAGAT-3′;下游引物:5′-TGAGTGTCGCTGTTGAAGT-3′。其中GAPDH为内参。引物由生工生物工程(上海)股份有限公司合成。
采用480Ⅱ qPCR仪进行实时定量PCR扩增,退火温度为60 ℃[27]。mRNA相对表达量采用2-ΔCT进行计算。
1.5 Western blot检测
采用湿转法对处理过的蛋白质样品经电泳、转膜、封闭、一抗孵育、二抗孵育后,用ECL对含有目的蛋白的PVDF膜处理后,用X光曝光,再用相关软件进行分析[27]。
1.6 数据分析
试验数据采用Excel 2016及SPSS 22.0进行统计分析,P<0.01表示差异极显著;P>0.05表示差异不显著。Origin 2018作图。
2 结 果
2.1 不同培养方式下外源添加VEGF对颗粒细胞FLT-1 mRNA表达的影响
图1结果表明,在共培养及COCs培养两种方式下,除颗粒细胞与裸卵共培养方式中未能在24 h检测到颗粒细胞FLT-1 mRNA表达外,其余不同培养时间下的试验组和对照组的颗粒细胞中均有FLT-1 mRNA表达。两种不同培养方式中,共培养对照组中颗粒细胞的FLT-1 mRNA表达量呈先降后升再降,0~8 h下降,8~20 h上升,其中16~20 h上升速率最快,在20 h时最高(3.31×10-1±1.32×10-3),20~24 h急速下降至0;共培养试验组中颗粒细胞的FLT-1 mRNA表达量从0~4 h开始上升,4~8 h略有下降,8~20 h又开始上升至最高(9.21×10-2±6.39×10-4),20~24 h急速下降至0;COCs对照组中颗粒细胞的FLT-1 mRNA表达量从0~12 h开始急速上升至最高(1.26×10-2±1.01×10-4),12~24 开始下降,其中16~20 h降速最快;COCs试验组中颗粒细胞的FLT-1 mRNA表达量在0~4 h阶段急速下降,4~24 h平稳下降至24 h最低(1.13×10-6±1.20×10-8)。12 和16 h各组间颗粒细胞的FLT-1 mRNA表达量差异极显著(P<0.01)。
2.2 不同培养方式下外源添加VEGF对卵母细胞FLT-1 mRNA表达的影响
图2结果表明,3种不同培养方式下,卵母细胞中均有FLT-1 mRNA表达。裸卵对照组中卵母细胞的FLT-1 mRNA表达量在0~24 h呈先降后升,在12 h降至最低(1.18×10-2±4.72×10-5),24 h最高(2.14×10-2±2.27×10-4);裸卵试验组中卵母细胞的FLT-1 mRNA表达量呈先升后降趋势,其中20 h升至最高(7.97×10-2±9.60×10-4);共培养对照组中卵母细胞的FLT-1 mRNA表达量总体呈上升趋势,其中16~24 h上升较快,尤其是20~24 h上升速率最大,24 h表达量最高(6.16×10-2±8.55×10-4);共培养试验组中卵母细胞的FLT-1 mRNA表达量在0~20 h总体呈波动性上升趋势,20~24 h急速上升至最高(4.26×10-2±3.42×10-4);COCs不论是对照组还是试验组中卵母细胞的FLT-1 mRNA表达量均呈下降趋势,其中0~8 h下降较快,尤其是0~4 h下降速率最大,在24 h表达量最低,对照组(4.18×10-5±3.86×10-7),试验组(3.21×10-5±2.56×10-7)。12 h时各组中FLT-1 mRNA表达量差异极显著(P<0.01)。20 h时裸卵试验组中的FLT-1 mRNA表达量为各时期各组中最高(7.97×10-2±9.60×10-4)。
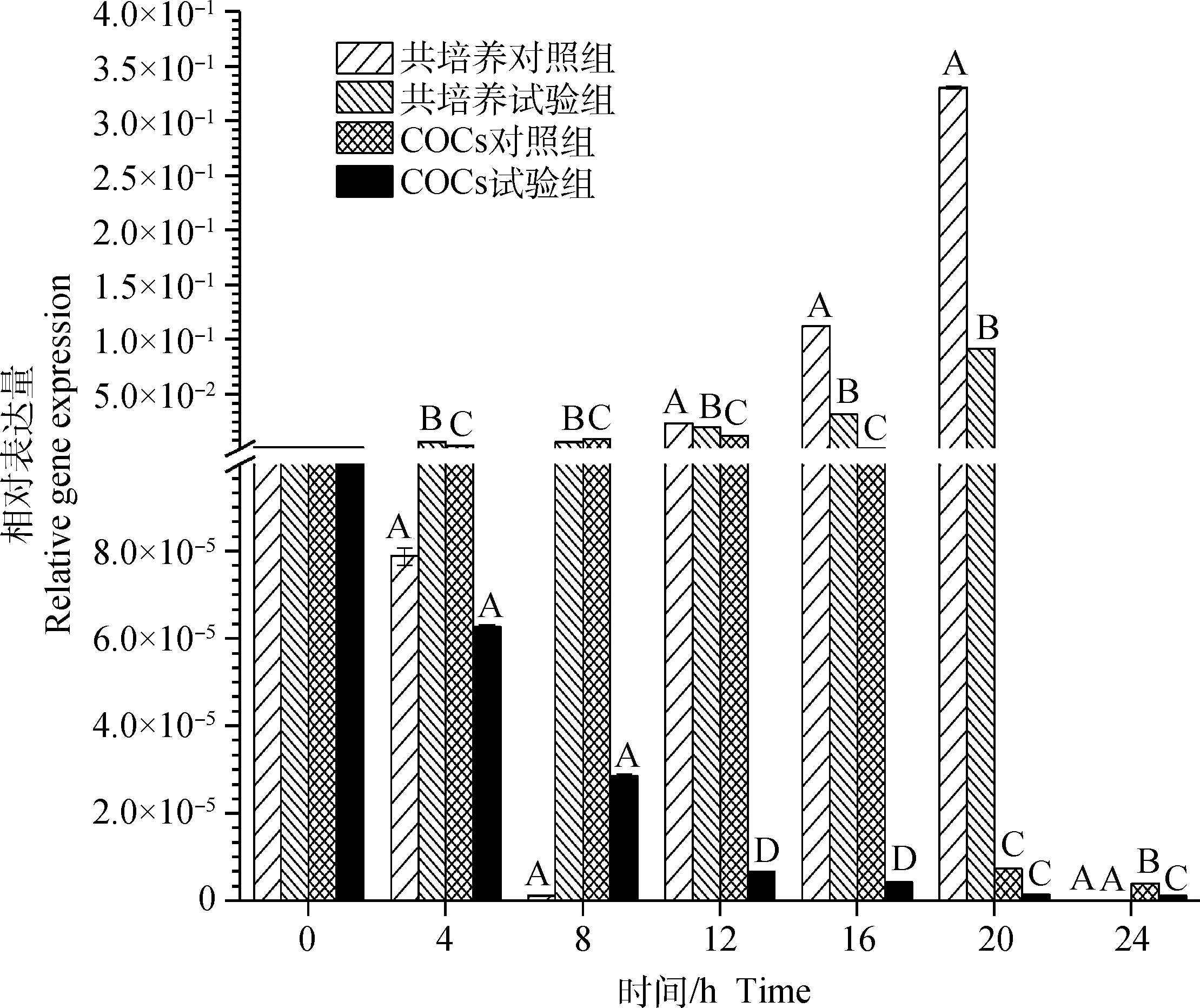
标注相同大写字母表示培养相同时间各组间差异不显著(P>0.05),标注不同大写字母表示培养相同时间各组间差异极显著(P<0.01)。下同The same capital letters indicate no significant difference in same culture time among different groups (P>0.05); The different capital letters indicate extremely significant differences in same culture time among different groups (P<0.01). The same as below图1 不同培养方式下颗粒细胞FLT-1 mRNA表达水平Fig.1 FLT-1 mRNA expression level in granule cells in different culture ways

图2 不同培养方式下卵母细胞FLT-1 mRNA表达水平Fig.2 FLT-1 mRNA expression level in oocytes in different culture ways
2.3 不同培养方式下外源添加VEGF对颗粒细胞FLT-1蛋白表达的影响
图3结果表明,除24 h在共培养对照组和试验组中未检测到颗粒细胞FLT-1蛋白表达外,其余各时间点不论是共培养还是COCs培养,颗粒细胞中均有FLT-1蛋白表达(图3A)。两种不同培养方式中,共培养对照组和COCs对照组中颗粒细胞的FLT-1蛋白表达量均呈先升后降趋势,其中共培养对照组在8 h时最高(15 859),COCs对照组在12 h最高(14 510);共培养试验组和COCs试验组颗粒细胞的FLT-1蛋白表达呈波动性下降趋势。不论是COCs对照组还是试验组颗粒细胞中FLT-1蛋白表达量在各时间点均高于同期共培养试验组(图3B)。
2.4 不同培养方式下外源添加VEGF对卵母细胞FLT-1蛋白表达的影响
图4结果表明,3种不同培养方式中,卵母细胞中均有FLT-1蛋白表达(图4A)。3种不同培养方式中,除裸卵试验组在20~24 h有一个急剧拉升外,其余所有组中FLT-1蛋白表达量总体均呈波动性下降趋势;裸卵对照组、共培养对照组、共培养试验组、COCs对照组以及COCs试验组中卵母细胞FLT-1蛋白含量均在24 h检测到最低值,分别为10 548、8 303、13 827、6 714和6 681;卵母细胞中FLT-1蛋白表达量在各组中的关系:裸卵试验组>共培养试验组>裸卵对照组>共培养对照组>COCs对照组>COCs试验组(图4B)。

A. Western blot检测;B. 灰度值分析A. Western blot test; B. Grayscale analysis图3 不同培养方式下颗粒细胞FLT-1蛋白表达水平Fig.3 FLT-1 protein expression level in granule cells in different culture ways

A. Western blot检测;B. 灰度值分析A. Western blot test; B. Grayscale analysis图4 不同培养方式下卵母细胞FLT-1蛋白表达水平Fig.4 FLT-1 protein expression level in oocytes in different culture ways
3 讨 论
绵羊卵母细胞体外成熟培养过程中颗粒细胞作为营养因子的传输者,在卵母细胞成熟过程中起重要作用。而VEGF已经被证明能够在体外刺激细胞分裂和细胞迁移[28-29]。本研究结果表明,FLT-1 mRNA的表达量在绵羊卵母细胞成熟过程中并非恒定不变,在不同的时间点有不同的表达量,表达量的升降随着时间的变化贯穿培养过程始终,即在不同培养阶段表达量不同,体现出了一种阶段性; mRNA作为一种不稳定的蛋白质信息源,很容易就会被降解,只有当同一mRNA产生的速度与降解的速度相一致时,才能维持同一mRNA总量的不变,而本试验中,FLT-1 mRNA的表达量在某些时间段是急剧下降的,表明在该时间段内,FLT-1 mRNA产生的量远小于被降解的量,具有一定的时效性;在3种培养方式中,FLT-1 mRNA的表达有呈下降趋势的(COCs试验组颗粒细胞和COCs组卵母细胞),有呈上升趋势的(共培养组卵母细胞),有呈先降后升趋势的(裸卵对照组卵母细胞),有呈先降后升再降趋势的(共培养对照组颗粒细胞),以及先升后降趋势的(共培养试验组颗粒细胞、COCs对照组颗粒细胞和裸卵试验组卵母细胞),造成以上不同趋势表达的原因除了颗粒细胞与卵母细胞的不同接触方式外,还因为有外源VEGF的添加与否,从而导致了不同培养方式下FLT-1 mRNA的不同表达模式。在裸卵单独培养方式下,对照组卵母细胞FLT-1的mRNA和蛋白都有表达,说明卵母细胞中存在FLT-1的自分泌。FLT基因是属于酪氨酸家族的原癌基因,与细胞生长和分化密切相关[30],这也验证了FLT-1存在于卵母细胞中的合理性,但要想其能发挥生物学效应以影响卵母细胞的成熟,FLT-1必须要与VEGF相结合,推断VEGF在卵母细胞中也存在自分泌。在体内检测了VEGF及其受体FLT-1在金黄地鼠植入前胚胎中的表达情况,发现在交配后第3~7天 胚胎中,均检测到VEGF及其受体FLT-1蛋白的表达,并随着发育过程表现不同变化规律。另外伴随外源VEGF的添加在整个培养时间内FLT-1 mRNA表现出活跃的表达量增加(除了24 h外),但其蛋白水平的表达量下降(除了24 h外),说明在体外培养环境下外源添加VEGF有效的激活了FLT-1 mRNA表达,但同时结合FLT-1蛋白以促进卵母细胞成熟的生物学效应,从而减少了FLT-1蛋白的表达,添加VEGF是提高卵母细胞成熟效率的有效手段之一,这与笔者前期研究外源VEGF可提高卵母细胞成熟率结果相互印证。而24 h的mRNA下降和蛋白水平的提升,推断是与添加VEGF试验组的卵母细胞大部分已经完成了成熟过程有关,这与笔者前期研究发现VEGF添加试验组在20 h已成熟卵母细胞数量显著高于对照组结果相吻合[26]。
3种培养方式试验结果表明,卵母细胞中FLT-1 mRNA和蛋白的表达与外围颗粒细胞的存在与否、数量的多少以及包裹方式息息相关。在COCs组中,添加VEGF无论是在颗粒细胞内还是在卵母细胞内都显著降低了4~8 h FLT-1 mRNA和蛋白的表达。说明颗粒细胞的存在抑制或者减少了FLT-1的表达,也许是由于颗粒细胞的旁分泌作用抑制了FLT-1 mRNA的表达,但外源添加的VEGF有效结合了FLT-1导致其蛋白表达量下降。除4~8 h颗粒细胞FLT-1 mRNA外,共培养方式下的各组FLT-1 mRNA和蛋白表达量均显著高于COCs培养方式下的各组(颗粒细胞中FLT-1蛋白表达除外,且这两种培养方式下其表达量变化趋势相似),说明COCs培养方式下,VEGF和其受体FLT-1作为营养因子在颗粒细胞与卵母细胞间的互作更活跃,这也充分说明了颗粒细胞对卵母细胞成熟发育的重要作用,而COCs方式下,卵母细胞与颗粒细胞的接触面积远远超过共培养方式下的,这大大促进了VEGF和FLT-1的有效结合,从而令检测到的FLT-1 mRNA和蛋白表达量下降。在各培养方式下,未添加VEGF对照组FLT-1蛋白都在4~8 h左右呈现先升后降的趋势,尤其以两对照组颗粒细胞中FLT-1蛋白表达结果明显,推断这与生发泡破裂(germinal vesicle breakdown,GVBD)的发生有关,而颗粒细胞组中的结果判断与颗粒细胞的调节作用至关重要。具有发育潜能的卵母细胞要首先获得生发泡破裂的能力,才能逐渐获得完成成熟分裂的能力,以产生高质量的、具有受精能力的卵母细胞[31],而前期研究结果发现,添加VEGF有效促进了绵羊卵母细胞体外培养过程中GVBD的完成[26]。外源添加VEGF对4~12 h颗粒细胞FLT-1蛋白表达和20~24 h卵母细胞FLT-1蛋白表达影响最明显。说明外源添加VEGF对FLT-1的影响主要发生在卵母细胞成熟前期的颗粒细胞中和卵母细胞成熟后期的卵母细胞中[22]。表明,颗粒细胞中FLT-1表达对GVBD的完成至关重要,而卵母细胞中FLT-1表达对卵母细胞成熟后期的影响巨大。
本研究结果显示,添加VEGF能够有效稳定FLT-1蛋白表达波动幅度,即添加VEGF能够促使卵母细胞体外培养过程中FLT-1蛋白更稳定的表达。FLT-1作为VEGFA、VEGFB和PGF的细胞表面受体,在胚胎血管形成、血管生成、细胞存活、细胞迁移、巨噬细胞功能、趋化、癌细胞侵袭等方面发挥着重要作用[32]。通过抑制内皮细胞的过度增殖,可以作为胚胎血管生成的负调节因子发挥重要作用[33]。对VEGFA和相对低活性蛋白激酶有很高的亲和力;可作为VEGFA信号的负调控因子,限制游离VEGFA数量,并阻止其与KDR结合[34]。推测本试验卵母细胞体外成熟过程中,对照组FLT-1蛋白的下降跟FLT-1与游离VEGF结合有关。另一方面,一些缺乏跨膜域的亚型,如:亚型2、亚型3和亚型4,可以作为VEGFA的诱变受体,从KDR中分离VEGF(这在胚胎的血管生成中尤为重要)[35],通过与KDR形成异质二聚体来调制KDR信号[36-38],KDR蛋白在整个卵母细胞成熟过程中都有表达,在未成熟的卵母细胞和颗粒细胞的膜表面也有表达[26],推测FLT-1蛋白下降跟KDR结合也密不可分。配体结合导致了几个信号级联激活,PLCG活化导致了细胞信号分子二酰基甘油和肌醇1,4,5-三磷酸和蛋白激酶C(PKC)激活。外源添加VEGF能够令对照组中前16 h的PKC表达趋势提前2 h,即PKC在外源VEGF的作用下被提前激活[26]。PKC可介导磷脂酰肌醇3-激酶受体1(phosphatidylinositol 3-kinase receptor 1,PIK3R1)的磷酸化,磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PIK3)亚基的调节,导致磷脂酰肌醇激酶和下游信号通路的活化,协调激活MAPK1/ERK2、MAPK3/ERK1和MAP激酶信号通路,以及AKT1信号通路[39-42]。笔者对绵羊卵母细胞体外成熟的研究表明,外源添加VEGF提前激活PKC能够提高卵母细胞中MAPK的表达[26],推断FLT-1跨膜域亚型与KDR形成异质二聚体调节KDR信号被进一步放大,从而导致MAPK信号通路被进一步激活, MAPK表达量增加,而FLT-1与KDR的结合也是导致FLT-1表达量下降的原因之一。卵母细胞中FLT-1蛋白表达量在24 h时,卵母细胞中FLT-1蛋白表达量在各组中的关系:裸卵试验组>共 培养试验组>裸卵对照组>共培养对照组> COCs对照组>COCs试验组。
绵羊卵母细胞体外成熟培养是一个相当复杂的过程。VEGF对绵羊卵母细胞体外培养成熟方面有着积极促进作用[22-23, 25-26],这种促进作用同时也影响着FLT-1 mRNA和蛋白在颗粒细胞和卵母细胞中的表达。其中颗粒细胞中FLT-1蛋白在卵母细胞成熟前期的低表达有助于卵母细胞GVBD的完成,而卵母细胞中FLT-1蛋白稳定下降也有助于卵母细胞的成熟。本研究结果可为进一步研究绵羊卵母细胞体外成熟过程VEGF和其受体间的交互作用及其作用机制奠定基础。
4 结 论
卵母细胞和颗粒细胞中存在FLT-1的自分泌和旁分泌作用,其表达具有阶段性、时效性和模式性;卵母细胞中FLT-1 mRNA和蛋白的表达与外围颗粒细胞的存在与否、数量的多少以及包裹方式息息相关;在体外培养环境下外源添加VEGF有效地激活了FLT-1 mRNA表达,但同时结合FLT-1蛋白以促进卵母细胞成熟的生物学效应,从而减少了FLT-1蛋白的表达。
