基于核酸适配体的非标记荧光检测技术发展研究
2018-10-15张天源杨瑞琴郝红霞
张天源, 杨瑞琴, 郝红霞
(1.中国人民公安大学刑事科学技术学院, 北京 100038;2.中国政法大学证据科学教育部重点实验室, 北京 100088)
0 引言
核酸适配体是单链结构的DNA或RNA序列,通常有15~40个碱基长度,它可与蛋白质或其他有机和无机分子结合[1]。核酸适配体具有高亲和力、特异性和稳定性等优点,且无免疫原性。此外,与筛选抗体的生物学过程不同,核酸适配体是体外化学合成的,可以很容易地进行修饰,因此被称为“化学抗体”[2]。
目前,利用核酸适配体为识别元件并结合其他检测技术,已经构建了多种类型的检测方法,包括表面等离子体共振(SPR)[3]、比色法[4]、电化学发光法(ECL)[5]、电化学法[6]、表面强化拉曼散射法[7]以及荧光法[8]。其中,荧光法在构建基于适配体的生物传感技术中最为常用,这是由于荧光法在保证高灵敏度和准确性的同时,还能实现对待测物的高通量检验分析。然而,大部分现有的方法需要利用荧光(淬灭)基团来标记核酸或者对适配体上的碱基进行修饰[9],无法实现快速检验。相反,非标记荧光法无需对适配体进行修饰,具有操作简单、灵敏度高、成本低等优点。因此,基于适配体的非标记荧光检测技术为靶标的快速检测提供了可能。
1 适配体的筛选
核酸适配体是通过体外筛选和扩增技术得到的一段寡核苷酸序列,20世纪90年代初,Tuerk和Gold[10]通过T4 DNA聚合酶筛选实验,首次提出并命名了SELEX技术。其基本原理主要包括以下3个步骤[11]:如图1所示,第一步,合成一个含有1012~1015个随机序列的寡核苷酸文库,通常每个序列含有20~50个碱基,每条单链的两端是与引物结合的保守序列。第二步,随机序列文库在适宜的温度和缓冲体系条件下与靶分子混合孵育,再分离与靶物质有强亲和力的结合序列。第三步,通过PCR技术将第二步得到的DNA进行扩增,变性成单链以备下一轮筛选;若为RNA SELEX,则需要运用逆转录- 聚合酶链反应(RT-PCR)来实现RNA的扩增,扩增得到的产物形成寡核苷酸亚库,用作新一轮的筛选。这3步组成了SELEX技术的一个循环周期。分离被筛选出的核酸,SELEX筛选结束。5~15轮的SELEX筛选后,解离常数(Kd)在皮摩尔到纳摩尔范围,最终形成含有高亲和力的核酸序列。然而,传统的SELEX技术在获得高质量的适配体方面仍然存在技术瓶颈,为了缩短筛选周期和提高结合率,CE-SELEX[12]、MAI-SELEX[13]、AEGIS-SELEX[14]、ES-SELEX[15]、MSD-SELEX[16]等新的筛选技术已被成功地运用于高特异性适配体的筛选。

图1 SELEX技术原理示意图[17]
2 非标记荧光技术的研究进展
基于适配体的荧光技术的机理是将适配体作为生物识别元件,适配体与靶标的结合引起整个体系的荧光强度发生改变,从而达到检测目标物的目的。当前,已经开发出众多基于适配体的荧光检测方法,一般分为标记型荧光检测法和非标记型荧光检测法两大类。
标记型荧光检测法的基本思想是把荧光基团和淬灭基团或者荧光供体和受体基团修饰在适配体的末端或者活性位点上[18]。适配体与靶标结合后发生构象变化。从而改变荧光基团的相对位置,导致荧光强度发生变化,然而该方法操作步骤复杂、费时并且成本较高,甚至会显著降低适配体与靶标的结合力产生较高的背景信号,影响检测结果,不利于高灵敏度测定[19],这些因素促进了用于检测适配体靶向结合后构型变化的光敏化合物或嵌入染料的发展。目前,迫切需要开发一种非标记、灵敏、准确、高效的荧光检测技术。
非标记型荧光检测法的机理是靶标直接与适配体结合改变了适配体的二级结构,或者通过互补序列以竞争的方式与适配体杂交,这些识别过程改变了适配体周围的环境,进而减弱或增强荧光物质与适配体间的作用即荧光信号的强弱[20]。近年来,相关研究人员利用不同的荧光物质开发了多种适配体非标记荧光检测技术,根据荧光信号的产生机理,主要分为3类:染料嵌入型、信号放大型和纳米颗粒结合型。下面将对现有的适配体非标记荧光技术进行归纳、总结。
2.1 染料嵌入型
在嵌入型荧光法中,荧光染料通过嵌入、电荷作用及分子堆积等方式与适配体或含有适配体的双链DNA相互作用,从而导致荧光产生或淬灭。
一部分荧光染料由于水分子氢键的作用,抑制了荧光的产生,导致溶液荧光信号极弱。但当溶液中出现dsDNA时,染料分子与双链结构嵌合后,荧光强度增强;当体系中的dsDNA转换成ssDNA时,荧光信号逐渐减弱。这类染料是基于对单、双链DNA的结构差异来改变荧光信号的强度,从而达到检测目的。
Wang等[21]利用适配体和PicoGreen构建了一种非标记的检测法。PicoGreen是一种新型的商业化染料,如图2所示,它与dsDNA结合产生很强的荧光信号,游离于溶液中PicoGreen不产生荧光。实验原理为:将适配体与等体积的cDNA杂交,得到具有双链结构的aptamer/cDNA,随后加入含有靶物和能够嵌入双链的PicoGreen混合溶液。混合后的产物夹在盖玻片和镀有银膜(SIFs)的载玻片之间,靶物与适配体竞相结合使aptamer /cDNA的双链结构被破坏,释放出PG染料和cDNA,游离的PG染料不与单链的cDNA结合,导致荧光淬灭。当没有靶物存在时,SIFs与PicoGreen之间存在金属增强荧光效应(MEF),从而增强了体系的荧光,荧光强度与靶标浓度成反比。作者用该方法检测了ATP和凝血酶,检出限分别为1.3nM和0.073nM。运用该方法检测血清中的ATP,荧光淬灭效率较缓冲液中的ATP样本降低了7.4%,能够检出5.2nM的ATP,该检测法在检测实际样本中的ATP效果更好。Luan[22]等采用相同原理,利用PicoGreen实现了水中镉离子的快速检测,检出限为0.038 ng/mL。

图2 双链嵌入型染料PicoGreen检测靶标
Li等[23]设计了一种检测凝血酶的荧光分子开关,其中,溴化乙淀(EB)为荧光基团,适配体为识别基团。实验原理为:EB分子呈扁平状,它可以嵌入核酸双链的配对碱基之间,游离于溶液中的EB显示出很低的荧光强度,在与dsDNA或双股RNA结合时,荧光强度明显增强,而对于ssDNA或RNA不会产生明显的荧光强度增强现象。首先,通过SELEX技术筛选出抗凝血酶的ssDNA,筛选出的适配体有15个碱基序列并且与其互补链形成dsDNA;加入EB后,形成EB-dsDNA复合物,体系荧光强度增强,EB荧光强度是游离态的11倍。凝血酶存在时,构成EB-dsDNA-thrombin复合物导致双链解开并释放EB染料和互补链,体系的荧光强度迅速减弱。荧光强度随溶液中凝血酶含量的上升而减弱,检出限为2.8nM。
Xu等[24]开发了一种以孔雀石绿(MG)为报告基团的非标记荧光传感器,原理是MG染料与其适配体结合会产生荧光,当MG游离于溶液中时,几乎没有荧光产生。该传感器中含有两条核苷酸链,一条链是腺苷和MG的适配体共轭嵌合体,另一条作为互补链——桥接ssDNA,两条链形成dsDNA,从而抑制了MG与其适配体的结合,当有腺苷存在时,腺苷与腺苷适配体特异性结合,双链结构被破坏,桥接链脱离适配体链,MG与MG适配体结合,体系的荧光强度显著增强,荧光强度越强表明腺苷浓度越高,检出限为20 μM。
Daniel等[25]设计了一种基于适配体的非标记荧光法检测可卡因。核酸适配体MNS-4.1既能特异性结合可卡因也能和荧光分子ATMND结合,并且适配体与ATMND结合导致荧光淬灭。可卡因存在时,适配体与可卡因结合形成Y型结构复合物,使已经与适配体结合的ATMND被迅速地释放到溶液中,溶液中游离的ATMND产生很强的荧光,荧光强度与可卡因的浓度成正比。在适配体MNS-4.1的基础上,通过G-T摇摆配对得到适配体38-GT,再用G-C碱基对替换G-T碱基对,最终得到适配体38-GC。相较于MNS-4.1,适配体38-GC对可卡因和ATMND有更强的结合能力并且能够增强整个体系的荧光信号。基于适配体38-GC和荧光物质ATMND的荧光检测技术能够实现对可卡因的快速检测,检出限为200nM。更重要的是,该技术已成功应用于唾液、尿液和血清中可卡因的检测,检出限分别为10.4 μM、18.4 μM和36 μM。
G四链体DNA(G4)是一种功能性核酸,随机状态的富含G的ssDNA通过折叠形成G四链体结构[26],G4的出现为靶标检测提供了另一种选择。
Fan等[27]利用G四链体结构的ssDNA、钾离子和血晶素构建了一种检测钾离子浓度的非标记荧光传感器。当有钾离子时,富G的ssDNA折叠成G-四链体结构,血晶素与G-四链体结构结合形成DNA酶,HPPA被过氧化氢氧化,氧化反应产物具有良好的荧光性能,钾离子浓度越高,反应产物浓度越高,荧光越强。钾离子不存在时,富G的钾离子适配体处于随机状态,不能形成DNA酶,从而无法催化HPPA与过氧化氢的氧化反应。该传感器检测钾离子浓度的线性范围是2.5 μM至5 mM,作者利用该传感器检测了血清样本中的钾离子浓度,实验结果表明该传感器可以对实际样本进行检测。Mao等[28]运用相同的技术原理,利用荧光物质ABTS被过氧化氢氧化生成的产物与G-四链体结合,使荧光强度增强来检测尿液中的甲基苯丙胺浓度,该方法对尿液中甲基苯丙胺的检出限是0.5 nM。
Xing等[29]构建了一种基于适配体的噻唑橙(TO)荧光探针检测卡那霉素。如图3,在溶液中游离的噻唑橙(TO)几乎没有荧光,但当TO染料与G-四链体结构的DNA结合时,能发出很强的荧光。实验中,设计一条具有平行构型G-四链体结构(G4-DNA)的适配体,加入TO染料后,TO与G4-DNA迅速结合形成G4-DNA-TO复合物并产生很强的荧光信号。当存在卡那霉素时,卡那霉素与适配体特异性结合,替换了G4-DNA-TO复合物上的TO染料,体系荧光强度迅速降低,荧光强度与溶液中卡那霉素的含量成反比,检出限为59nM。此外,向牛奶中加入不同浓度的卡那霉素,考查该检测法的回收率,得到的平均值范围为80.1%~98.0%,这表明该方法在实际应用中有较高的准确度。

图3 G4-DNA嵌入型染料噻唑橙检测卡那霉素
此外,还有一类嵌入型的染料通过静电吸附作用与适配体结合,游离态的染料显示出较强的荧光,但与适配体结合后,由于聚集荧光淬灭效应,荧光信号衰减。
Lv等[30]合成了一种水溶性苝酰亚胺染料(PTCDI),PTCDI以单体的形式游离于溶液中且带有两个正电荷,电荷间的斥力降低了它的堆积,从而显示出很强的荧光强度。如图4,由于凝血酶的适配体含有多个带负电荷的磷酸基团。在静电吸附非作用下,PTCDI单体吸附到适配体上,由于聚集诱导荧光淬灭效应,体系荧光强度降低;加入靶标凝血酶,适配体与凝血酶结合形成G-四链体结构,释放PTCDI单体,荧光强度恢复。该方法的检出限为40pM。Wang[31]等运用相同的技术原理,利用PTCDI染料和溶菌酶的适配体检测了溶菌酶,检出限为0.07nM。

图5 基于酶修复扩增的信号放大策略检测病原菌

图4 静电吸附型苝二酰亚胺染料检测凝血酶
上述染料嵌入型非标记荧光法具有低成本、使用方便等优点,但是,这类方法中采用的染料与核酸的结合位点不确定,不利于考察荧光染料在反应体系中的性能,检测结果易受到背景信号的干扰,因此,在不同的分析实验中需要对其进行优化。
2.2 信号放大型
信号放大技术是将核酸扩增与荧光技术联用来提高检测的灵敏度,这为超灵敏适配体荧光传感器的设计提供了一种新的模式。
Leng等[32]利用酶修复扩增策略(ERA)构建了一种荧光生物传感器用于快速检测病原菌。靶标- 适配体结合介导的酶修复扩增反应,在聚合酶和两种DNA修复酶的作用下进行循环,尿嘧啶DNA糖基化酶(UDG)和核酸内切酶Ⅳ(Endo Ⅳ)被用作放大荧光信号。如图5所示,实验中,专门合成了一种发夹探针(HAP),它被用作DNA模板,产生大量的报告寡核苷酸和辅助引物,引发新一轮的聚合修复循环。此外,通过核酸内切酶IV催化的修复反应,可以周期性地裂解荧光淬灭探针。聚合酶催化结合病变基质与UDG和EndoⅣ辅助的酶修复扩增相结合,从而实现识别信号放大的多轮循环,最终达到快速检测病原菌的目的。在理想条件下,该传感器显示出了很高的灵敏度,检出限为9.86 cfu mL-1且检测范围为5个数级。
Xu等[33]基于外切核酸酶催化循环(ECTR)扩增策略和SYBR Green Ⅰ染料,构建了一种检测ATP的非标记荧光传感平台。Exo Ⅲ的催化作用是从双链DNA钝性或凹陷的3’-羟基末端开始,逐步酶解单核苷酸,且对ssDNA或3’端突出的dsDNA无作用。ATP不存在时,含有ATP结合序列的发夹适配体和五个3’端突出的单核苷酸抗外切酶的水解,因此,SGI可以嵌入发夹结构的茎部,在520 nm的紫外光激发下产生强烈的荧光信号。相反,当溶液中出现ATP时,它与适配体上相应的序列结合后,发夹适配体重新配置得到3’端是凹陷末端的发夹结构,从而被Exo Ⅲ切割,释放出ATP。被释放的ATP再次与其他适配体上的序列结合,启动下一轮的循环进程。这种自发的循环过程,导致大量发夹核酸适配体的裂解且使嵌入发夹适配体探针的SGI的数量急剧减少,从而抑制了荧光信号,实现了对ATP的高灵敏检测,检出限为9.5nM。
除酶诱导的信号放大策略外,还包括聚合酶链反应(PCR)、滚环放大(RCA)、杂交链式反应(HCA)等,但是,这些扩增技术易受到环境和昂贵仪器设备等条件的限制。为此,Fu等[34]基于发夹DNA的自组装,开发了一种无酶的基于适配体和荧光染料NMM的非标记荧光法。如图6,H1和H2为发夹结构的DNA链,且H2中的位点4和位点5能形成G-四链体结构。位点4隐藏在发夹H2的茎部,因此,现阶段无法形成G4。首先,由于Apt-C与抑制链(Inh)杂交,催化链的催化效应被抑制。腺苷与适配体结合使Apt-C与Inh间的互补碱基对逐渐减少,从而大大减弱了双链结构的稳定性,导致双链解开,释放出抑制链(Inh)。Apt-C的位点1被暴露出来随后在发夹H1的1*位点成核,这引起分支迁移,H1暴露出位点3、4、1;发夹打开的H1成为位点3和发夹H2上3*位点间成核的新引发剂,随着分支迁移作用,H2的位点3、2、1、4和5全部被展露出来,其中,位点3、2、1置换了Apt-C,得到了H1-H2自组装后的复合物,且发夹H2的4、5位点在复合物的一端形成了G4。被释放的Apt-C参与到下一轮的反应过程中。加入荧光染料NMM,NMM对G-四链体结构具有很强的选择结合能力,增强荧光信号,随着腺苷浓度的增加,H1-H2复合物数量增加,所以,荧光强度与腺苷浓度成正比,此外,该方法不易受腺苷类似物的干扰,检出限为6 μM。

图6 基于DNA发夹自组装信号放大策略的非标记荧光技术检测腺苷
Wang等[35]构建了一种基于等温循环扩增策略的比率荧光生物传感器来检测癌胚抗原(CEA),检测原理是:靶标激发一个循环过程来分裂银纳米簇对(AgNCs),导致其荧光信号减弱。同时,释放出的大量G4序列增强了THT染料的荧光强度,最终达到检测目的。实验中,识别和扩增两部分共同组成了一种DNA机制,使用两种免标记的荧光探针——ThT和AgNCs,当CEA不存在时,在扩增部分中,G-DNA与带有AgNCs的Ag-DNA1和Ag-DNA2杂交并在一端形成纳米团簇对,得到很强的荧光信号(FAgNCs) ,同时,由于G4结构的形成被抑制,ThT荧光信号(FTHT)极低;当加入CEA时,在识别部分,发夹H-DNA特异性结合CEA,适配体构象的改变暴露出激发序列引起了扩增;在扩增过程中,适配体/CEA复合物(H/C) 在立足域激发了一系列的链置换反应从而抑制了银纳米簇对的形成,释放出更多的G-DNA,ThT染料与三链结构的G-DNA结合导致荧光强度(FTHT)的显著增强,AgNCs荧光强度(FAgNCs) 的骤然下降。基于比率FTHT/FAgNCs,从而实现对CEA定量检测的高灵敏度和特异性,检出限为0.1 ng/mL。同时,当有其他干扰物存在时,该方法展现出对CEA优异的选择性。今后,在现阶段的信号放大策略下,通过改变适配体的构型还可以检测其他生物标志物,这为信号放大型非标记荧光技术提供了新的思路,应用前景广阔。
2.3 纳米颗粒结合型
基于纳米颗粒的非标记荧光检测平台具有反应灵敏、无酶和特异性高等优点,随着纳米材料技术的快速发展,纳米材料的选择性越来越受到人们的关注。
纳米金(AuNPs)具有较高的消光系数和随尺寸变化的荧光特性,被视为最理想的纳米颗粒,广泛应用于光学适配体传感器[36]。
Gu等[37]利用分子刷型荧光共轭聚合物ThNI与纳米金结合的策略来检测溶菌酶。ThNI是一种高电荷密度的阳离子聚合物,如图7,适配体通过很强的π-π堆积吸附在AuNPs的表面,基于此,AuNPs不会聚集且溶液呈红色。带负电荷的AuNPs/ssDNA复合物和正电荷的ThNI间的强烈的静电相作用,导致AuNPs和ThNI间距变小,由于存在能量共振转移(FRET),ThNI荧光淬灭。当溶菌酶出现时,ssDNA与溶菌酶特异性结合,引起AuNPs大规模聚集,溶液呈蓝色。由于高密度的刷型ThNI和大量AuNPs的聚集,AuNPs与ThNI之间达到一定距离,从而ThNI的荧光不淬灭。随着溶菌酶浓度的增加,荧光信号逐渐增强,检出限为10nM。该方法被成功地应用于检测人唾液中的溶菌酶,实验中,滴加的的唾液量越多,溶液颜色由红色变为紫色最终变成蓝色,这进一步证明了该方法具有简便、灵敏度高、快速和特异性好等优点。
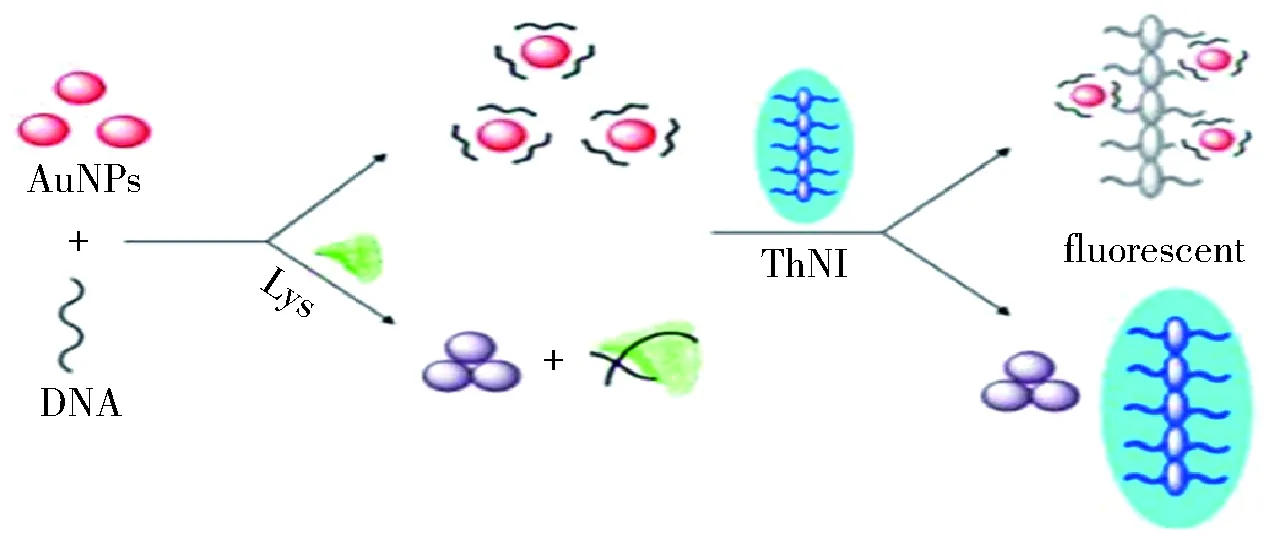
图7 基于纳米金和刷型共轭聚合物的非标记荧光技术检测溶菌酶
纳米二氧化硅是构建各类荧光传感器中最常用的纳米物质,具有表面积大、化学性能稳定和亲水性强等特点。此外,纳米二氧化硅还能够增强荧光基团产生的荧光信号[38-39]。
Taghdisi等[40]利用纳米二氧化硅(SNPs)和铜纳米颗粒(CuNPs)构建了一种荧光适配体传感器来检测γ-干扰素(IFN-γ),该生物传感器是基于铜纳米颗粒(CuNPs)作为荧光报告基团 、链霉亲和素包覆的纳米二氧化硅(SNPs-Streptavidin)、对单链DNA有高特异性的结合蛋白(SSB)和含有核酸适体序列和聚胸腺嘧啶(T)序列的发夹结构寡核苷酸。没有IFN-γ存在时,寡核苷酸以发夹结构的状态存在于链霉亲和素包覆的纳米二氧化硅表面,所以SSB未能与ssDNA结合。随后加入铜离子和抗坏血酸,通过结合寡核苷酸中含有dsDNA和聚T序列的干区,形成铜纳米颗粒,最终基于DNA模板的纳米铜粒子释放出很强的荧光信号。当加入IFN-γ后,寡核苷酸的发夹结构解开,形成Aptamer/IFN-γ复合物,含有聚T序列寡核苷酸的3端变成ssDNA并与SSB结合,加入铜离子和抗坏血酸后,由于体系中不存在dsDNA和聚T序列,缺少了形成荧光铜纳米颗粒的模板,因此,荧光信号极弱。该传感器展现了理想的线性范围10 pg/mL~4 ng/mL,在缓冲液中γ-干扰素的检出限为1 pg/mL。同时,该方法成功应用于检测血清中的γ-干扰素,分析结果的相对标准偏差小于7.1%,回收率在92.52%~98.32%之间。
量子点(QDs)是一种纳米发光半导体晶体,具有独特的光学和电学性质,例如发射光谱峰窄而对称;可得到与量子点尺寸相关、可调谐的吸收和发射光谱[41]等。与传统的有机荧光染料相比,量子点的光致发光具有很多优势,包括量子产率高、优异的光稳定性和更强的抗光漂白性,近年来,量子点作为新型的发光指示物备受人们的关注[42]。
Sun等[43]利用量子点和多吡啶钌配合物Ru设计了一种非标记的DNA荧光传感器检测水溶液中的银离子。量子点(QDs)作为荧光发射物,多吡啶钌配合物对DNA具有显著的选择结合特性,QDs与RU在水溶液中反应,导致QDs荧光淬灭。该传感器的检测机理是:多吡啶钌配合物阳离子吸附在带负电的量子点表面,吸附后的RU与QDs之间存在存在着光诱导电子转移(PET),从而抑制了QDs产生荧光。实验中,Ru(bpy)2dppz2+既作为荧光淬灭基团,又作为DNA的报告基团,如图8所示,带正电的多吡啶钌配合物和带负电荷的水溶性CdTe量子点在水溶液中通过静电吸附结合形成离子共轭物,这种静态结合导致量子点荧光强度降低。随后加入富C的单链DNA,由于钌配合物与DNA有更强的结合能力,所以RU从量子点表面脱离,量子点的荧光恢复。当有银离子出现时,形成C-Ag+-C配合物,诱导C-ssDNA折叠成发夹结构,这影响了RU与C-ssDNA结合,导致QDs荧光强度骤降。该平台提供了一种简单、灵敏、选择性的方法检测水溶液中的银离子,检出限为0.1 μM。

图8 基于量子点的适配体非标记荧光技术检测银离子
碳纳米管因其独特的光电性能和优良的生物相容性,在生物传感领域得到了较快的发展。He等[44]利用BPA适配体和Mo2C纳米管开发了一种简便、快速的方法检测双酚A(BPA)。Mo2C纳米管是一种新型过渡金属碳化物,相较于其他纳米材料,二维超薄纳米片含有更多的活性位点。实验中,当没有BPA时,适配体与Help-DNA杂交后,在BPA适配体的富G分支GGGT和Help-DNA上5端的富G序列(TGGGTGGG TGGGT)之间形成G4。G4结构富含鸟嘌呤(G),G4能够与小分子染料NMM结合,增强荧光信号;相反,BPA与适配体反应且适配体发生构象转换,阻碍了G4的形成,导致荧光淬灭。同时,Mo2C纳米管能够吸收Help-DNA从而减弱了富G序列(TGGGTGGG TGGGT)的背景信号。该方法检测BPA的检出限为2nM。在检测真实样本中,一系列浓度梯度的BPA溶液被实际的水样本稀释5倍,检测得到的荧光减弱比率相似于检测缓冲液中BPA的结果;更重要的是,该方法能从与BPA结构相似的其他分子中鉴别出BPA,具有较高的实际应用价值。

图9 基于适配体的碳纳米管技术检测双酚A
3 总结与展望
非标记荧光法避免了对核酸适配体进行修饰,大大降低了成本,且该方法检出限较低,使得非标记的适配体荧光检测技术发展迅速。此外,适配体与靶标间是特异性结合,大部分荧光染料通过嵌合或者静电作用与DNA或者RNA结合,使非标记荧光法在特异性和灵敏度方面均优于其他方法。由于合成阴阳离子聚合物的难度较大,而许多染料都是商业化的染料,易于得到,所以大部分的非标记荧光法是利用染料作为信号报告基团,较少使用阴阳离子聚合物。但从总体上看,该方法存在以下几个问题:(1)传统的SELEX技术操作繁琐、筛选周期长;(2)针对的靶标单一,限制了该方法在实际样品检测中的应用。
基于此,对SELEX技术进行优化能够促进和缩短整个筛选过程,此外,在微流控芯片、纳米技术、新的测序方法等相关领域的快速发展[45],有助于构建一系列新的SELEX技术,从而可以筛选获得特异性、稳定性更强的核酸适配体。通过运用纳米颗粒和多种DNA扩增技术与传统的适配体-染料非标记荧光技术相结合,可以消除背景信号的干扰,增强荧光强度变化的信号,从而达优化检测结果的目的,这是适配体非标记荧光技术今后发展的一个趋势;此外,SELEX新技术的应用和荧光染料的发展不断优化非标记荧光技术,促使其朝着更高效、更简便、低成本的趋势发展。
