Chk1和Chk2高表达人胃癌BGC823细胞的建立与鉴定
2018-10-13,,,,,,*
, , , , , , *
(1. 南华大学肿瘤研究所,湖南省肿瘤细胞与分子病理学重点实验室,湖南 衡阳 421001;2. 山东省邹平县人民医院肿瘤科)
胃癌是全球最常见的恶性肿瘤之一,在我国每年发生率与死亡率分别为15.82%与17.70%,仅次于肺癌而位于第二,手术仍然是胃癌的唯一治疗方法,而辅助化疗与放疗可以改善切除后的胃癌的预后[1-3]。破坏DNA的化疗和放疗可激活细胞检查点功能,这些检查点容易使DNA修复和促进未修复细胞死亡。大部分肿瘤抑癌基因与癌基因突变损伤细胞检查点,而G1/S和G2/M期检查点失活在细胞癌变过程中起着至关重要的作用。目前,已经研发许多特异性抑制G2/M检查点的化合物已成为肿瘤治疗的新策略,其靶点是Chk1[4-6]。
本实验室已经证明,二烯丙基二硫(diallyl disulfide,DADS)可抑制人胃癌细胞增殖和阻滞G2/M,与激活p38、抑制ERK/AP-1,上调组蛋白乙酰化、p21 WAF1等有关[7-9]。沉默Chk1可废除胃癌BGC823细胞G2/M阻滞[10]。本研究建立稳定高表达Chk1/2的BGC823细胞,为进一步研究Chk1/2功能奠定实验基础。
1 材料与方法
1.1材料人胃癌细胞株BGC823购自中国科学院上海细胞研究所。大肠杆菌 E. coli DH5α、真核表达质粒pcDNA3.1由本实验室保存。RNA提取试剂盒购自Omega公司;反转录cDNA第一链合成试剂盒购自Promega公司;Taq Plus PCR Mastermix购自北京天根公司;BamHI和HindIII限制性内切酶购自深圳晶美公司;质粒小量抽提纯化试剂盒和胶回收试剂盒购自江苏碧云天公司;T4 DNA连接酶购自上海生工;Lipofectamine 2000脂质体、G418、PRIM1640均购自Invitrogen公司;BCA蛋白定量试剂盒为Pierce公司产品;ECL发光剂LumiGLO Reagant为Cell Signaling Technology产品;Chk1与Chk2兔多克隆抗体购自Santa Cruz公司。
1.2引物合成Chk1与Chk2克隆引物分别由上海生工公司合成,根据GenBank中公布的人Chk1与Chk2 cDNA序列合成引物:Chk1:F5′-CGGAAGC TT ATGGCAGTGCCCTTTG-3′;R5′-CGGCGAAT TCTCATGTGGCAGGA-3′;Chk2:F5′-CGCCAGCTTATGTCTCGGGAG TC-3′;R5′-CGGAAT TCTCACAACACAGCAGCACAC-3′。引物5′端引入EcoRI酶切位点GAATTC,3′端引入HindIII酶切位点AAGCTT。
1.3总RNA的提取按照Omega公司RNA提取试剂盒说明书进行。
1.4 PCR扩增根据Promega公司cDNA第一链合成试剂盒说明书,以提取的总RNA为模板在特异克隆引物下采用高保真DNA聚合酶扩增Chk1与Chk2全长cDNA片段。PCR扩增条件:Chk1:第一链cDNA产物2 μL,特异引物各1 μL,Taq Plus Mastermix 10 μL;反应条件为:95 ℃预变性5 min,95 ℃变性30 s,58 ℃退火30 s,72 ℃延伸1 min 40 s,扩增29个循环。Chk2:第一链cDNA产物2 μL,特异引物各0.8 μL,Taq Plus Mastermix10 μL;反应条件为:95 ℃预变性5 min,95 ℃变性30 s,60 ℃退火30 s,72 ℃延伸1 min 50 s,扩增30个循环。
1.5构建真核表达载体将扩增的Chk1和Chk2 PCR产物和pcDNA3.1均用EcoR I和Hind III 双酶切,并用琼脂糖凝胶电泳回收纯化。将目的片断与载体用T4 DNA连接酶进行连接,构建成重组真核表达载体pcDNA 3.1/Chk1与pcDNA3.1/Chk2。重组载体用EcoR I和Hind III酶切鉴定和菌液PCR鉴定正确后,由上海生工进行测序鉴定,鉴定后大量扩增重组质粒pcDNA 3.1/Chk1与pcDNA3.1/Chk2。
1.6细胞转染于转染前24 h按0.5×105cells/well将BGC823细胞接种于24孔板中,待细胞至90%~95%汇片。稀释0.8 μg质粒DNA于无血清Opti-MEM培养液中,总体积50 μL,轻轻混匀。混匀LipofectamineTM2000,取2 μL于无血清Opti-MEM培养液中至总体积50 μL混匀,室温孵育5 min。混合质粒和LipofectamineTM2000,轻轻混匀,孵育205 min。将100 μL复合物加入24孔板,混匀。细胞于37 ℃、5%的CO2培养箱内孵育5 h后换成10%小牛血清PRMI 1640完全培养基。24 h后细胞以1∶10比例传代,48 h后加400 μg/mL G418筛选阳性细胞,3天换一次筛选培养液,培养2 周,可见阳性细胞克隆。挑取单克隆细胞,培养后进行鉴定。
1.7 RT-PCR检测分别提取转染pcDNA 3.1/Chk1、pcDNA3.1/Chk2与pcDNA 3.1质粒的BGC823细胞和BGC823细胞总RNA,进行RT-PCR,具体反应体系和条件同上,琼脂糖凝胶电泳观察结果。
1.8 Western Blot检测收集转染pcDNA 3.1/Chk1、pcDNA3.1/Chk2与pcDNA 3.1 质粒的BGC823细胞,冰PBS洗2次,以1×106个细胞浓度加入细胞裂解液75 μL,冰上裂解20 min,采用BCA蛋白定量测定法检测蛋白浓度,每一样品取20 μg,以5∶1倍的体积与5×SDS加样缓冲液混合,100 ℃加热5 min,样品经10%SDS-PAGE胶电泳分离,然后转至硝酸纤维素膜上,5%的脱脂牛奶室温封闭3 h,TBST洗膜3次,一抗4 ℃孵育过夜,TBST洗膜3次,加入1∶2 000二抗室温孵育30~60 min,ECL发光显影,扫描仪测定印迹区带的光密度值。
1.9流式细胞仪测定收集转染pcDNA 3.1/Chk1、pcDNA3.1/Chk2与pcDNA 3.1的BGC823细胞于50 mL培养瓶中,1 000 r/min离心5 min,弃去培养液,5 mL PBS洗2次,离心,去PBS,加入70%乙醇固定24 h,流式细胞仪分析DNA含量,检测群体细胞中G1、S、G2/M期细胞百分率。
1.10统计学处理结果采用SPSS12.0统计软件包进行数据处理,数据比较采用t检验,率的比较采用χ2检验,P<0.05为差异有显著性。
2 结 果
2.1真核表达载体pcDNA3.1/Chk1与pcDNA3.1/Chk2的构建提取约5×106人胃癌BGC823细胞的总RNA,图1-A清晰可见28S和18S两条,可用于下一步实验。以cDNA为模板,PCR扩增,1%琼脂糖电泳鉴定结果显示,已分别扩增分子量为1400 bp和1600 bp左右的PCR产物带,与测序推测值1431 bp和1632 bp相符(图1-B)。对可能有Chk1和Chk2插入质粒的DH5α受体菌行PCR扩增,电泳可见约1.4 kb和1.6 kb两条带,与预计大小一致。Chk1有3个阳性菌落,Chk2有8个阳性菌落(图1-C)。取菌落PCR鉴定为阳性的克隆转化菌,提取重组质粒pcDNA3.1/Chk1与pcDNA3.1/Chk2,用BamHI、HindIII双酶切,分别得到约6900 bp与1400 bp、6900 bp与1600 bp的两条带,结果与序列推测值一致(图1-D)。序列经NCBI Blast分析,Chk1序列同源性为100%,编码氨基酸同源性为100%;Chk2序列同源性为99%,编码氨基酸同源性为100%(图1-E)。
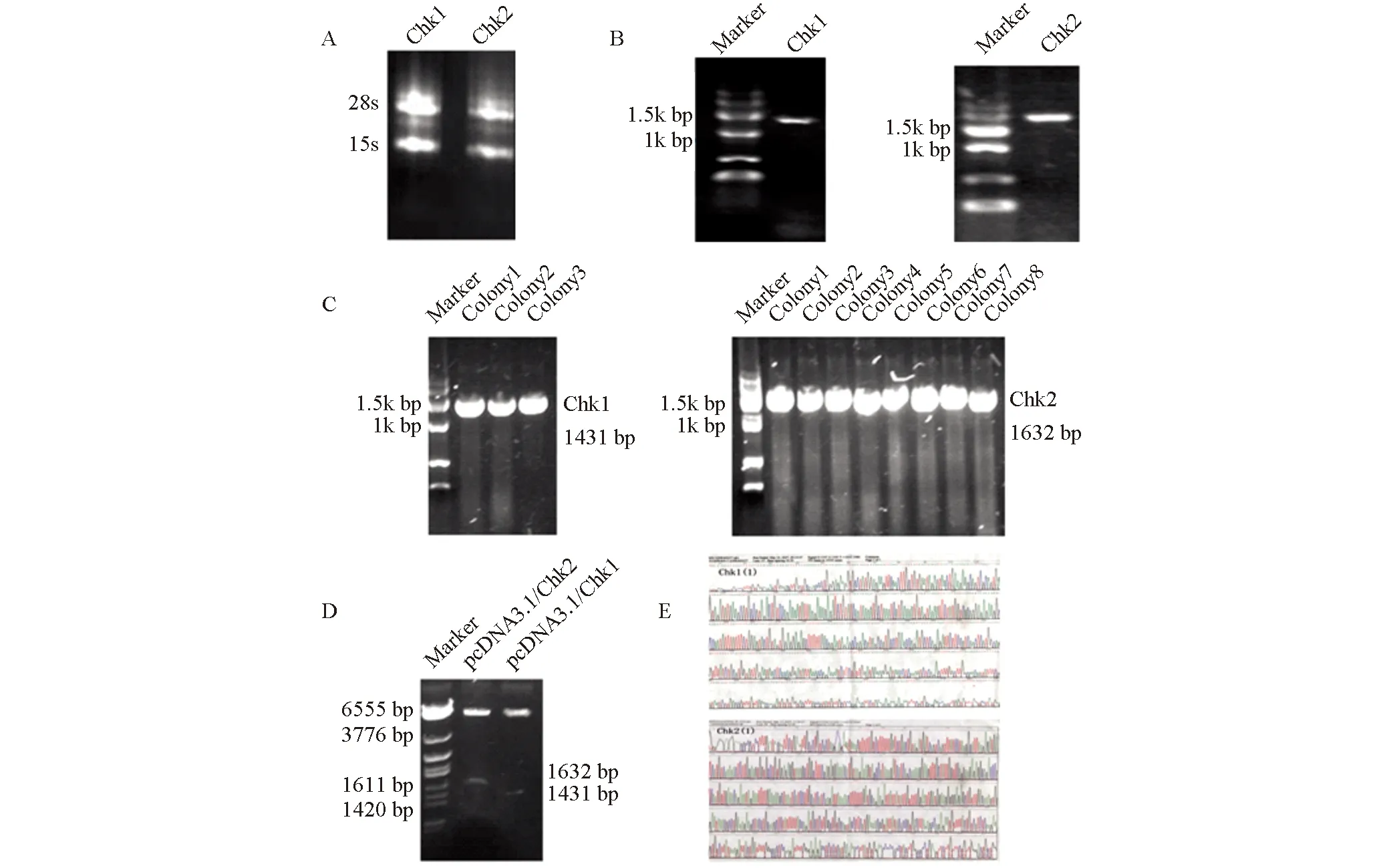
图1 真核表达载体pcDNA3.1/Chk1与pcDNA3.1/Chk2的构建A:人胃癌BGC823细胞总RNA电泳图谱;B:pcDNA3.1/Chk1与pcDNA3.1/Chk2 RCR扩增;C:转染pcDNA3.1/Chk1与pcDNA3.1/Chk2阳性克隆菌落;D:重组质粒双酶切鉴定;E:重组质粒测序结果.
2.2建立高表达Chk1/2基因人胃癌BGC823细胞
2.2.1 BGC823细胞的稳定转染 分别将空载体pcDNA3.1、pcDNA3.1/chk1与pcDNA3.1/chk2转染BGC823细胞,经400 μg/ml G418筛选2周后获得阳性克隆(图2-A),随机挑取阳性克隆作进一步鉴定。
2.2.2 Chk1和Chk2基因在BGC823细胞中的表达 提取BGC823细胞和转染细胞总RNA,1.0%琼脂糖凝胶电泳显示,28S和18S条带非常浓而亮(图2-B)。RT-PCR与Western Blot显示,空载体组Chk1和Chk2 mRNA与蛋白表达水平较对照组差异无显著性(P>0.05),而转Chk1组和转Chk2组Chk1和Chk2 mRNA与蛋白表达分别较对照组与空载体组明显增加(P<0.05)(图2-C,图2-D)。表明转染成功。
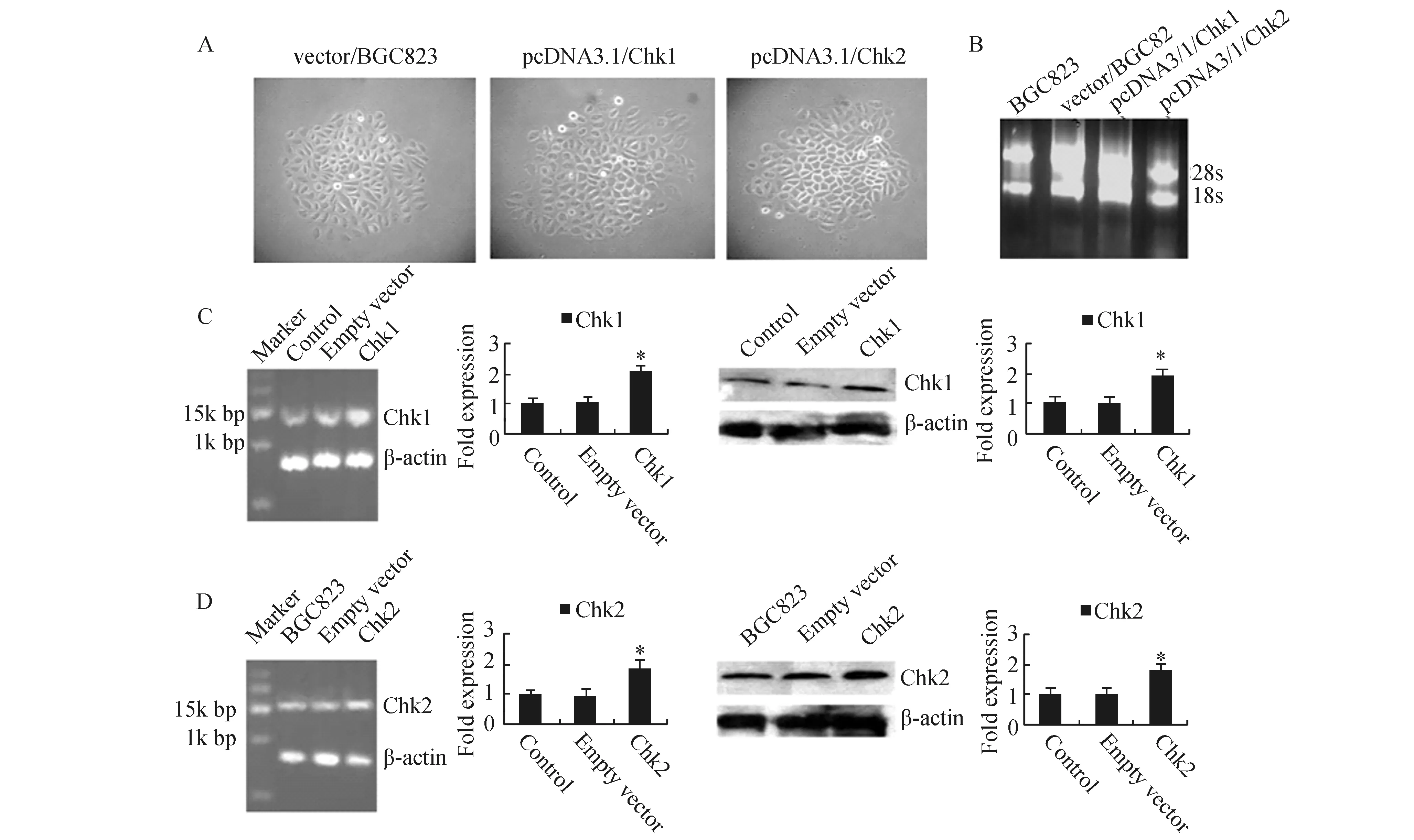
图2 建立高表达Chk1/2基因人胃癌BGC823细胞A:G418筛选2周后阳性克隆(40×);B:BGC823细胞和转染细胞总RNA电泳图谱;C:Chk1转染细胞mRNA和蛋白表达;D:Chk2转染细胞mRNA和蛋白表达.
2.2.3 流式细胞术检测Chk1和Chk2高表达对BGC823细胞周期的影响 流式细胞术检测显示,Chk1 转染组G2/M 细胞32.40%较对照组14.27%与空载体组14.97%明显增加 (P<0.05)(表1),而Chk2转染组G2/M细胞19.37%较对照组14.17%与空载体组17.63%无明显差异 (P>0.05)(表2)。表明调控BGC823细胞G2/M转换可能主要是Chk1。

表1 Chk1高表达对BGC823细胞周期的影响(%)
与空载体组和BGC823组比较,aP<0.05

表2 Chk2高表达对BGC823细胞周期的影响(%)
3 讨 论
DNA损伤信号的完整功能对保持基因组完整性和预防肿瘤发展至关重要。在对DNA损伤的反应(DDR)中,检查点可以被激活以阻止细胞周期的进展,直到损伤修复。在DNA损伤信号网络中,监视这些基因组途径的中心是Chk1。它能促进细胞周期阻滞与DNA损害修复,调节转录和诱导细胞凋亡。Chk1直接磷酸化CDC25磷酸酶、P53、RAD51、FANCE和E2F等多个底物,调节其活性、稳定性或亚细胞定位。Chk1的特征底物有助于细胞周期的阻滞和DNA修复,以应对DNA损伤[5-6]。
目前主要使用的抗癌疗法,要么直接破坏DNA,要么破坏细胞分裂。这些攻击会触发细胞周期检查点的激活,保护细胞实现正确完成细胞周期阶段的机制,修复损伤,或最终在无法修复的情况下自杀[11]。Chk1是在DDR过程中细胞周期检查点的保守的蛋白激酶,激活对DDR或停止复制的蛋白激酶ATR是Chk1的唯一调控因子。Chk1的时空调节在DDR与正常细胞周期进程中很重要。Chk1通过基因毒性应激来调节细胞周期检查点,防止DNA损伤细胞进入有丝分裂,并协调DNA修复的各个方面[12]。近年来,运用细胞周期检查点作为肿瘤治疗的靶点,已经成为研究的热点,许多针对Chk1的强力抑制剂已经发展成为抗癌药物,其中一些抑制剂正在临床试验中[11-13]。
研究表明,pectenotoxin-2可通过增加ATM和Chk1/2磷酸化介导cdc25C磷酸化,下调cyclin B1与cdc2表达,明显抑制乳腺癌细胞增殖和阻滞G2/M[14]。小分子Chk1抑制剂LY2603618可增加DNA 损伤介导Chk1 磷酸化,阻滞肺癌细胞于G2/M[15]。NSC746364通过激活ATR/Chk1通路、下调cyclin B1和激活caspase-3诱导人肺癌细胞G2/M期阻滞与凋亡[16]。近年来,发现不少中药提取物可上调或活化Chk1诱导G2/M阻滞,如gossypin可活化Chk1磷酸化Cdc25C诱导恶性胶质瘤U251细胞G2/M阻滞[17]。斑蝥素上调Chk1引起结直肠癌colo 205细胞G2/M阻滞[18]。鬼臼素的系列轭合物可激活肿瘤细胞ATM与Chk1,导致有效的DNA损害[19]。Scoulerine通过增加Chk1、Chk2和H3磷酸化诱导肿瘤细胞G2/M期阻滞与抑制增殖[20]。
我们已经证实,DADS可通过磷酸化ATR,激活Chkl与下调CDC25C和cyclin B1,阻滞胃癌MGC803细胞于G2/M[21]。沉默Chkl可消除DADS诱导BGC823细胞G2/M期阻滞,但沉默Chk2作用不明显[6]。然而,阐明DADS阻滞人胃癌细胞G2/M阻滞的作用靶点是Chkl或Chk2,必须建立高表达Chkl/Chk2胃癌细胞。本研究采用基因重组技术构建真核表达载体pcDNA3.1/Chk1与pcDNA3.1/Chk2,并转染BGC823细胞,成功建立高表达Chkl/Chk2胃癌BGC823细胞,并且,Chk1高表达,而不是Chk2,可阻滞BGC823细胞于G2/M。但是,确定DADS阻滞人胃癌细胞G2/M阻滞的靶点是Chkl尚待进一步研究。
