牦牛不同发育阶段睾丸中KDM2A的表达
2018-10-12熊显荣杨显英阿果约达
王 艳,熊显荣,韩 杰,王 斌,杨显英,阿果约达,李 键
(西南民族大学 生命科学与技术学院,成都 610041)
牦牛(Bosgrunniens)是分布在中国青藏高原及毗邻高寒牧区的特有牛种资源。因其能适应高原生态环境并提供优质畜产品,已成为当地群众主要的经济来源之一[1]。受环境及自身因素影响,牦牛自然繁殖能力仅为30%~40%,严重制约牦牛的生产效率。提高牦牛繁殖性能是提高牦牛生产效率的关键,但公牦牛的体成熟和性成熟均较晚,严重阻遏牦牛产业的发展[2]。睾丸是激素分泌和精子产生的主要器官,睾丸的发育与精子的质量对雄性牦牛的繁殖性能有显著影响。因此,研究睾丸发育与精子生成对提高高原地区牦牛业的发展有重要意义。
从胎儿到性成熟,睾丸一直处于发育状态,精子发生是睾丸中进行的一种特殊细胞分化过程,两者都受到多种调节因素影响,并在复杂的分子机制控制下完成,其中表观遗传协调基因表达是重要的调控机制,组蛋白甲基化转移酶和去甲基化酶在时空上平衡甲基化状态是重要的表观修饰,正确的组蛋白修饰对睾丸发育及精子持续生成至关重要。前期研究发现,敲除组蛋白去甲基化酶FBXL10上JmjC结构域后成年小鼠的生精小管退化、附睾中精子减少,证实组蛋白去甲基化在睾丸发育和精子生成中发挥重要作用[3]。
组蛋白赖氨酸去甲基化酶2A(KDM2A)是由1 162个氨基酸构成的蛋白质,其N末端上存在负责去甲基化酶活性的JmjC结构域,该结构域特异性地作用于组蛋白H3的36位赖氨酸位点,进行去甲基化修饰[4]。该蛋白上还存在2个锌指,一个是与DNA结合的CXXC型,另一个是PHD型。C端有F-box和涉及蛋白质—蛋白质相互作用的LRR功能域[5-6]。KDM2A通过组蛋白去甲基化修饰调节细胞周期因子,对细胞增殖、分化、凋亡和肿瘤形成起调控作用[7-8]。作为致癌基因,近年来对KDM2A的研究主要集中于胃癌[9]、乳腺癌[10-11]、肺肿瘤[12]等疾病的发生机制。研究发现小鼠胚胎缺失KDM2A导致E10.5~E12.5胚胎致死,表明KDM2A蛋白在小鼠胚胎各器官的增殖、分化过程中发挥重要作用[13]。该蛋白在雄性生殖中的作用尚未见报道,因此,本研究首次以牦牛睾丸为研究对象,通过实时荧光定量PCR和免疫组化技术,研究KDM2A在牦牛睾丸组织中的时空表达模式,为进一步研究 KDM2A基因在雄性牦牛生殖生理过程中的作用奠定基础,为阐明牦牛睾丸发育及精子生成的分子机制提供借鉴,同时为提高雄性牦牛的繁殖性能提供理论依据。
1 材料与方法
1.1 试剂及仪器
试剂:PrimeScriptTMRT Reagent Kit反转录试剂盒、SYBR○RPremix ExTaqTMⅡ试剂盒均购于TaKaRa公司,Trizal试剂购于Invitrogen公司。仪器:离心机、荧光定量PCR仪购于美国Bio-red公司,核酸浓度测定仪购于日本岛津,引物由成都擎科梓熙生物技术有限公司合成。
1.2 样本采集
样本来源于四川省成都市青白江区向阳镇屠宰场。屠宰后立即无菌采集牦牛胎儿(5~6月龄)、幼年时期(1~2岁)、性成熟时期(3~4岁)的睾丸组织,剥离白膜后取部分组织样本放入已编号的冻存管,迅速投入液氮保存。另一部分放入4 g/100 mL福尔马林中固定。
1.3 总RNA的提取及反转录
睾丸组织液氮研磨后,严格按照Trizol说明书的步骤提取组织总RNA。DEPC水处理后核酸浓度测定仪检测总RNA的质量浓度及纯度。选择A260nm~A280nm为1.8~2.0的RNA样本按照反转录试剂盒Prime ScriptTMRT Reagent Kit说明书,以Oligo(dT)为引物反转录合成cDNA产物,-20 ℃保存。
1.4 引物的设计与合成
参考NCBI数据库中瘤牛(Bosindicus) KDM2A(GenBank登录号:XM_019954720.1)及GAPDH(GenBank登录号:AC_00162.1)基因mRNA序列,Primer Premier 5.0软件设计PCR引物后由成都擎科梓熙生物技术有限公司合成,详见表1。

表1 KDM2A基因和内参基因引物序列Table 1 The Primers of KDM2A and GAPDH gene
1.5 实时荧光定量PCR
利用SYBR○RPremix ExTaqTMⅡ试剂盒进行荧光定量PCR,反应体系15 μL:酶7.5 μL,上、下游引物(10 μmol/L)各0.5 μL,模板1 μL,ddH2O 5.5 μL。扩增条件:95 ℃ 3 min;95 ℃ 10 s,60 ℃ 30 s,循环40次,每个样本3个重复。
1.6 免疫组织化学检测
利用免疫组化法检测 KDM2A的分布。将福尔马林固定液中睾丸组织取出,经酒精梯度脱水、二甲苯脱脂、浸蜡、包埋制成石蜡切片。切片脱水后在8.82×102mmol/L H2O2液中封闭,0.01 mol/L PBS洗涤液清洗3次,φ=0.05%的胎牛血清封闭,滴加一抗兔抗 KDM2A 抗体,4 ℃孵育过夜,PBS洗涤后滴加生物素标记的二抗,37 ℃孵育2 h,PBS洗涤后加入DAB显色液,孵育3 min,经过苏木精复染后,脱水、透明、封片。免疫组织化学染色后显微镜观察,判定棕黄色为阳性。
1.7 数据统计分析
利用2-△△Ct法计算相对表达量,使用SPSS 19对定量结果进行分析。以胎牛Ct值为参照,对不同发育阶段进行差异定量分析。P<0.01表示差异极显著,P<0.05表示差异显著。
2 结果与分析
2.1 RT-PCR检测
通过RT-PCR扩增、琼脂糖凝胶电泳检测后,在250 bp左右获得单一清晰条带,与预期目的基因 KDM2A片段大小一致,证明引物特异性良好(图1)。
2.2 KDM2A基因的时序表达谱
由图2可知, KDM2A基因在牦牛睾丸组织中的表达量随年龄的增长呈上升趋势。实时荧光定量PCR结果表明(图3),以GAPDH为参照,幼年时期是胎儿时期的2.5倍(P<0.01);性成熟期是胎儿时期的5倍(P<0.01),幼年时期的2倍(P<0.01)。
2.3不同发育阶段牦牛睾丸中KDM2A的定位
免疫组化检测 KDM2A在睾丸中的定位结果见图4, KDM2A在3个发育时期睾丸各级生精细胞和支持细胞中均有表达,但表达水平存在差异。在胎牛睾丸中(图4-A),精原干细胞与支持细胞均呈阳性。随着睾丸发育,到幼年时期,KDM2A蛋白的分布更为广泛(图4-B,4-C),精原细胞、支持细胞、初级精母细胞、圆形精子及精子形成期均有表达,精原细胞表达水平最高(着色最深),支持细胞与初级精母细胞次之(着色较深),精子形成期较低(着色较浅),圆形精子最低(着色最浅),到性成熟时期(图4-D),随着睾丸生精上皮明显增厚,性成熟后圆形精子与精子形成期较幼年时期明显增高。

M. DNA marker DL2000; 1. KDM2A; 2. 空白对照 Blank control
图1牦牛睾丸组织中KDM2A基因的RT-PCR结果
Fig.1RT-PCRamplificationofKDM2Agenefromyaktesticle
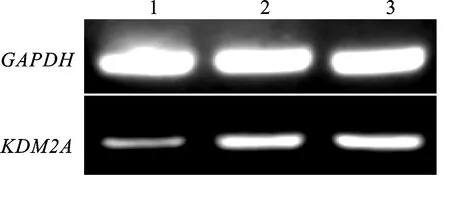
1~3依次为胎儿时期、幼年时期、性成熟时期牦牛睾丸组织 Represents the testicle of fetal, juvenile periods, sexual maturation periods of yak, respectively
图2RT-PCR检测不同发育阶段牦牛
睾丸KDM2AmRNA表达
Fig.2ExpressionofKDM2AmRNAinyaktesticleatdifferentgrowthstagesbythemeansofRT-PCR
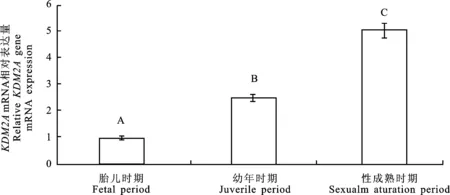
不同大写字母表示差异极显著(P<0.01) Different capital letter mean extreme significant difference(P<0.01)
3 讨 论
在雄性动物睾丸发育及精子生成过程中组蛋白修饰起重要作用,研究表明KDM2亚家族基因敲除或敲除特定功能结构域会导致小鼠胚胎致死或精子减少、生精小管退化[3,13]。作为该家族的重要成员, KDM2A能够对H3K36me1/2/3和H3K4me3去甲基化[14],同时作为转录抑制因子, KDM2A可以调节细胞的增殖、分化及衰老。因此,研究 KDM2A基因为进一步了解牦牛睾丸发育及精子生成奠定基础。
本研究通过实时荧光定量PCR检测牦牛睾丸中 KDM2A基因的时序表达谱,结果显示其在3个发育阶段均表达,且随着年龄增长表达量增加。2016年Ozawa 等[3]检测小鼠性成熟前睾丸中 KDM2A mRNA的表达,结果与本试验不同,小鼠睾丸中 KDM2A基因的表达在21日龄前呈递增趋势,21日龄表达量达到峰值,直至性成熟后无显著变化。由此表明小鼠及牦牛睾丸中存在 KDM2A 基因的表达差异,原因可能是 KDM2A在不同物种中的作用不同。小鼠与牦牛睾丸中 KDM2B mRNA的表达均随年龄增长表达量增高,但小鼠出生后,前10 d睾丸中 KDM2B的表达量增长缓慢,第10天出现激增并持续至性成熟,牦牛 KDM2A mRNA的表达量增长相对平缓,由此推测 KDM2A与 KDM2B通过不同方式参与调节睾丸的生理活动。
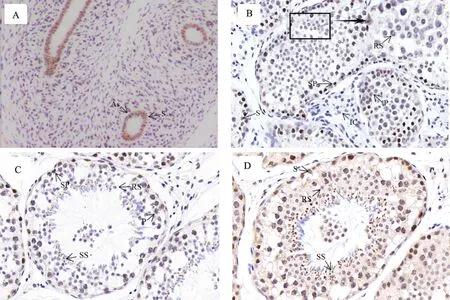
A:胎儿时期牦牛睾丸(200×) Fetal yak testicle(200×); B~C:幼年时期牦牛睾丸(40×) Juvenile yak testicle(40×); D:性成熟时期牦牛睾丸(40×) Yak testicle during sexual maturity(40×); As:精原干细胞 Spermatogonial stem cells; S:支持细胞 Sertoli cells; SP:精原细胞 Spermatogonium; P:初级精母细胞 Primary spermatocyte; RS:圆形精子 Round spermatid; IC:间质细胞 Leydig cells; SS:精子形成期 Spermiogenesis
图4不同发育阶段牦牛睾丸免疫组化KDM2A蛋白
Fig.4ImmunohistochemistryofKDM2Aproteininyaktesticleatdifferentgrowthstages
免疫组化结果表明 KDM2A在精原干细胞及支持细胞均呈阳性。朱俊峰[15]研究幼龄牦牛(3月龄)睾丸中的细胞形态,认为生精小管中仅存在精原细胞和少量支持细胞,表明牦牛胎儿时期睾丸的变化主要是以生精小管发育为主,且主要与精原干细胞和支持细胞增殖相关。睾丸中由精原干细胞分化而来的各级生精细胞与支持细胞在精子发生过程中起重要作用[16]。说明胎牛时期生精小管的发育为后续精子持续发生奠定基础。笔者推测,胎牛时期 KDM2A主要在精原干细胞及支持细胞的增殖过程中起重要作用。已证实 KDM2A可以特异性地将DUSP3的近端启动子和5′端的H3K36me2去甲基化;同时作为转录抑制因子, KDM2A介导DUSP3的转录抑制,两者偶联遏制DUSP3的活性[12]。作为ERK1/2抑制蛋白,DUSP3通过抑制ERK1/2活性影响Ras/ERK1/2信号通路,该信号通路在精原细胞自我更新及诱导减数分裂中发挥重要作用[17-18]。1997年Cadigan等[19]发现Wnt/β-catenin信号通路对睾丸支持细胞的增殖分化起促进作用,其中β-catenin的活性直接影响Wnt信号通路[20-21],研究证实细胞核中的 KDM2A可以通过调控β-catenin的降解进而防止Wnt信号过度活化[22]。因此推测 KDM2A通过介导ERK1/2和Wnt/β-catenin信号通路活性调节精原干细胞与支持细胞的增殖分化。
精子发生是复杂而有规律的细胞分化过程,这一过程必然经历精原细胞有丝分裂和精母细胞减数分裂。本研究结果显示,幼年及性成熟牦牛睾丸中精原细胞、初级精母细胞及圆形精子中均表达 KDM2A,说明 KDM2A参与调控精原细胞的增殖与精母细胞的分化。 KDM2A调节维持着丝粒异染色质状态的异染色质蛋白1(HP1)的功能,进而介导着丝粒异染色质的状态,该异染色质区能够吸引连接因子,从而确保染色体正确分裂[23-24],同时基于对 KDM2A表观修饰学的研究发现,该蛋白的JmjC结构域能抑制着丝粒卫星DNA的转录,后者转录产物的累积会造成染色体分离和着丝粒功能所需的着丝粒相关蛋白的错误定位[25-26]。由此推测 KDM2A通过调节着丝粒的状态介导精原细胞增殖和精母细胞分化,减少细胞分裂过程中染色体的错误分离,进而确保精子质量。
KDM2A在精子形成期表达,成熟精子中不表达,表明在精子形成期该蛋白发挥一定作用。在精子形成期,精子细胞的形态发生变化,核染色质变形浓缩,向一侧偏移形成精子头部,核体积变小的主要原因是染色质中的核蛋白由组蛋白转变为鱼精蛋白,染色质重新包装形成精子核[27-28]。研究表明组蛋白H2A在核染色质浓缩变形过程中发挥作用,其通过泛素化使核小体去稳定,进而促进组蛋白向鱼精蛋白转变的过程[29]。通过小鼠胚胎 KDM2A敲除试验发现敲除 KDM2A后H2A泛素化水平明显降低[7]。由此推测 KDM2A通过调节H2A泛素化水平参与精子的形成。
4 结 论
本试验通过RT-qPCR及免疫组化法检测不同发育阶段牦牛睾丸组织中 KDM2A的时空表达,发现不同阶段睾丸中存在表达差异,表明 KDM2A参与调节生精细胞的增长、分化,介导支持细胞的增殖过程。本研究为进一步研究 KDM2A在牦牛生殖生理中的作用机制奠定基础,为揭示牦牛睾丸发育和精子发生的分子机制提供依据。
