酵母双杂交筛选与小鼠维生素D受体互作的蛋白
2018-10-12路宏朝杜伟立杨理凯
张 涛,白 皓,王 令,路宏朝,杜伟立,刘 欢,杨理凯
(陕西理工大学 生物科学与工程学院,陕西汉中 723001)
维生素D受体(Vitamin D receptor, VDR)是一种核转录因子,属于类固醇激素/甲状腺激素受体超家族成员。VDR广泛分布于各种组织细胞,包括肾脏、骨骼、肠道等维生素D靶器官,以及泌尿生殖系统(乳腺、前列腺、卵巢、子宫等),血液淋巴系统(T淋巴细胞、B淋巴细胞、巨噬细胞、单核细胞等),神经系统及甲状旁腺等[1-2]。维生素D在体内主要活性代谢产物是1,25-二羟胆骨化醇(1,25- dihydroxyc-holecalciferol, 1,25-(OH)2D3),其生物活性主要是通过VDR介导[3],在靶细胞中,1,25二羟维生素D(1,25D)与VDR形成激素受体复合物,结合在靶基因启动子区的维生素D受体应答元件(VDRE)调节其表达,最终通过靶基因影响体内血钙和磷酸盐平衡、肾小管钙的重吸收及骨骼中钙的再吸收等[4-5]。近期研究表明,除了VDR调节钙和矿物质平衡以外,VDR还可以通过调控AKT、Wnt/β-Catenin等关键信号通路抑制细胞增殖,刺激细胞成熟等其他方面作用,涉及多种组织(皮肤、结肠、免疫系统、前列腺和乳房等)[4-6]。此外,VDR缺乏可能会增加患心血管疾病、炎症、糖尿病、干扰毛囊循环及生殖类疾病的风险[7-8]。最新临床研究证实,在小鼠睾丸组织中1,25-(OH)2D3与VDR作用调控精原细胞及精子钙离子转运、盐离子平衡,进而影响精子形成及精子活力,同时VDR在睾丸与附睾内调控芳香化酶(雌激素生成关键酶)的表达,影响雌二醇浓度、精液浓度、精子活力等[9]。本研究基于酵母双杂交技术从小鼠cDNA文库中筛选与VDR互作的蛋白因子,检测相互作用能力,并分析候选蛋白是否与生殖功能相关,为进一步探索VDR调控雄性小鼠生殖能力的分子机制研究提供理论依据。
1 材料与方法
1.1 材 料
酿酒酵母菌株AH109、PGBKT7质粒、EscherichiacoliTop10(E.coliTop10)由陕西理工大学生物科学与工程学院分子遗传学实验室保存;含酵母小鼠胚胎cDNA文库,RNA提取试剂盒,核酸内切酶EcoRⅠ、BamHⅠ和Hind Ⅲ等酶购自大连宝生物工程公司;一抗为兔抗小鼠VDR单克隆抗体,以辣根过氧化物酶标记的羊抗兔IgG为二抗购自CST公司;ONPG、TaqDNA聚合酶、DNA marker DL2000、低分子质量标准蛋白购自Thermo Fisher公司;PVDF膜、质粒提取试剂盒、DNA纯化试剂盒购自BioFlux公司;基因序列测序、引物合成由北京奥科鼎盛生物有限公司完成。
1.2 方 法
1.2.1 引物设计与合成 根据GenBank公布的小鼠VDR基因序列(CT010294.1)设计上下游引物(表1):VDRY2H-F与VDRY2H-R扩增VDR全长基因;KoVDR-F和VDRY2H-R引物扩增删除特异性转录激活的调节功能区A/B片段的部分VDR基因,简称VDR-KoA/B;VDRY2H-F和KoVDR-R引物扩增删除VDR结构域AF-2的基因片段,简称VDR-KoAF2;KoVDR-F和KoVDR-R引物扩增的片段同时删除A/B和AF-2区域,简称VDR-KoA/B-AF2。
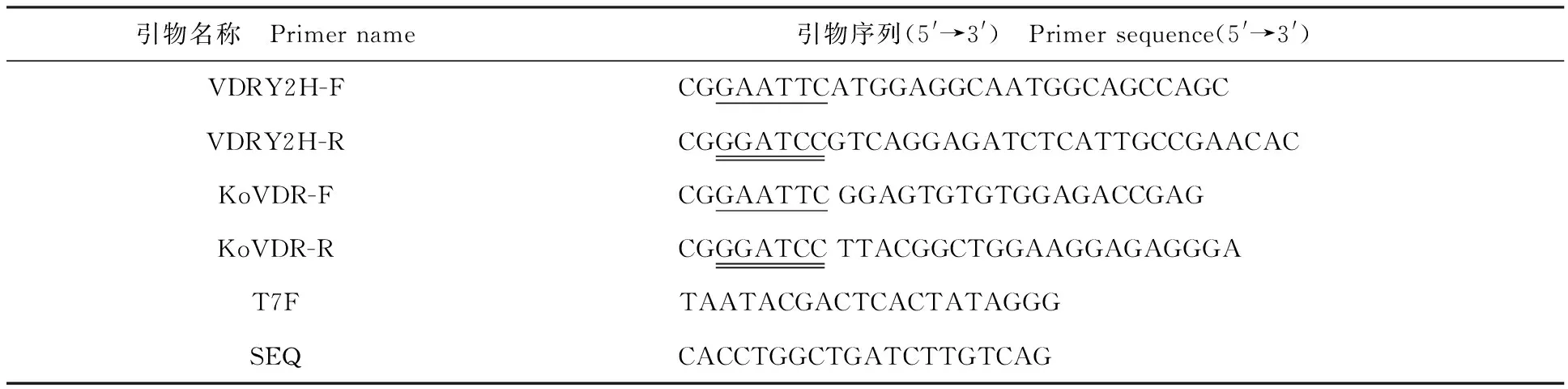
表1 引物信息Table 1 Primer information
注:单划线为EcoRⅠ,双划线为BamHⅠ.
Note:Single underline isEcoRⅠ,Double underline isBamHⅠ.
1.2.2 VDR诱饵表达载体的构建 通过TRIZOL方法提取小鼠小肠总RNA,反转录获得cDNA,以cDNA为模板,PCR扩增小鼠VDR基因片段。PCR扩增体系为50 μL:5 μLTaq酶缓冲液,6 μL Mg2+,5 μL dNTP,引物各2 μL,模板1 μL,Taq酶0.5 μL,水28.5 μL;PCR 反应程序:95 ℃预变性 5 min,95 ℃变性 30 s,60 ℃退火30 s,72 ℃延伸90 s,34个循环,72 ℃延伸10 min,12 ℃保存。检测并纯化PCR产物和骨架载体pGBKT7,分别用EcoRⅠ和BamHⅠ双酶切并纯化;在T4连接酶作用下,将VDR基因片段插入pGBKT7载体,将连接产物转化至E.coliTop10感受态细胞,再通过菌落PCR及测序鉴定构建的诱饵表达载体,并命名为pGBKT7-VDR、pGBKT7-VDR-KoA/B、pGBKT7-VDR-KoAF2和pGBKT7-VDR-KoA/B-AF2。
1.2.3 VDR表达及自激活检测 利用酵母一步转化法将VDR诱饵表达载体转化至酿酒酵母AH109,经缺色氨酸的营养缺陷型培养基(SD/+His/+Ade/+Leu/-Trp)筛选重组酵母菌株;挑取单克隆菌落于5 mL SD/+His/+Ade/+Leu/-Trp液体培养基,置于30 ℃恒温摇床200 r/min培养48 h。收集菌液,将重组菌株收集,通过液氮反复冻融破除酵母细胞壁和细胞膜,再加入终浓度为工作浓度的SDS-聚丙烯酰胺凝胶(SDS-PAGE)上样缓冲液中,充分打散,置于沸水浴10 min破碎细胞后冰浴,立即置于冰上,4 ℃、10 000 r/min、冷冻离心10 min。取蛋白上清液进行12% SDS-PAGE电泳,然后转至硝酸纤维膜,洗脱后用封闭液封闭,加入一抗,洗脱,加二抗,然后用ECL曝光试剂曝光鉴定VDR基因在酿酒酵母AH109是否成功表达。根据His与Ade作为酵母双杂交报告基因的AH109酵母菌自身特点,筛选VDR诱饵蛋白是否具有自激活现象,将重组酵母菌株分别置于SD/+His/+Ade/+Leu/-Trp液体培养基,30 ℃培养过夜,收集菌液,调整浓度至OD600=1.0,进行梯度稀释,然后分别点样在多种营养缺陷型培养基上,置于30 ℃培养箱,培养48 h,观察酵母生长状态检测自激活现象。
1.2.4 重组诱饵酵母与小鼠cDNA文库Y187酵母杂交 挑取没有自激活现象的重组酵母单克隆接种到2 mL SD/+His/+Ade/+Leu/-Trp液体培养基,置于30 ℃恒温摇床200 r/min培养48 h;取500 μL菌液接种量接种至50 mL SD/+His/+Ade/+Leu/-Trp液体培养基中,置于30 ℃恒温摇床200 r/min扩大培养,检测菌液OD600吸光值为0.5,收集菌液。将收集的菌液与含酵母小鼠胚胎cDNA文库的酵母一起加入到2×YEPD 液体培养基中,置于30 ℃恒温摇床30~50 r/min培养1~2 d进行酵母杂交。然后通过显微镜镜检酵母双杂交菌,目测至一定的杂交效率后将酵母菌分别涂布于SD/-Trp/-Leu/-Ade/-His固体培养基,并将菌液稀释至10-1、10-2、10-3、10-4涂布于SD/+His/+Ade/-Leu/-Trp固体培养基检测杂交效率,置于在30 ℃培养箱中培养5~7 d。统计酵母双杂交的杂交效率,挑取能够在SD/-Trp/-Leu/-Ade/-His固体培养基上生长的酵母单克隆菌株于5 mL营养缺陷型SD/-Trp/-Leu/-Ade/-His液体培养基,置于30 ℃恒温摇床200 r/min培养48 h。提取杂交后酵母单克隆菌株质粒转化至E.coliTop10感受态细胞中获得大量酵母杂交后的质粒。用HindⅢ单酶切、测序鉴定,经NCBI在线比对,从而获得可能与VDR相互作用的候选蛋白。
1.2.5 候选酵母菌株的β-半乳糖苷酶活性测定 通过ONPG的方法测定初筛克隆的β-半乳糖苷酶活性,以AH109菌株为阴性对照,酵母双杂交后的菌株为阳性酵母菌株[10]。首先克隆酵母双杂交菌株,挑取单克隆于2 mL SD/-Trp/-Leu/-Ade/-His液体培养基,置于30 ℃恒温摇床200 r/min培养,检测菌液OD600的吸光值为0.8~1.0收集菌液,再用ONPG缓冲液悬浮,反复冻融之后加入ONPG(4 mg/mL),置于37 ℃培养箱中进行反应计时,待出现黄色用1 mol/L Na2CO3终止反应,然后于常温10 000 r/min离心2 min,转移上清至96孔酶标板中,用酶标仪测定420 nm处吸光值OD420,β-半乳糖苷酶活性=1 000*OD420/(t*v*OD600)(t反应时间,v浓缩因子)。
2 结果与分析
2.1 VDR诱饵表达载体(pGBKT7-VDR)的构建
提取C57BL/6小鼠小肠组织总RNA,反转录为cDNA,以其为模板通过PCR扩增小鼠全长VDR基因,片段大小约为1 279 bp,与预期基因片段大小相一致(图1-A);通过双酶切VDR基因与pGBKT7骨架载体并纯化,再用T4连接酶连接后转化至E.coliTop10感受态细胞,随机挑取11个单克隆进行菌落PCR鉴定,其中7个单克隆中能扩增获得大小约为1 279 bp的特异条带(图1-B)。最终通过测序鉴定确认,载体中VDR序列与NCBI所公布VDR基因全长序列完全一致,说明成功构建重组诱饵表达载体pGBKT7-VDR(图2)。

A:VDR基因扩增 PCR amplification ofVDRgene;B:菌落PCR PCR assay of Colony;M.DNA标准物DL2000 DNA marker DL2000;1.阴性对照 Negative control;其他序号为试验组 Other numbers stand for experimental group
图1pGBKT7-VDR重组载体构建检测
Fig.1ConstructiondetectionofrecombinantvectorpGBKT7-VDR
2.2 VDR诱饵蛋白表达检测及自激活验证
将成功构建的pGBKT7-VDR重组载体转化至酿酒酵母AH109,经营养缺陷型培养基SD/+His/+Ade/+Leu/-Trp筛选获得重组酵母菌株,命名为AH109-pGBKT7-VDR(图3),并通过Western blot验证VDR诱饵蛋白可在重组酵母菌株中表达。从图4可见对照组无特异蛋白条带,而试验组中有一条大小约为65 ku的特异蛋白条带,与预期结果相一致。为了排除酵母双杂交试验中的假阳性现象,进行VDR诱饵蛋白自激活现象的验证,结果发现AH109-pGBKT7-VDR重组酵母菌株与阳性对照类似,可在营养缺陷型培养基上正常生长,而阴性对照菌株只能在SD/+His/+Ade/+Leu/-Trp营养缺陷型培养基正常生长(图5和表2)。证明完整的VDR诱饵蛋白存在自激活现象,并无任何毒性。

图2 pGBKT7-VDR重组载体示意图Fig.2 Schematic diagram of recombinant vector pGBKT7-VDR
图3 含重组载体的AH109菌株Fig.3 Transformants of AH109 harboring recombinant vector
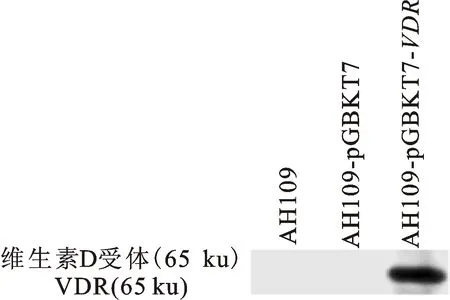
图4 Western blot检测VDR表达Fig.4 Detection of VDR by Western blot

CK.AH109菌株 AH109 strain;PC.FGF13相互作用蛋白阳性杂交酵母菌株 FGF13 interaction protein positive hybrid yeast strain;NC.AH109-pBKT7-FGF13菌株 AH109-pBKT7-FGF13strain;1#.AH109-pGBKT7-VDR菌株 AH109-pGBKT7-VDRstrain
图5完整VDR诱饵蛋白自激活分析
Fig.5Self-activatinganalysisofcompleteVDRbaitprotein
2.3 删除转录激活域后VDR诱饵表达载体的构建及自激活验证
为了消除自激活现象,分别构建删除VDR转录激活域不同区段的诱饵表达载体,如图6-A、6-B所示,并通过菌落PCR鉴定和测序鉴定确认成功构建删除VDR转录激活域的诱饵表达载体(图6-C、图6-D、图6-E)。为了检验删除不同区段VDR转录激活域诱饵蛋白是否仍存在自激活显现,通过营养缺陷型培养发现,试验组2#与4#未能在SD/+Leu/-Trp/-His/-Ade和SD/-Trp/-His/-Ade/-Leu培养基上生长(图7和表3),结果表明,结构域AF-2依然存在自激活现象,但切除结构域A/B未有自激活现象,同时两者都切除也不存在自激活现象。由此证明,VDR结构域A/B导致自激活现象,而结构域AF-2未有自激活现象,于是本试验选取pGBKT7-VDR-KoA/B载体作为诱饵蛋白表达重组载体。
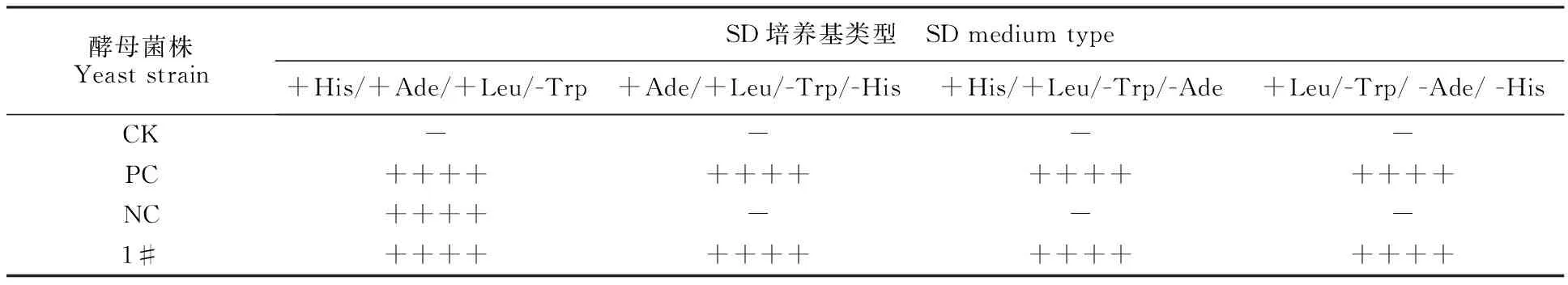
表2 表达完整VDR诱饵蛋白的酵母生长活性评价Table 2 Evaluation of growth activity of yeast expressing VDR bait protein
注:CK.AH109菌株;PC.FGF13相互作用蛋白阳性杂交酵母菌株;NC.AH109-pBKT7-FGF13菌株;1#.AH109-pGBKT7-VDR菌株;“+”正常生长克隆;“-”不能正常生长克隆。
Note:CK.AH109 strain;PC.FGF13 interaction protein positive hybrid yeast strain;NC.AH109-pBKT7-FGF13 strain;1#.AH109-pGBKT7-VDRstrain;“+”Colony normal growth;“-”Colony unnormal growth.

A:重组载体示意图 Schematic diagram of recombinant vector; A/B.不依赖配体的细胞特异性转录激活的调节功能区 Regulatory regions of ligand-independent cell-specific transcriptional activation;DBD.DNA结合结构域 DNA binding domain;Hinge.抗原决定区 Antigen-determining region;LBD.配体结合区 Ligand binding domain;AF-2.配体依赖激活结构域 Ligand dependent activation domain;B:PCR扩增删除转录激活域VDR检测结果 VDR assay results for PCR amplification to remove transcriptional activation domain.M.DNA标准物 DL2000 DNA marker DL2000;1.删除VDRA/B和AF-2激活域片段 VDR-KoA/B-KoAF-2;2.删除VDR A/B激活域片段 VDR-KoA/B;3.删除VDR AF-2激活域片段 VDR- KoAF-2;C:菌落PCR检测pGBKT7-VDR-KoA/B载体构建 Colony PCR assay ofpGBKT7-VDR-KoA/B;D:菌落PCR检测pGBKT7-VDR- KoAF-2载体构建 Colony PCR assay of pGBKT7-VDR-KoAF-2;E:菌落PCR检测pGBKT7-VDR-KoA/B-KoAF2载体构建 Colony PCR assay of pGBKT7-VDR-KoA/B-KoAF2;M.DNA标准物 DL2000 DNA marker DL2000;1.空白对照 Numbers1 stand for negative control;2~11.不同单克隆菌落PCR扩增产物 PCR production of different colonies
图6删除转录激活域后VDR诱饵表达载体的构建
Fig.6ConstructionofvariousVDRexpressionvectorsafterdeletionoftransactivationdomains

CK.AH109菌株 AH109 strain;PC.FGF13相互作用蛋白阳性杂交酵母菌株 FGF13 Positive hybrid yeast strain of interaction protein ;NC.AH109-pBKT7-FGF13菌株 AH109-pBKT7-FGF13strain;1#.AH109-pGBKT7-VDR菌株 AH109-pGBKT7-VDR strain;2#.AH109-pGBKT7-VDR-KoA/B菌株 AH109-pGBKT7-VDR-KoA/Bstrain;3#.AH109-pGBKT7-VDR- KoAF2菌株 AH109-pGBKT7-VDR- KoAF2strain;4#.AH109-pGBKT7-VDR-KoA/B - KoAF2菌株 AH109-pGBKT7-VDR-KoA/B - KoAF2strain
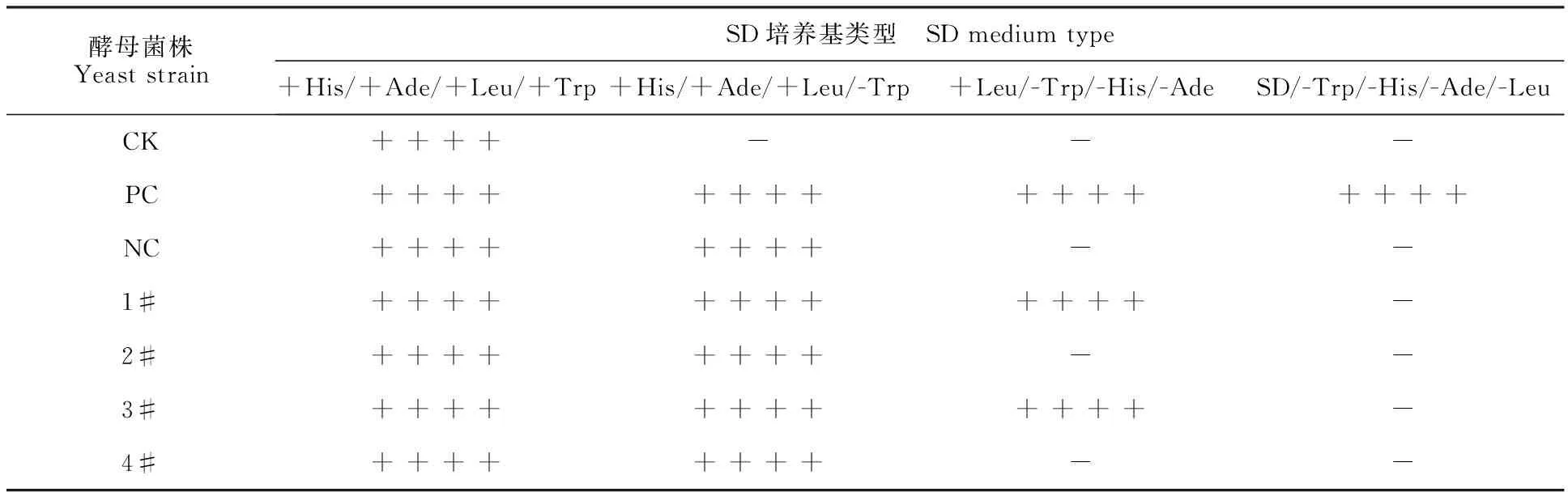
图7 不同激活域突变类型的VDR诱饵蛋白自激活分析Fig.7 Self-activation analysis of different transactivation domain mutant of VDR bait proteins
注:CK.AH109菌株;PC.FGF13相互作用蛋白阳性杂交酵母菌株;NC.AH109-pBKT7-FGF13菌株;1#.AH109-pGBKT7-VDR菌株;2#.AH109-pGBKT7-VDR-KoA/B菌株;3#.AH109-pGBKT7-VDR- KoAF2菌株;4#.AH109-pGBKT7-VDR-KoA/B - KoAF2菌株;“+”正常生长克隆;“-”不能正常生长克隆。
Note:CK.AH109 strain;PC.FGF13 Positive hybrid yeast strain of interaction protein;NC.AH109-pBKT7-FGF13 strain;1#.AH109-pGBKT7-VDR strain;2#.AH109-pGBKT7-VDR-KoA/Bstrain;3#.AH109-pGBKT7-VDR- KoAF2strain;4#.AH109-pGBKT7-VDR-KoA/B - KoAF2strain;“+”Colony normal growth;“-”Colony unnormal growth.
2.4 酵母双杂交效率验证及阳性克隆筛选
将AH109-pGBKT7-VDR-KoA/B酵母菌株与含小鼠的酵母双杂交猎物蛋白cDNA文库的Y187酵母菌进行杂交,杂交52 h后,取少量酵母杂交菌液镜检,杂交成功的酵母菌株呈三叶草形状(图8-A)。取杂交酵母菌梯度稀释为10-1、10-2、10-3、10-4涂布于SD/+His/+Ade/-Leu/-Trp,置于30 ℃培养箱培养3~5 d,统计生长菌落数,计算杂交效率为28.75%(图8-B),可以用于后续试验研究。将杂交的酵母菌液涂布于 SD/-Trp-Leu-His-Ade培养基,置于30 ℃培养箱培养6~10 d,从而获得500多个候选阳性克隆。
2.5 候选阳性克隆鉴定分析
随机提取50个阳性克隆质粒,经Hind Ⅲ酶切鉴定,发现不同的阳性克隆插入的基因大小也不同(图9)。将酶切鉴定的阳性质粒测序,并在NCBI数据库BLAST比对分析,结果筛选出12个可能与VDR互作的蛋白因子(表4),筛选的蛋白参与不同的代谢途径,包括细胞增殖、凋亡以及与胚胎发育、精子发育、精子活力等多种生物学功能。
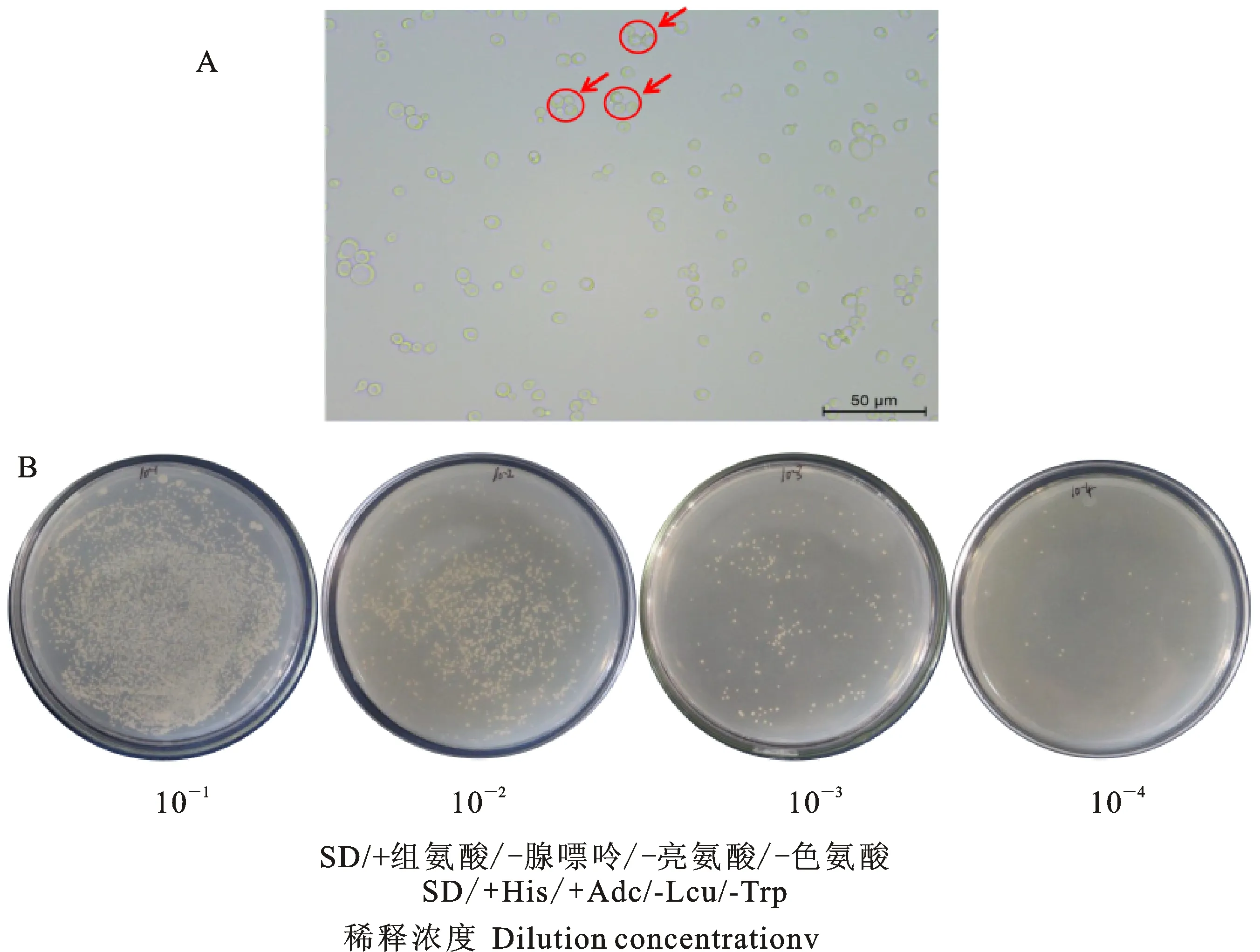
A:显微镜检测酵母杂交 Yeast hybrids by microscopic examination;B:酵母双杂交效率检测 Yeast hybridization efficiency test
图8酵母双杂交筛选与VDR互作蛋白
Fig.8Screeningofyeasttwo-hybridsystemandmouseVDRinteractionprotein
M.DNA标准物 5000 DNA marker 5000;其他泳道为插入不同cDNA的质粒 Other numbers are all plasmids of inserting indifferent cDNA
图9酶切鉴定不同插入的cDNA
Fig.9IdentificationofcDNAspeciesbyenzymedigestion
2.6 β-半乳糖苷酶活性检测
通过检测β-半乳糖苷酶活性,鉴定所筛选的蛋白因子与VDR互作能力的强弱。结果表明:与对照组相比,所筛选的蛋白因子均有与VDR相互作用的活性,其中AKAP10、FKBP51蛋白与VDR互作能力相对较强(图10)。最终,本研究通过验证筛选的蛋白因子与VDR相互作用的强弱,并筛选出与雄性生殖相关的AKAP10、FKBP51以及CYP2J5蛋白因子,但是这些蛋白因子如何与VDR相互作用影响雄性生殖还需进一步验证。
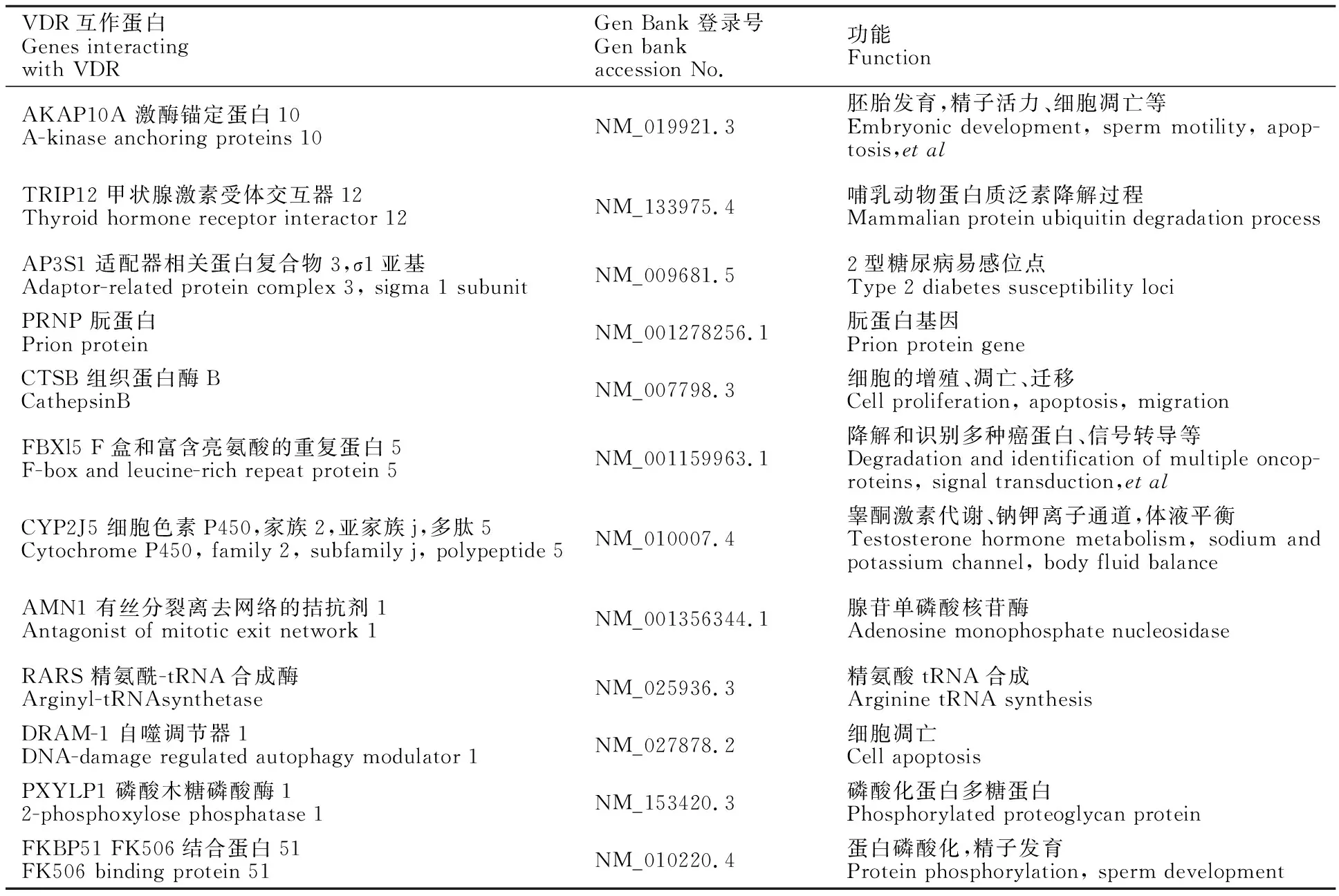
表4 BLAST分析与预测候选基因功能Table 4 BLAST analysis and predicted functions of candidate genes
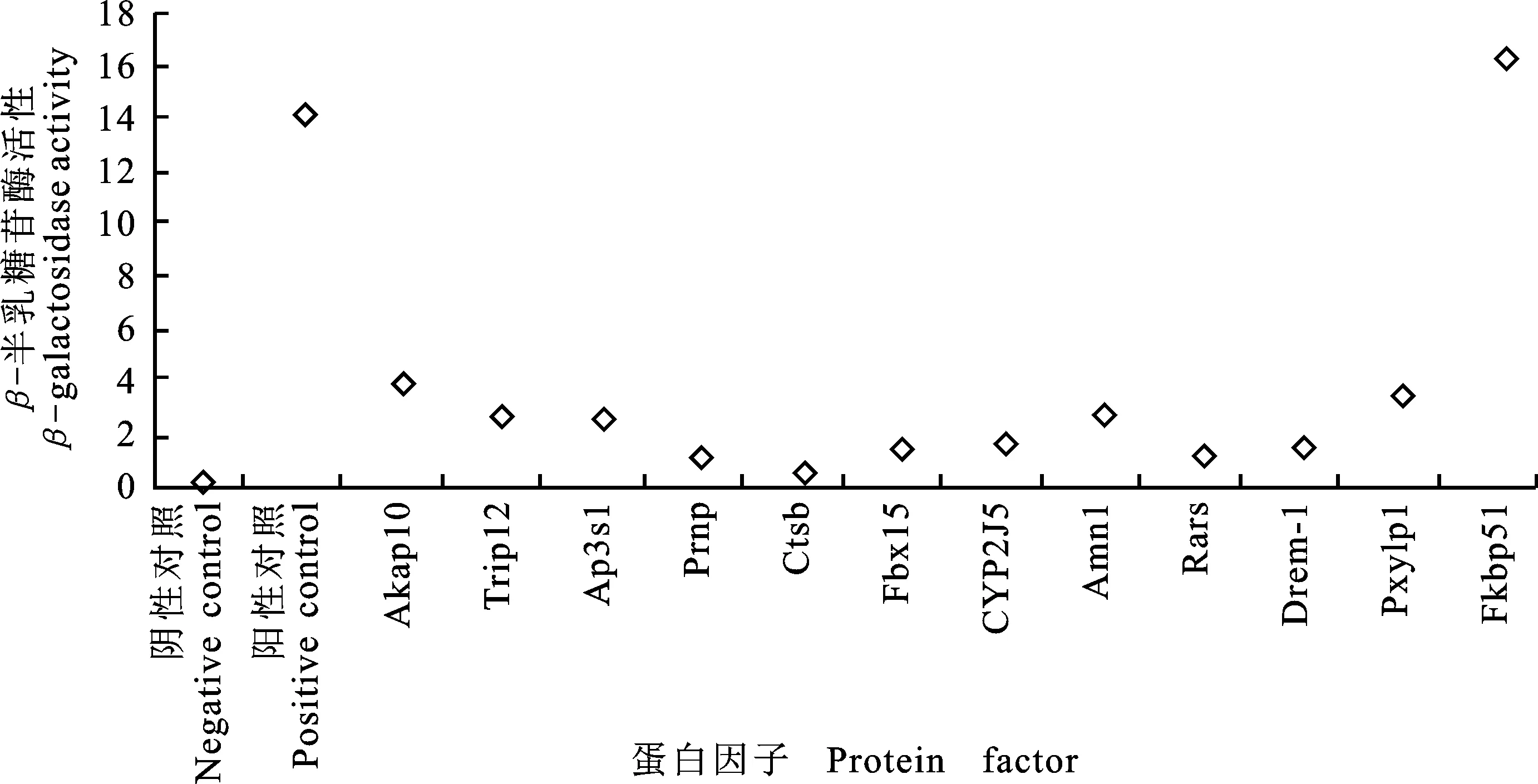
图10 酵母双杂交菌株β-半乳糖苷酶活性测定Fig.10 Determination of beta-galactosidase activity of yeast two-hybrid strain
3 讨 论
VDR作为一种亲核蛋白,通过与配体特异性结合调控多种基因表达,进而影响细胞增殖分化、免疫调节、抑制肿瘤等多种生命活动[3,6,11]。VDR不仅可以直接或间接结合到一种或多种转录起始位点调控基因表达,VDR还能与蛋白因子互作调控生命活动。研究蛋白互作的方法主要有酵母双杂交系统、噬菌体展示、荧光共振能量转移、Pulldown和免疫共沉淀等方法,相对于其他技术,酵母双杂交技术简便、灵敏、高效以及能反映不同蛋白质之间在活细胞内的相互作用等特点[12-13]。本研究基于酵母双杂交技术筛选与VDR互作蛋白,进一步了解VDR的作用机制。本试验通过在酿酒酵母体内验证VDR全长诱饵表达载体pGBKT7-VDR自激活现象,证实VDR全长基因编码的蛋白因子可能作为转录因子调节某些基因的转录表达,与前人[3-5]研究结果一致。
本研究最终选择删除A/B结构域的诱饵表达载体pGBKT7-VDR-KoA/B可用于在小鼠cDNA文库中筛选与VDR互作蛋白。通过酵母双杂交分析获得可能与VDR互作的12个蛋白因子。这些蛋白因子参与机体信号传递、细胞增殖、凋亡和生殖等多种生物学功能。A型激酶锚定蛋白(A-kinase anchoring proteins,AKAPs)是一种第二信使cAMP介导的细胞信号传递中重要的蛋白分子家族,其主要功能是通过特异性将cAMP依赖性蛋白激酶A(PKA)锚定于作用底物附近,进而催化靶蛋白的磷酸化传递细胞信号[14-15]。AKAPs家族能锚定多种蛋白因子,并参与多种细胞信号转导,AKAP3、AKAP 4、AKAP82等蛋白家族成员已经被报道[16-19]:它们在精子细胞和精子中表达,定位于鞭毛,这些蛋白家族分子与精子跨膜细胞信号转导与精子的活力密切相关。AKAPs结合的KAPP3或RII-β酪氨酸磷酸化导致精子前向运动抑制和高活性运动,再通过PKA与酪氨酸磷酸化AKAPs结合而激活和补充精子活力[17],但是AKAP10的功能几乎没有报道,于是可以猜测AKAP10也可以通过磷酸化或去磷酸化影响精子形成、发育和精子活力。还有一类蛋白因子FKBP家族成员调控着精子发生,它们能在睾丸组织中特异表达,在生殖细胞减数分裂Ⅰ中与其他蛋白因子形成联会复合体,直接差异减数分裂过程的同源染色体联会[20-21]。FKBP51是其家族一员也在睾丸中高效表达,可以通过与热激蛋白Hsp70/ Hsp90形成复合体调节类固醇激素,其中包括糖皮质激素(GR)及孕酮激素;据报道,孕激素在某种条件下可以向雄性激素转化,进而FKBP51可能也能调控雄性激素[22-23]。本研究通过酵母双杂交筛选出VDR与FKBP51互作,VDR能够调控类固醇激素维生素D代谢,进而表明:VDR与FKBP51在生命活动中有密切的关系,同时可调控雄性生殖。不仅FKBP51有这些功能,此外,FKBP51作为一种支架蛋白,参与到AKT、AKT/NFKB、PI3K/AKT信号通路,通过控制AKT磷酸化与去磷酸化,进一步调控各种生命活动[24-25]。细胞色素P450属于CYP基因家族,广泛存在多种组织器官,是一种由结构和功能相关的超家族酶系,有的家族成员能够激活PI3K/AKT、MAPK等多种信号通路,形式多种生物功能[26-28]。CYP2J5便是大家族一员,在小鼠肾脏中也能调节盐离子平衡,其表达不仅受到年龄的影响,还受到性激素的调节,即在肾脏中在雄性体内表达量高于雌性,待性成熟之后两者表达量更为明显[29]。除了CYP2J5参与亚油酸的代谢,还可以代谢睾酮、双氯芬酸以及丁呋洛尔,于是CYP2J5也很有可能参与到雄性生殖通路过程[30]。
