慢性低氧状态对肾小球足细胞高通量钙激活钾通道表达和功能的影响*
2018-10-11张蕊张威刘国建鲍运霞
张蕊,张威,刘国建,鲍运霞
(哈尔滨医科大学附属第二医院 肾内科,黑龙江 哈尔滨 150086)
慢性低氧是各种肾脏疾病进展至终末期肾脏病(end stage renal disease, ESRD)的共同途径[1-2]。以往的研究大多关注低氧引起的肾小管间质损害,却较少提及肾小球的低氧性损伤。最近的研究表明肾小球足细胞的低氧性调节可能引起足细胞裂孔蛋白CD2AP等水平下降,足细胞骨架蛋白F-actin重组,并参与肾小球硬化的发展[3-4]。足细胞是肾小球滤过屏障的关键组成部分,能通过改变足突间裂隙膜的孔径调节肾小球滤过率,足细胞损伤可引起肾小球滤过率下降和蛋白尿产生[5-6]。已有研究证实,低氧条件下足细胞内低氧诱导因子(hypoxia induced transcription factor,HIFs)水平升高,通过调控足细胞重要功能基因的转录改变细胞的结构和功能[4-7]。此结果提示慢性低氧可能通过足细胞调节机制参与肾小球损伤和硬化的发展[7],但是其具体机制尚不清楚。
高通量钙激活钾通道(简称BK通道)是最早发现的氧敏感性离子通道之一[8-9],在可兴奋性细胞中,BK通道低氧性抑制引起细胞膜去极化,激活电压依赖式钙通道,导致大量Ca2+内流,引发细胞的低氧适应性改变,从而参与多种组织细胞的低氧性调节[10-12]。本研究组设想BK通道参与足细胞低氧的适应性调节。为证明这项假设,笔者观察了低氧对人类足细胞BK通道表达和功能的影响,同时对低氧状态下BK通道调节的可能机制进行探讨。
1 材料与方法
1.1 研究对象
由于肾小球足细胞为终末分化细胞,只有分化完全后才能行使正常生理功能,因此研究组选择条件永生性人类足细胞系作为研究对象。此类细胞系特殊转入了温度敏感性基因,在33℃培养时处于增殖状态,转入37℃培养后无需改变培养基成分即停止增殖并开始分化。继续培养11~14 d足细胞可达完全分化,具有类似人类足细胞的生理结构和功能。
1.2 实验材料
RPMI 1640(美国HyClone公司),胰岛素、转铁蛋白及亚硒酸钠混合液(insulin, transferrin and sodium selenite, ITS)(美国 Sigma公司),10% FBS(美国HyClone公司)。cDNA转录试剂盒(美国ABI公司),SYBR Green PCR Master Mix体系(美国ABI公司),ABI PRISM 7500系统(美国ABI公司)。BCA蛋白测定试剂盒(美国Pierce公司),BK通道α、β3和β4亚基抗体(英国Abcam公司)或actin抗体(美国Santa Cruz公司),羊抗兔IgG或羊抗鼠IgG的荧光二抗(美国Invitrogen公司),Odyssey infrared成像系统(美国Li-COR公司)。电生理实验的所有试剂(美国Sigma公司),倒置显微镜(日本Nikon公司),电极拉制仪P-97(美国Sutter公司),Axo-patch 200B系统(美国Axon公司),Digidata 1440A interface系统(美国Axon公司),pClamp 10.2软件(美国Axon公司),Graphpad prism 5软件(美国GraphPad公司)。
1.3 方法
1.3.1 细胞培养、低氧处理及实验分组 条件永生性人类足细胞系增殖及分化所需培养基成分包括RPMI 1640,ITS和10% FBS,其中ITS能够促进足细胞的增殖及分化,为培养所必需。可根据实验设计将分化完全的足细胞分为3组,分别置于正常氧气浓度(21% O2)和低氧条件(10%或2% O2)的孵箱中进行培养[8,13-15]。正常氧浓度孵箱内气体成分为21% O2,5% CO2,其余由N2补充。低氧孵箱内气体成分为10%或2% O2,5%CO2,其余由N2补充。在培养的第6、12、24和48 h逐步取出各组细胞,分别进行PCR检测,Western blot检测和膜片钳实验,测定各组细胞BK通道α、β3及β4亚基基因和蛋白的表达水平,同时记录BK通道开放电流,比较各组细胞在常氧和低氧条件培养不同时间点BK通道表达和功能状态,观察低氧条件对足细胞BK通道表达和功能的影响,从而为慢性肾脏病引起的肾小球缺氧状态和足细胞缺氧性BK通道功能调节提供理论依据。另取两组常氧浓度培养并分化完全的足细胞,分别加入二甲基烯丙基氧甘氨酸(DMOG,1 mmol/L)或氯化钴(CoCl2,100μmol/L),制作化学缺氧模型,测定BK通道亚基和蛋白表达水平,记录通道电流,比较其与常氧对照组细胞BK通道功能和表达的不同。另取两组常氧培养的足细胞,在放入低氧孵箱前分别向培养液中加入还原剂谷胱甘肽乙酯(GSH,1 mmol/L)或过氧化氢酶(Catalase,200 u/ml),比较其与低氧培养组细胞BK通道亚基表达和功能的不同,分析其是否参与氧化应激机制。
1.3.2 Real-time PCR 将10μl的反应混合物放入逆转录系统中。这个过程所使用的RNA总量为0.5 mg,并应用高效能cDNA逆转录试剂盒进行cDNA的初始合成。所有的real-time PCR实验都应用SYBR Green PCR Master Mix体系,并在ABI PRISM 7500系统中完成。BK通道蛋白基因的引物序列如下,KCNMA1正向引物:5'-AACCCGCCCTATGAGTTTG-3',反向引物:5'-GGATGGGATGGAGTGAACAG-3';KCNMB3正 向引物:5'-GAGAGGACCGAGCCGTGAT-3',反向引物:5'-CACCACCTAGCAGAGTCAGTGAAG-3';KCNMB4正向引物:5'-GCGTTCTCATTGTGGTCC-3',反向引物:5'-TTCCAGTTGTGCCTGTTTC-3'。扩增后的成分由ABI Prism genetic analyzer进行分析。
1.3.3 Western blot 分化完全的足细胞用冰PBS液冲洗后,经3000 r/min离心10 min,放入含有1%蛋白酶抑制剂的溶液中用于蛋白提取。细胞裂解产物需在冰上培养15 min,之后以13500 r/min离心15 min。用BCA蛋白测定试剂盒对总蛋白含量进行定量分析。随后蛋白样本需进行10% SDS PAGE凝胶电泳,分离后的蛋白质转至硝酸纤维素膜上。转膜后将硝酸纤维素膜在室温下用5%脱脂奶封闭2 h,随后选择合适的一抗进行孵育:BK通道α、β3和β4亚基抗体(1︰200)或actin抗体(1︰500)。冲洗后将硝酸纤维素膜与羊抗兔IgG或羊抗鼠IgG的荧光二抗(1︰10000)进行培养。最后使用Odyssey infrared成像系统对条带吸光度进行分析。
1.3.4 电生理记录 BK通道电流以全细胞模式进行膜片钳记录,微电极使用毛细硅硼玻璃管在电极拉制仪P-97上拉制完成,所有实验均在室温(20~22℃)下进行。在全细胞记录模式下,细胞内液成分为15 mmol/L KCl,130 mmol/L K aspartate,1 mmol/L MgCl2,10 mmol/L EGTA,10 mmol/L Hepes及5.76 mmol/L CaCl2(游离Ca2+浓度200 nmol/L);用KOH调节pH值至7.2。标准浴液成分包括145 mmol/L NaCl,4.5 mmol/L KCl,1 mmol/L MgCl2,2 mmol/L CaCl2及 10 mmol/L Hepes;用NaOH调节pH值至7.4。传代在5~15代之间的完全分化足细胞用于检测。细胞的钳制电压设定为-60 mV,记录电压在-80~+80 mV之间波动时通道电流的变化。每20 mV记录1次,每次记录时间为700 ms。电流由Axo-patch 200B系统放大并经1 kHz频率滤波后,通过Digidata 1440A interface系统进行在线记录。最后应用pClamp 10.2软件获取数据并进行分析。电导率数据以G/Gmax表示且符合Boltzmann方程。
1.4 统计学方法
数据分析采用SPSS 16.0、Photoshop及Graphpad prism 5统计软件,计量资料以均数±标准差(±s)表示,多组间的比较采用单因素方差分析,两组比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 BK通道电流的确定
通道的反转电位约为-60 mV,接近K+平衡电位(细胞内外的K+浓度分别为145.0和4.5 mmol/L)。将细胞内Ca2+浓度由200 nmol/L提高至5μmol/L时,通道的外向电流水平明显增加(见图1A)。在细胞外液中加入非选择性K+通道阻断剂TEA(5 mmol/L)后,+80 mV电压下的电流水平下降至41%;加入选择性BK通道阻断剂Penitrem A(100 nmol/L)[16]后,通道电流下降至29%(见图1B)。由此证实诱发的通道电流完全由BK通道开放所引起。见表1~3。
2.2 慢性低氧对足细胞BK通道电流的抑制
低氧条件(2%O224 h)下,足细胞BK通道在+80 mV电压刺激下的电流水平由(14.45±2.06)pS下降至(4.78±1.12)pS,差异有统计学意义(P<0.05),且足细胞的活性无明显变化。见图2A、2B及表4。
2.3 慢性低氧上调足细胞BK通道β4亚基mRNA及蛋白表达对α和β3亚基表达的影响
低氧条件(2% O224 h)下足细胞BK通道β4亚基mRNA(B4)水平升高,而α和β3亚基mRNA(A1和B3)表达无明显变化(见图3A)。β4亚基mRNA自低氧6 h起开始升高,低氧12~24 h达峰值,在低氧48 h时有所下降。与基因表达情况类似,低氧条件下(2% O224 h)BK通道β4亚基表达增加(见图3B和表 5)。
2.4 氧化应激反应参与低氧诱导的BK通道β4亚基表达上调
细胞培养液中加入DMOG(1 mmol/L)或CoCl2(100 μmol/L)孵育24 h并未明显改变BK通道β4亚基mRNA的表达(见图4A)。低氧条件下细胞外液中加入还原剂谷胱甘肽乙酯(GSH,1 mmol/L)或过氧化氢酶(Catalase,200 u/ml)明显降低低氧引起的β4亚基mRNA水平升高。见图4B和表6、7。

图1 人类肾小球足细胞BK通道电流的记录
表1 不同游离钙浓度对BK通道电流的影响 (±s)

表1 不同游离钙浓度对BK通道电流的影响 (±s)
电流值电压值t值 P值游离钙200 nmol/L 游离钙5 μmol/L-80 mV -0.225±0.132 -0.204±0.200 0.288 0.776-60 mV 0.005±0.054 -0.015±0.087 0.663 0.515-40 mV 0.253±0.136 0.470±0.173 3.155 0.005-20 mV 0.536±0.272 1.039±0.408 3.385 0.0030 mV 0.937±0.422 1.749±0.647 3.480 0.00320 mV 1.686±0.574 3.291±1.393 3.787 0.00140 mV 3.369±0.777 6.166±3.064 3.288 0.00460 mV 6.685±0.976 11.838±4.025 4.635 0.00080 mV 12.171±1.464 19.168±4.279 5.613 0.000
表2 TEA对BK通道电流的影响 (±s)
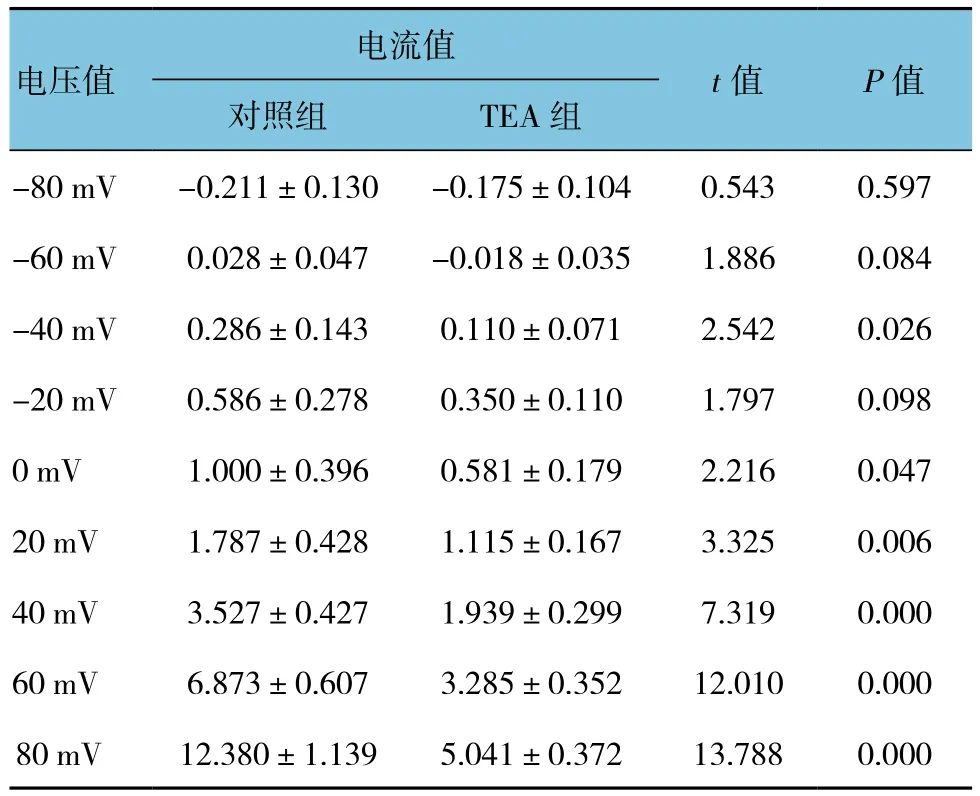
表2 TEA对BK通道电流的影响 (±s)
电流值电压值t值 P值对照组 TEA组-80 mV -0.211±0.130 -0.175±0.104 0.543 0.597-60 mV 0.028±0.047 -0.018±0.035 1.886 0.084-40 mV 0.286±0.143 0.110±0.071 2.542 0.026-20 mV 0.586±0.278 0.350±0.110 1.797 0.0980 mV 1.000±0.396 0.581±0.179 2.216 0.04720 mV 1.787±0.428 1.115±0.167 3.325 0.00640 mV 3.527±0.427 1.939±0.299 7.319 0.00060 mV 6.873±0.607 3.285±0.352 12.010 0.00080 mV 12.380±1.139 5.041±0.372 13.788 0.000
表3 Penitrem A对BK通道电流的影响 (±s)

表3 Penitrem A对BK通道电流的影响 (±s)
电流值电压值t值 P值对照组 Penitrem A组-80 mV -0.211±0.130 -0.258±0.181 0.527 0.609-60 mV 0.028±0.047 -0.002±0.046 1.055 0.314-40 mV 0.286±0.143 0.280±0.135 0.073 0.943-20 mV 0.586±0.278 0.561±0.183 0.165 0.8720 mV 1.000±0.396 0.903±0.287 0.439 0.66920 mV 1.787±0.428 1.333±0.404 1.793 0.10040 mV 3.527±0.427 1.896±0.544 5.874 0.00060 mV 6.873±0.607 2.642±0.684 11.197 0.00080 mV 12.380±1.139 3.619±0.709 14.027 0.000
表4 低氧对足细胞BK通道电流的影响 (±s)

表4 低氧对足细胞BK通道电流的影响 (±s)
电流值电压值t值 P值常氧浓度 低氧浓度-80 mV -0.277±0.203 -0.088±0.042 2.403 0.028-60 mV 0.114±0.189 0.103±0.145 0.130 0.896-40 mV 0.520±0.560 0.030±0.047 2.283 0.036-20 mV 0.990±0.876 0.002±0.002 2.948 0.0090 mV 1.532±1.222 0.169±0.186 2.897 0.01020 mV 2.571±1.598 0.690±0.578 2.972 0.00940 mV 4.629±1.793 1.441±1.099 4.234 0.00160 mV 8.135±1.899 2.091±1.355 7.359 0.00080 mV 13.807±2.272 3.504±1.591 10.530 0.000

图2 慢性缺氧抑制人类肾小球足细胞BK通道电流
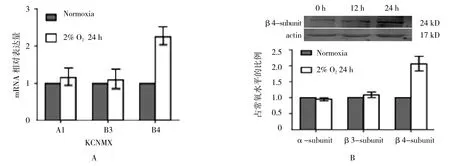
图3 慢性缺氧对BK通道亚基mRNA和蛋白表达的影响
表5 慢性缺氧对BK通道亚基mRNA和蛋白表达的影响(±s)
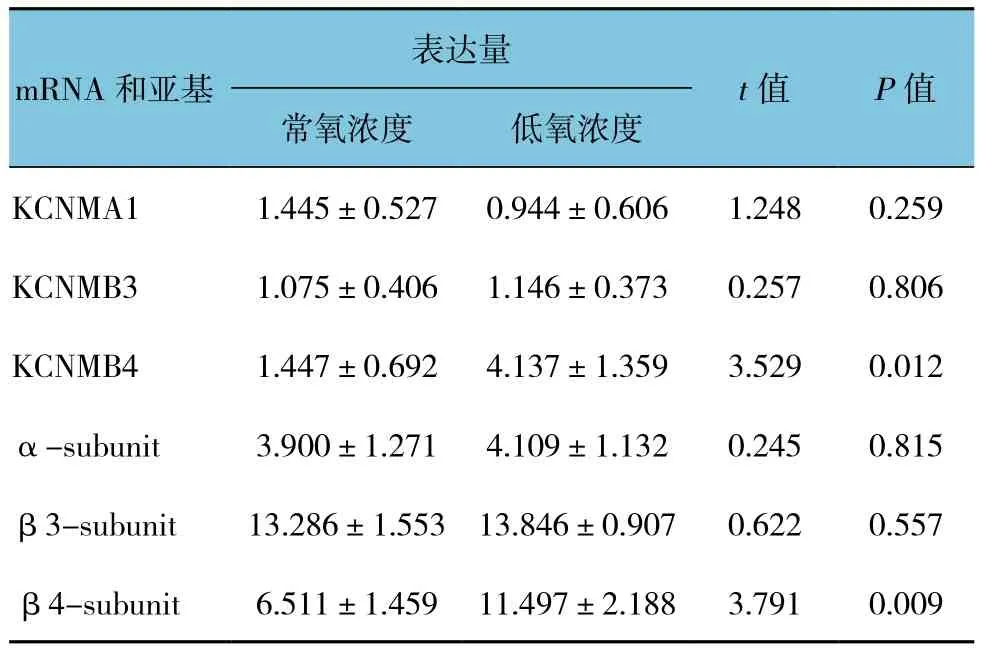
表5 慢性缺氧对BK通道亚基mRNA和蛋白表达的影响(±s)
表达量mRNA和亚基t值 P值常氧浓度 低氧浓度KCNMA1 1.445±0.527 0.944±0.606 1.248 0.259 KCNMB3 1.075±0.406 1.146±0.373 0.257 0.806 KCNMB4 1.447±0.692 4.137±1.359 3.529 0.012 α-subunit 3.900±1.271 4.109±1.132 0.245 0.815 β3-subunit 13.286±1.553 13.846±0.907 0.622 0.557 β4-subunit 6.511±1.459 11.497±2.188 3.791 0.009
表6 DMOG和CoCl2对β4亚基mRNA表达的影响(±s)
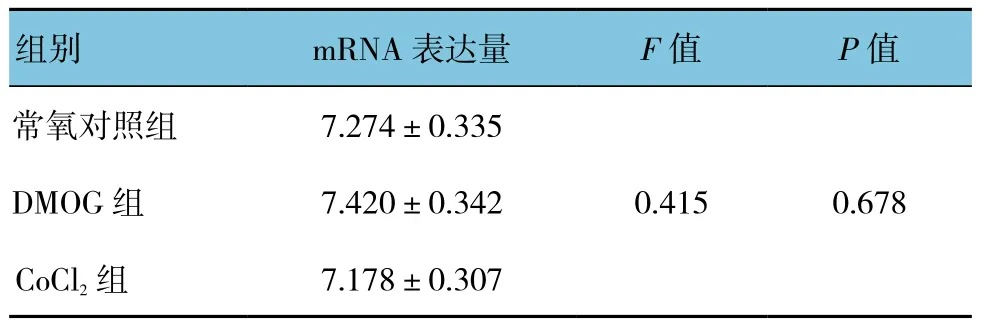
表6 DMOG和CoCl2对β4亚基mRNA表达的影响(±s)
组别 mRNA表达量 F值 P值常氧对照组 7.274±0.3350.415 0.678 DMOG组 7.420±0.342 CoCl2组 7.178±0.307

图4 氧化应激反应参与缺氧诱导的β4亚基mRNA表达上调
表7 GSH和Cata对β4亚基mRNA低氧性上调的影响(±s)

表7 GSH和Cata对β4亚基mRNA低氧性上调的影响(±s)
组别 mRNA表达量 F值 P值常氧对照组 7.754±0.4750.047 0.954 Hypo+GSH组 7.803±0.415 Hypo+Cata组 7.637±0.998
3 讨论
足细胞低氧性损伤在肾小球疾病的进展中具有重要作用[6]。BK通道被认为是参与低氧反应的关键角色。大多数组织中BK通道表现为低氧性功能抑制,如颈动脉体、动脉平滑肌细胞、中枢神经元和心肌细胞等。在这些组织细胞中,缺氧性BK通道抑制引起细胞膜去极化,从而激活电压依赖式钙通道,继而导致大量Ca2+内流,引发细胞的缺氧适应性改变。本研究表明在肾小球足细胞中,低氧可引起BK通道功能抑制,电流水平明显降低。
BK通道主要由成孔α亚基和调节性β亚基构成。目前为止已经克隆出哺乳动物BK通道的4种β亚基,β1~β4亚基分别由相应的KCNMB 1~4所编码。人类足细胞BK通道由α、β3及β4亚基组成。本研究分子生物学结果表明慢性缺氧环境可以引起足细胞BK通道β4亚基mRNA和蛋白表达水平上调,而对BK通道的成孔α亚基和调节性β3亚基的表达无明显影响,提示低氧可能通过上调β4亚基表达抑制足细胞BK通道功能。此结果与脑组织中的BK通道低氧性调节类似[17]。神经元的β4亚基被认为是BK通道的“下调因子”,可以使通道激活电压向去极化方向移动,减慢BK通道的激活动力学过程。同样在心肌细胞和动脉平滑肌细胞中β亚基也参与了低氧诱导的BK通道活性抑制[17-19]。因此,研究结果提示低氧通过上调β4亚基表达抑制足细胞BK通道功能。同时本研究组还发现用还原剂GSH和Catalase预处理的足细胞显著降低低氧诱导的BK通道β4亚基表达上调,提示ROS激活参与了足细胞BK通道β亚基表达的低氧性调节。以上数据提示慢性缺氧对β4亚基表达的影响至少发生在转录水平[20]。几乎所有的细胞类型对于慢性缺氧(数小时至数天)的适应性反应都依赖于影响多种基因表达水平的转录机制。然而对于影响BK通道重塑过程(包括亚基的翻译、装配、转运,以及以上过程的组合形式)的多种机制还不清楚。
虽然本研究组的结果表明低氧对α亚基表达无明显影响,但是许多其他研究提示α亚基参与BK通道的低氧性调节。BK通道α亚基的羧基端上具有血红素结合保守序列,可以与血红素直接结合[21-22]。另外,BK通道α亚基与血红素加氧酶2(HO-2)相关联,HO-2使血红素在有氧条件下与NADPH细胞色素P450还原酶结合产生一氧化碳NO。NO可以直接提高原位和重组BK通道的活性。而低氧条件降低了NO的有效性,从而导致通道关闭。因此HO-2被认为是BK通道的酶联氧感受器[20,23]。与酶联机制不同,BK通道也可以被细胞内Ca2+浓度的瞬间变化(Ca2+火花)激活。Ca2+火花可以使肌桨网内的Ca2+浓度以微摩尔的级别增加,从而迅速达到激活BK通道的水平[24]。对脑动脉平滑肌细胞[25]和稳定表达BK通道α亚基和β亚基的HEK293细胞[26]进行内面向外式膜片钳记录发现,在不添加任何酶类底物的情况下,缺氧以细胞内Ca2+依赖的模式抑制BK通道活性。这些数据提示缺氧通过非膜限制机制减少Ca2+火花和BK通道的有效耦联,进而引起BK通道活性抑制。但是也有人提出BK通道对氧浓度敏感性的保持是由于在通道蛋白羧基端的压力调节性外显子中有一段高度保守的富含半胱氨酸的序列[10]。本研究中低氧对足细胞BK通道α亚基表达无明显影响,可能与笔者检测的通道蛋白为细胞总蛋白有关。因此本研究组将进一步测定细胞膜BK通道α亚基的表达,从而明确其在足细胞缺氧性调节中的作用。
