杂交莲瓣兰根状茎增殖和分化技术研究及分子鉴定
2018-10-11孙东玲卓素卿欧阳明安
刘 祥,孙东玲,卓素卿,欧阳明安
(福建农林大学生物农药与化学生物学教育部重点实验室,福建福州 350000
莲瓣兰(Cymbidiumtortisepalum)别称菅草兰、卑亚兰、小雪兰[1],为兰科兰属多年生草本植物。曾被归入春兰之下作为变种,但因两者形态差异较大,最终恢复承认莲瓣兰为独立的种[2]。“莲瓣”是对兰花瓣型的描述,莲瓣兰的花形像荷花,莲瓣即荷瓣,故因此得名[3]。莲瓣兰原产于云南西北部的三江并流流域,分布范围十分狭窄,主要见于滇西北、川西南和台湾等地[4]。一般生长在常绿松栎林和灌木混交林下,土壤中性,喜背阴坡和疏松的腐质土[5],是中国传统兰花中最具云南特色的品种。
20世纪80年代起,以韩、日和我国台湾为中心的东南亚国家和地区兰市暴热,1株中档国兰的价值在数百至数千元人民币之间,珍稀兰花价值更逾百万元,莲瓣兰作为国产兰属中的重要一员,逐渐被国内兰界所熟知。目前已形成素花、奇花、瓣型花、复色花、线艺、矮种等系列的优良品种[6],因其叶态多姿(直立或半直立),叶长和叶宽有较大差异,花色丰富(白色、绿色、红色、黄色等),瓣型各异[7],深受中国、日本、韩国和东南亚等国家人民的喜爱,具有极高的观赏价值、文化价值和经济价值。
但是由于全球“兰花热”和经济利益驱使,近20年,瓣兰种质资源遭到了毁灭式采挖[8],导致其数量急剧减少,自然界中很难再找到开花的成年植株。生存环境的破坏导致其无法在自然界中正常地繁衍和生存,野生种质资源濒临灭绝。而莲瓣兰种子的胚多发育不完全或不成熟,甚至不含胚乳,因此直接用种子萌发来获得植株较为困难[9]。而传统的分株繁殖,种苗增殖缓慢,分株移栽过程易被病毒感染,品种退化严重[10],因此采用植物组织培养技术进行快速大量繁殖,对于解决莲瓣兰繁殖系数低等问题,同时推动大规模商业化生产是一种极为可行的方法。本试验以莲瓣兰大雪素为母本,墨兰为父本进行杂交,产生的后代根状茎为材料,研究不同因素对杂交莲瓣兰根状茎增殖的影响,并对其进行分子鉴定,以期为提高莲瓣兰育种质量和大规模商业化生产提供理论依据。
1 材料与方法
1.1 材料
供试材料为杂交莲瓣兰蒴果,其由父本墨兰(Cymbidiumsinense)的花粉涂抹于母本莲瓣兰大雪素(Cymbidiumtortisepalum‘Daxuesu’)的子房柱头上并套袋发育获得(2014年12月人工授精,2015年7月获得蒴果,地点在福建农林大学英龙2号楼天台)。
1.2 方法
1.2.1 杂交根状茎的诱导 将蒴果表面消毒后剖开,取出兰花种子撒在1/2 MS培养基上,暗培养10 d后转入光照培养。培养条件:温度25 ℃,光照度2 400 lx,时间12 h/d,湿度75%,待种子萌发后转移到新的培养基上进行扩增,为后续试验积累材料。
1.2.2 不同基本培养基对根状茎增殖的影响 根状茎的增殖是莲瓣兰快速繁殖的关键,而基本培养基的成分则会直接影响到根状茎的生长状况,试验选取了MS、1/2MS、B5、N6共4种培养基进行比较,培养基中另外添加1 mg/L萘乙酸(NAA)+1 mg/L 6-苄基氨基嘌呤(6-BA)+30 g/L蔗糖+1 g/L活性炭+1 g/L胰蛋白胨+7 g/L琼脂。在无菌条件下,将根状茎掰成小块放入培养基中,每瓶放4根,每个处理重复5次,培养前后记录鲜质量和根状茎分枝数。
1.2.3 不同NAA浓度对根状茎增殖的影响 试验在N6基本培养基上进行,设置6-BA的浓度为1.0 mg/L固定不变,激素NAA的浓度梯度为0、0.5、1.0、2.0、4.0、5.0 mg/L,培养基中另外添加30 g/L蔗糖+1 g/L活性炭+1 g/L胰蛋白胨+7 g/L琼脂。每瓶放置4根材料,每个处理重复4次,培养前后记录鲜质量和根状茎分枝数。
1.2.4 不同6-BA浓度对根状茎增殖的影响 试验在N6基本培养基上进行,设置NAA的浓度为1.0 mg/L固定不变,激素6-BA的浓度梯度为0、0.5、1.0、2.0、3.0、4.0 mg/L,培养基中另外添加30 g/L蔗糖+1 g/L活性炭+1 g/L胰蛋白胨+7 g/L琼脂。每瓶放置4根材料,每个处理重复4次,培养前后记录鲜质量和根状茎分枝数。
1.2.5 不同碳源对根状茎增殖的影响 培养基中添加糖类是为植物组织细胞生长提供碳源,也可以提高培养基的渗透压。本试验对蔗糖、葡萄糖、乳糖、果糖、木糖、麦芽糖6种糖类进行筛选,浓度均为30 g/L,并以试验得到的最佳基本培养基N6和最佳激素搭配0.5 mg/L NAA+0 mg/L 6-BA为定值,另外添加1 g/L活性炭+1 g/L胰蛋白胨+7 g/L琼脂。每瓶放置4根材料,每个处理重复5次,培养前后记录鲜质量和根状茎分枝数。
1.2.6 不同有机添加物对根状茎增殖的影响 兰花组织培养过程中常常添加一些天然有机物,这些有机物成分复杂,研究表明,它们对根状茎的增殖和分化有明显的促进作用[11]。试验选取了椰子汁、苹果汁、马铃薯匀浆、西红柿匀浆、蛋白胨和胰蛋白胨6种天然复合物进行测试,其添加浓度分别为椰汁100 mL/L、苹果汁100 mL/L、马铃薯匀浆100 g/L、西红柿匀浆100 g/L、蛋白胨1 g/L、胰蛋白胨1 g/L。培养基中其他成分为N6+0.5 mg/L NAA+30 g/L蔗糖+1 g/L活性炭+7 g/L 琼脂。每瓶放置4根材料,每个处理重复4次,培养前后记录鲜质量和根状茎分枝数。
1.2.7 不同活性炭浓度对根状茎增殖的影响 组织培养中添加活性炭有吸附有毒代谢物和调节激素释放的作用,可以有效促进植物的生长。本试验测试0、1.0、2.0、3.0、4.0、5.0 mg/L 共6个活性炭浓度水平,培养基中其他成分为N6+0.5 mg/L NAA+30 g/L蔗糖+7 g/L琼脂。每瓶放置4根材料,每个处理重复4次,培养前后记录鲜质量和根状茎分枝数。
1.2.8 不同激素浓度搭配对根状茎分化的影响 前人研究表明选用恰当的植物激素配比对根状茎的分化起着主导作用[12]。本试验选取9个激素组合探究对根状茎发芽的影响(表1),培养基中其他成分为N6+30 g/L蔗糖+7 g/L琼脂。每瓶放置5根材料,每个处理重复4次,培养前后记录鲜质量、根状茎分化个数和总出芽数。

表1 分化试验激素组合
1.2.9 试验培养基条件及统计分析计算方式 以上“1.2.2”节至“1.2.8”节试验中的培养基pH值5.4~5.8,培养温度(25±2) ℃,相对湿度70%~80%,光照度2 400 lx,增殖过程光照时间12 h/d,培养时间为30 d,分化过程光照时间14 h/d,培养时间为120 d(时间从2016年3月至2017年4月,在福建农林大学英龙2号楼2楼植物组培室进行)。实验分析计算公式具体如下:
增殖率=(培养后分枝数-培养前分枝数)/培养前分枝数×100%;
鲜质量增长率=(培养后鲜质量-培养前鲜质量)/培养前鲜质量×100%;
分化率=分化根状茎数/5×100%;
平均出芽数=总出芽数/根状茎分化个数。
1.2.10 杂交莲瓣兰的分子鉴定 取根状茎诱导长出的小苗叶片作材料,通过植物基因组DNA提取试剂盒(TIANGEN)提取基因,并扩增其ITS片段,PCR体系如表2所示。

表2 PCR反应体系的组成
然后通过1.0%琼脂糖凝胶电泳法检测PCR产物,可用后进行回收,样品送至铂尚生物技术(上海)有限公司进行测序。最终将测序结果放在NCBI网站上进行比对,并下载10个相近的序列运用MEGA 5.05构建系统发育树探究其亲缘关系。
1.2.11 数据分析 试验数据采用Excel进行记录,采用SPSS 19.0进行数据分析并作图,采用Duncan’s新复极差法进行统计分析。
2 结果与分析
2.1 杂交根状茎的诱导
兰花种子内的球形胚发育不完全且无胚乳,加之致密种皮的透性差和种皮上含有抑制萌发的物质,自然条件下萌发困难。本试验将兰花种子撒在培养基上控温控湿,一段时间后种子吸水开始膨胀,在150~180 d内观察到种子萌发并逐渐形成根状茎,接着将根状茎转移到相同培养基上进行扩增(图1)。
2.2 不同基本培养基对根状茎增殖的影响
将根状茎接种在不同基本培养基上培养30 d后,可以肉眼观察到根状茎上新长出的白色或绿色的幼嫩侧枝,这说明不同培养基中的根状茎均有侧枝增加。通过对培养前后鲜质量的数据统计,由图2可知,在4种基本培养基培养条件下,无论是根状茎增殖率还是鲜质量增长率的差异都比较明显。在1/2MS上培养的根状茎增殖率最高,说明此培养基能够有效促进根状茎侧枝的生长,但是与N6培养基相比差异并不显著,另外其鲜质量增长率最低,可以说明1/2MS不利于根状茎质量的增加。在N6培养基上培养的根状茎鲜质量增长率在4种基本培养基中最高,说明其有利于根状茎的增粗增大,增殖率方面比1/2MS略少,但差异不大,其他2种培养基MS和B5促进根状茎侧枝和鲜质量增加的效果均一般,所以综合2种生长指标来看,N6培养基为最佳选择。
2.3 不同NAA浓度对根状茎增殖的影响
生长素在根状茎增殖过程中起着至关重要的作用。本试验设置6-BA为固定浓度,研究NAA不同浓度下根状茎的生长情况。从数据分析得出的折线图(图3)可以看出,根状茎的增殖率和鲜质量增长率随着NAA浓度的不断增大呈现出明显的波动状态。在不同处理中,当NAA浓度为 0.5 mg/L 时,根状茎鲜质量增长率最高,说明在此条件下根状茎增粗增大的幅度最大,此浓度最有利于根状茎有机物质的积累,但增殖率较低,说明不利于侧芽的生长,与此情况相近的浓度为5.0 mg/L,其增殖率和鲜质量增长率与0.5 mg/L水平差异并不明显。当NAA浓度为4.0 mg/L时,根状茎增殖率最高,其鲜质量增长率较之其他浓度一般,那么在培养过程中,可以根据需求的不同选择相应的生长素浓度,以便对根状茎有侧重地进行培养。



2.4 不同6-BA浓度对根状茎增殖的影响
细胞分裂素搭配生长素使用可以更好地促进根状茎的增殖。本试验设置NAA为固定浓度,选取6个不同的6-BA浓度水平,测定其不同浓度对根状茎增殖的影响。图4显示,增殖率和鲜质量增长率都随着6-BA浓度的改变而呈现出相似的趋势,即6-BA浓度小于2.0 mg/L时,整体上为下降趋势,6-BA浓度为2.0 mg/L时,增殖率和鲜质量增长率均为最低,6-BA浓度>2.0 mg/L后,增殖率和鲜质量增长率开始增加。整体看,无论是增殖率还是鲜质量增长率都以 6-BA 浓度为0时最佳,只是鲜质量增长率与浓度0.5、1.0 mg/L 水平相比差异不显著,但增殖率却达到了极显著差异(P<0.01),说明杂交莲瓣兰根状茎的培养只添加NAA即可,6-BA的存在会不同程度地降低增殖效率。

2.5 不同碳源对根状茎增殖的影响
兰花组织培养中应用较多的是蔗糖和葡萄糖,添加糖类物质主要是增加培养基中的渗透压,本试验除了这2种外,又增加了乳糖、果糖、木糖和麦芽糖4种碳源进行测试。图5显示,6种碳源中果糖对杂交莲瓣兰根状茎的侧枝和鲜质量的促进作用均为最佳,这与前人关于碳源对根状茎增殖影响的研究结果有所不同,可能跟莲瓣兰的植物特性以及杂交因素相关。另外侧枝增加效果接近果糖的碳源分别为蔗糖和葡萄糖,但是培养基中添加蔗糖和葡萄糖,莲瓣兰根状茎鲜质量增长率与果糖相比差距较大,而蔗糖和葡萄糖2种糖类间差异并不显著。增殖效果最差的为乳糖,增殖率和鲜质量增长率均为最低。
2.6 不同有机添加物对根状茎增殖的影响
天然复合物的成分一般比较复杂,以往的研究发现这些外来添加物可以有效地促进兰花组织增殖。本试验测试了椰汁、苹果汁、马铃薯、西红柿、蛋白胨和胰蛋白胨6种天然复合物,并设置1个空白对照(不添加复合物)。由图6可以看出,在添加蛋白胨的培养基上生长的根状茎增殖率最高,说明培养材料分枝最多,其次为空白对照,两者差异不显著,而空白对照的鲜质量增长率最高,说明在此条件下根状茎有机物积累速度最快,生长粗壮,不过与蛋白胨相比差异也不显著。

总体看,不加任何天然复合物的培养基对根状茎增殖效果最佳,而添加了复合物的培养基其促增殖作用大部分有不同程度的降低,说明添加复合物对此杂交莲瓣兰根状茎不利,对其生长会产生一定的阻碍作用,虽然蛋白胨、胰蛋白胨和椰汁等与空白对照的增殖效果相近,但考虑培养成本因素,最终确定不添加任何天然复合物为最佳条件。

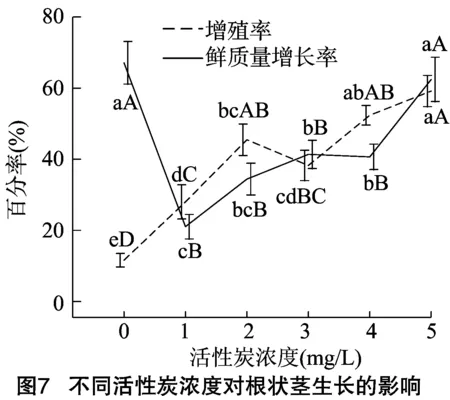
2.7 活性炭不同浓度对根状茎增殖的影响
活性炭对于调节培养基中有机物和植物生长调节剂的浓度具有十分重要的作用,本试验设置了6个浓度梯度测试其对根状茎增殖的影响。从图7可以看出,莲瓣兰根状茎增殖率和鲜质量增长率随着活性炭浓度的提高也发生较大的波动,不加活性炭时根状茎鲜质量增长率最高而增殖率最低,表明在此条件下根状茎有机物积累快但侧枝增长较少。活性炭浓度为5.0 g/L时根状茎侧枝生长最快,其鲜质量增长速度略低于不加活性炭时的水平,且差异不显著,其他活性炭浓度下,根状茎的生长均处于一般水平,因此培养基中添加活性炭的最适浓度应为5.0 g/L。
2.8 不同激素浓度搭配对根状茎分化的影响
目前最常用的激素是生长素和细胞分裂素,不同的浓度、种类和组合所起的作用不同。有关资料显示,兰花培养材料的分化一般需要较低浓度的生长素和高浓度的细胞分裂素搭配。本试验设置了9组激素配比进行测试,图8和图9分别表示不同激素配比组合对杂交莲瓣兰根状茎增殖和分化的影响。从图8中可以看出组合二(0.5 mg/L NAA+2.0 mg/L 6-BA)的分化率最高,接近100%,说明此种激素配比对根状茎分化影响最为显著,可以有效地促进杂交莲瓣兰根状茎快速发芽,其次是组合一(0.5 mg/L NAA+1.0 mg/L 6-BA)和组合三(0.5 mg/L NAA+4.0 mg/L 6-BA)的分化率较高,组合二与组合一差异不显著,与组合三差异显著(P<0.05)。另外从图8上看前3个组合的分化率明显比其他组合高很多,而它们的NAA浓度都为0.5 mg/L,说明较低浓度的NAA有利于杂交莲瓣兰的分化,这与前人研究结果相一致。结合图9可知,组合二的平均出芽数也较高,与最高者差异不显著,所以确定组合二为最佳促分化激素搭配。图9显示组合九(2.0 mg/L NAA+4.0 mg/L 6-BA)平均出芽数最高,说明高浓度的激素搭配能促使单个根状茎分化时出芽数量多,所以可以考虑将已经分化的根状茎转移到添加此激素配比的培养基上促进芽数量的增加,最终达到莲瓣兰苗又快又好生长发育的目的。


2.9 杂交莲瓣兰的分子鉴定
提取的DNA经过通用引物ITS1和ITS4扩增后,其ITS片段扩增电泳图见图10。图10显示杂交莲瓣兰的ITS片段大小接近750 bp,扩增的产物可以直接从PCR反应液中回收,然后送至铂尚生物技术有限公司测序,获得相应序列,正向序列大小为698 bp,反向序列大小为723 bp。登陆NCBI网站Blast并下载相近序列, 再使用MEGA5.05软件构建系统发育树(图11)。网站搜索显示最近的序列其相似度仅为96%,从构建的系统发育树上看此杂交种与选取的10种兰花都不在同一分支上,说明与它们的亲缘关系较远,而本株兰花是由莲瓣兰和墨兰接种杂交而成,之所以造成这种现象应该与杂交后代基因发生较大改变有关,总体说明此植株应为杂交后代。

3 讨论与结论
不同种兰花材料进行组织培养所需要的基本培养基和激素等物质是不同的,而同一种兰花材料在不同培养阶段需要的培养条件也不尽相同,因此对于具体的兰花品种及材料,培养条件的筛选是一项十分艰巨的任务。在兰花组织培养方面,通常对于春兰、寒兰、建兰和墨兰等研究较多,而对莲瓣兰的研究相对偏少,对于杂交品种的研究相比纯种也较少,所以往往在这些方面缺乏参考的依据。另一方面,由于兰花种子萌发率低[13],苗株生长周期长等问题制约了兰花的工厂化生产,杂交不失为一种生产新品种的手段,但是亲缘关系近的品种间容易杂交成功,而亲缘关系远的品种间就不容易获得成功[14]。在兰花组织培养过程中,基本培养基和激素对其影响往往最大,前人对其研究也最多[15],其次就是碳源、添加物和活性炭等方面,所以要找出最优组织培养条件,任重而道远。

本试验选取基本培养基,从NAA、6-BA、碳源、有机添加物和活性炭共6个方面进行最佳培养条件的筛选。综合考虑增殖率、鲜质量增长率、分化率和平均出芽数4个生长指标,确定N6培养基为最佳基本培养基;NAA浓度为0.5 mg/L有利于根状茎鲜质量的增加,为4.0 mg/L则有利于侧枝的生长;对碳源的选取以果糖效果最佳,这与以往的研究结果相比差异较大,可能跟植株的品种不同相关;不加天然复合物既有利于杂交莲瓣兰根状茎的增殖,又可以节约培养成本;活性炭浓度为5.0 g/L可以高效地促进根状茎的生长;0.5 mg/L NAA+2.0 mg/L 6-BA激素组合能够使根状茎快速分化,2.0 mg/L NAA+4.0 mg/L 6-BA激素组合可以使分化的根状茎产生更多的芽,2个激素组合如果在诱芽过程中搭配使用效果更好,最终可获得大量的幼苗,为后续移栽和诱花研究提供丰富的材料。杂交兰苗株的形态往往表现出父本和母本中和或者偏向于某一亲本的现象,由于周期较长,本试验未能从花型等特征进行辨别,而选取分子鉴定手段确定其为杂交品种。
