植物PTI天然免疫信号转导研究进展*
2018-10-11吕东平
杨 俊, 吕东平
植物PTI天然免疫信号转导研究进展*
杨 俊1,2, 吕东平1**
(1. 中国科学院遗传与发育生物学研究所农业资源研究中心 石家庄 050022; 2. 中国科学院大学 北京 100049)
病害是危害农业生产的重要因素之一, 植物对于病原菌的抗性依赖于植物的天然免疫(plant innate immunity)系统。因此, 对于植物天然免疫的研究将为农作物抗病育种提供重要理论基础。植物天然免疫系统包含彼此相互关联的两个层面, 即PTI(PAMP-triggered immunity)和ETI(effector-triggered immunity)。近年来, 国内外对于PTI的研究取得了一系列重要进展。PTI是由病原物相关分子模式PAMP(pathogen-associated molecular pattern)所诱发的植物免疫反应。PAMP被位于植物细胞表面的受体识别后, 将免疫信号通过胞质类受体激酶BIK1(Botrytis-induced kinase 1)、MAPK级联、CDPK(calcium-dependent protein kinase)等向下游传递, 诱导活性氧的爆发、气孔的关闭、免疫基因的表达等, 从而抑制病原微生物的生长。免疫信号在传递过程中会在多个层次上被精细调控, 以保证合适的反应强度和持续时间。本文从植物免疫受体FLS2及其他免疫受体的发现、免疫信号转导组分的发现以及其生物学功能、参与天然免疫的转录因子、植物免疫反应的负调控及植物天然免疫在抗病育种中的应用等方面综述了近年来植物PTI天然免疫的分子机理和信号转导方面的研究进展。并对该领域的发展提出展望, 我们认为农作物天然免疫信号转导和作物与致病真菌互作系统的研究将会是未来研究的重点和主要方向, 天然免疫的重要理论与基因编辑技术的结合, 必将使作物抗病育种迎来新时代。
植物天然免疫; 植物抗病; 病原菌相关分子模式(PAMP); 病原菌相关分子模式激发的免疫(PTI)
病害是危害农业生产的重要因素之一, 植物病害的发生往往会造成大范围的粮食减产。因此, 防止作物病害的大规模发生对于保障粮食安全具有重要意义。培育抗病品种是抵御作物病害的最为经济、环保的手段之一[1]。植物生活的环境中充满了各种各样的微生物, 如细菌、病毒和真菌等。古人云: “沉舟侧畔千帆过, 病树前头万木春”。对于绝大多数的植物, 它们都能够成功地抵御病原微生物的侵染, 这依赖于植物本身的天然免疫(plant innate immunity)系统。因此, 对于植物天然免疫的分子机理的研究可为作物抗病育种提供重要的理论支撑和基因资源。那么, 植物是如何识别病原微生物的?识别后, 信号又是如何传递, 从而使植物产生免疫反应以抵御病原微生物的侵染的呢?近年来, 国内外对于植物天然免疫信号转导(即植物从识别病原微生物, 到其最终产生抗病反应的信号传递过程)的研究取得了一系列重要进展, 并且成功地应用于作物抗病育种的实践中。本文扼要总结了最近20年来(1998—2018年)植物天然免疫的分子机理和信号转导的一些重要研究进展, 在此基础上试图对该领域的未来发展提出展望。
1 天然免疫的概念
植物天然免疫(innate immunity)这一概念沿用了动物的相关提法。动物的天然免疫是相对于动物的适应性免疫(adaptive immunity)而提出的。病原菌的一些保守的分子, 如细菌的脂多糖(lipopolysaccharide, LPS)等, 被动物细胞感知后, 会触发其产生免疫反应。早在20世纪90年代, 法国科学家Jules Hoffmann的研究团队用细菌或真菌侵染基因发生突变的果蝇(spp.)时, 发现该果蝇突变体因为不能产生有效的防御反应而死亡[2]。随后, 另一位来自美国的科学家Bruce Beutler领导的研究团队发现果蝇基因在小鼠()中的同源基因编码了动物细胞识别细菌脂多糖的受体, TLR4(toll-like receptor 4)。基因突变的小鼠比野生小鼠对革兰氏阴性菌的侵染更加敏感[3]。上述研究结果表明, 在动物细胞中存在一类免疫受体, 在它们识别了来自病原菌的一些保守的分子结构后, 会触发动物细胞产生免疫反应, 抑制病原菌的入侵。这一现象被称为天然免疫。Hoffmann和Beutler的发现引起人们对天然免疫研究的广泛兴趣。因为在天然免疫研究中的开创性工作和重大贡献, 他们共同分享了2011年的诺贝尔生理医学奖。
2 植物免疫受体FLS2的发现
植物天然免疫的发现稍晚于动物。早在20世纪90年代, 科学家发现植物也可以识别一些微生物共有的且高度保守的分子, 如一些细菌的蛋白质、多糖、糖蛋白和脂多糖(LPS)等。因为这些分子结构能诱导植物产生一些与植物抗病相关的反应, 所以它们被统称为诱导子(elicitors)[4-5]。细菌的鞭毛蛋白是一种典型的诱导子。鞭毛对于细菌的运动至关重要。人工合成的细菌鞭毛蛋白N端保守区域的22个氨基酸的肽段(flg22)可以诱导植物病程相关基因的表达, 植物的胼胝质累积, 以及抑制植物的生长[6]。2001年, 英国科学家Thomas Boller的研究团队利用正向遗传学的方法, 筛选获得了对flg22不敏感的拟南芥()突变体。从而鉴定到了拟南芥中识别flg22的受体蛋白FLS2。FLS2是一个类受体激酶(receptor-like kinase)成员。FLS2主要由胞内的激酶结构域、跨膜结构域和胞外的亮氨酸富集重复(leucine-rcih repeat, LRR)结构域组成[7](图1)。FLS2的发现奠定了植物天然免疫研究的基础。
随后, 由Jen Sheen领导的研究团队系统地提出了植物天然免疫的概念[4]。Flg22、LPS等诱导子被称为病原菌相关的分子模式(pathogen-associated molecular pattern, PAMP)。而位于植物细胞表面识别PAMP的受体被称为模式识别受体(PRR, pattern recognition receptor)。由PAMP激发的天然免疫反应被称为PTI (PAMP-triggered Immunity)[8-9]。植物、昆虫和哺乳动物的PTI天然免疫信号通路具有一定的保守性。除了PTI, 植物还存在另外一个层次的天然免疫反应——ETI(effector triggered immunity), 即由细菌分泌的效应因子激发的天然免疫反应[10-11]。本文重点讨论PTI, 有关ETI可参考其他的综述论文。
3 其他免疫受体的发现
除了FLS2, 植物其他的模式识别受体, 如EFR (EF-Tu receptor)、CERK1(chitin elicitor receptor kinase 1)等也陆续被发现。
3.1 EFR的发现
细菌的翻译延伸因子EF-Tu也可以作为PAMP激发植物的天然免疫反应。利用EF-Tu的保守肽段elf18处理植物, 也能引起植物产生天然免疫反应, 包括MAPK(mitogen-activated protein kinase)的激活、活性氧(ROS)的爆发、植物生长的抑制和对丁香假单胞菌(pv.)抗性的增强等[12]。2006年, 同样是由Thomas Boller领导的研究团队利用反向遗传学的方法, 从众多的受体激酶中鉴定出能够识别EF-Tu的受体EFR[13]。EFR在结构上与FLS2类似, 也是由胞外的LRR区、跨膜区和胞内的激酶区组成(图1)。值得注意的是, 与FLS2不同,基因只分布于十字花科(Brassicaceae)植物[13]。
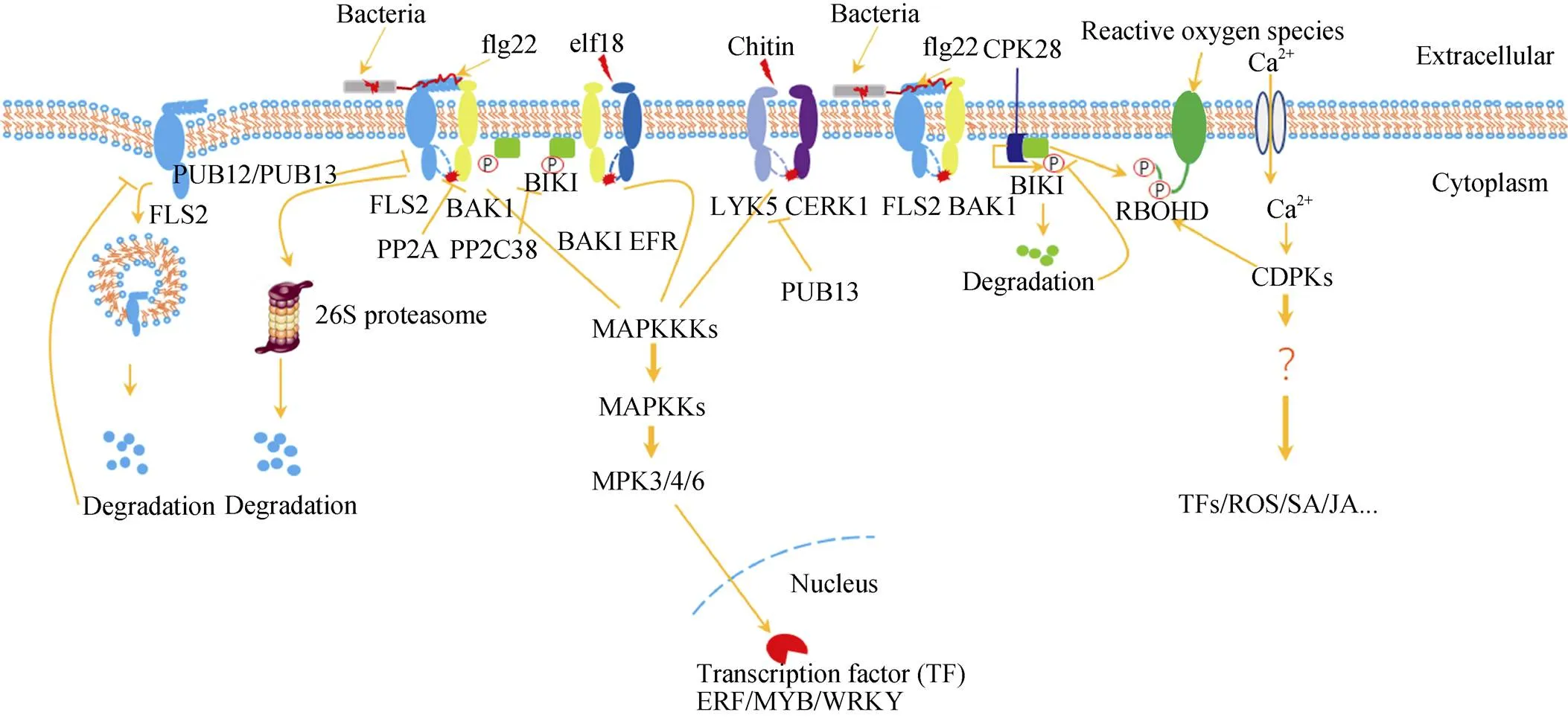
图1 拟南芥中PTI信号通路
3.2 几丁质受体的发现
几丁质(chitin)是真菌细胞壁的重要成分, 也可以作为PAMP诱导植物的免疫反应, 如MAPK级联反应的激活、ROS的爆发以及免疫相关基因的表达[14-15]。2006年, 研究人员发现水稻()中的OsCEBiP (chitin elicitor-binding protein)蛋白是真菌几丁质的受体。但是, 与FLS2和EFR不同的是, OsCEBiP没有胞内激酶结构域[5]。因而, 水稻中很可能存在其他蛋白, 它们与OsCEBiP形成受体复合物, 共同完成免疫信号的传导。2010年, 研究者在水稻中发现了拟南芥类受体激酶chitin elicitor receptor kinase 1(CERK1)的同源蛋白OsCERK1。几丁质能够诱导OsCEBiP和OsCERK1形成受体复合物。这样, 在水稻中几丁质诱发的PTI免疫信号可以通过OsCERK1的胞内激酶结构域向下游传递[15]。
尽管拟南芥具有与水稻OsCEBiP同源的LYM2蛋白, 而且LYM2也可以与几丁质结合, 但是它不参与拟南芥中几丁质诱导的PTI信号转导, 这表明拟南芥识别几丁质的方式与水稻不同[16]。拟南芥的CERK1在胞外具有3个LysM结构域, 在胞内具有一个能发生自我磷酸化的Ser/Thr激酶结构域。CERK1能参与几丁质诱导的免疫信号转导, 如MAPK的激活、ROS的爆发以及免疫相关基因的表达[14]。原核细胞表达纯化的CERK1也能够在体外直接结合几丁质[17]。所以, 拟南芥的CERK1一度被认为是几丁质的主要受体。2014年, Cao等[18]发现拟南芥中几丁质的主要模式识别受体是LYK5 (lysin motif receptor kinase 5)。而CERK1可能是LYK5的共受体。LYK5与CERK1(LYK1)同属于LYK基因家族[19]。当存在几丁质时, LYK5与几丁质结合, 诱导LYK5与CERK1的结合, 向下游传递免疫信号[18](图1)。
4 免疫信号转导组分的发现及其生物学功能研究
4.1 BAK1在天然免疫信号转导中的功能
FLS2和EFR等免疫受体可以识别来自病原菌的PAMPs。那么, 在模式识别受体与相应的PAMP结合之后, 免疫信号是如何进一步传递的呢? 2007年, 国际上两个不同的实验室几乎同时独立发现了另一个受体激酶BAK1(BRI1 associated receptor kinase 1)能够参与PTI免疫信号传递[20-21]。在此之前, 已有报道表明BAK1能够与植物激素油菜素内酯的受体BRI1结合, 参与该激素的信号转导[22]。在植物天然免疫信号转导过程中, flg22可以诱导FLS2与BAK1形成免疫受体复合物。同样, 在elf18的诱导下, BAK1也可以与EFR结合[20]。而且, BAK1能够磷酸化FLS2, 二者可以相互激活对方的激酶活性[23](图1)。
2013年, 我国的两个科研团队合作, 解析了flg22-FLS2-BAK1复合物的晶体结构。flg22-FLS2- BAK1是第1个被解析的植物LRR类模式识别受体复合物。FLS2胞外域通过其螺线状凹面的连续β-片层来识别flg22。而其共受体BAK1通过其N端的帽子结构直接接触flg22的C末端。并且, BAK1与FLS2有广泛的直接相互作用, 表明它们可能在FLS2识别flg22之前就预先形成了复合物, 这样可能有利于植物对病原菌的入侵做出更为快速的反应[24]。
4.2 BIK1在天然免疫信号转导中的功能
胞质类受体激酶(receptor-like cytoplasmic kinase)BIK1(Botrytis-induced kinase 1)可以将免疫信号从位于细胞表面的免疫受体向下游传递[25-26]。与受体激酶相比, 胞质类受体激酶只有激酶结构域而没有胞外域和跨膜结构域[27]。BIK1能和FLS2发生相互作用。而且, 在flg22诱导下, BIK1迅速发生磷酸化并与FLS2蛋白分离。BIK1同样也能分别与EFR和CERK1发生相互作用。在elf18或几丁质诱导后, BIK1蛋白会发生磷酸化并与EFR或CERK1解离。用flg22处理突变体后, ROS爆发和免疫基因表达明显弱于野生植物, 这表明BIK1参与PTI信号转导的正调控[25-26,28]。
之后, 周俭民领导的研究团队和英国Zipfel领导的研究团队分别独立地解析了BIK1参与天然免疫信号转导的机理。BIK1通过磷酸化NADPH氧化酶RbohD(respiratory burst oxidase homologue D)来控制ROS的爆发[29-30](图1)。RbohD蛋白具有6个跨膜结构域, 这使得其定位于细胞质膜。它还有FAD和NADPH的结合位点、N端负责结合Ca2+离子的EF-hand, 以及氧化酶功能区。RbohD能够直接催化ROS的产生[31]。ROS的爆发能够正反馈调节Ca2+离子信号, 促进Ca2+离子的细胞内流, 而Ca2+离子内流能够引起气孔关闭[31]。BIK1对RbohD的磷酸化主要发生在Ser39和Ser343位点。这两个位点的磷酸化激活了RbohD的活性, 引起ROS的积累。而ROS的积累导致气孔关闭。当病原菌侵染宿主时, 首先需要它们能进入宿主体内。气孔是病原菌入侵植物的重要途径。气孔保卫细胞的FLS2识别flg22后, 将免疫信号传递给BIK1-RbohD, 导致ROS的爆发和气孔的关闭, 最终限制病原菌通过气孔入侵植物叶片[30,32-33]。
4.3 MAPK级联在天然免疫信号转导中的功能
MAPK级联途径(MAPK cascade)存在于几乎所有的真核生物中, 在多个信号途径中发挥重要作用, 如动物中MAPK p38的活性与肿瘤的发生有关[34]。MAPK级联途径包含三级磷酸化反应。其三级成员依次为促分裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK), 磷酸化MAPK的促分裂原活化蛋白激酶激酶(mitogen-activated protein kinase kinase, MAPKK), 和磷酸化MAPKK的促分裂原活化蛋白激酶激酶激酶(mitogen-activated protein kinase kinase kinase, MAPKKK)[35-36]。拟南芥基因组编码约20个MAPK、10个MAPKK和60个MAPKKK蛋白。在不同条件下, 这些蛋白通过不同的三级组合形成了复杂的MAPK信号通路。MAPK被激活后, 能够进一步磷酸化下游的底物蛋白, 使信号向下游传递[36]。比如, MAPK级联反应可以通过磷酸化WRKY转录因子来控制免疫相关基因的转录[37]。
2002年, Jen Sheen领导的研究团队发现, 当FLS2识别flg22后, 可以激发MAPK级联反应(图1)。该团队鉴定了一条完整的MAPK级联反应途径: MEKK1—MKK4/MKK5—MPK3/MPK6[4]。后来, 其他研究团队发现, 用flg22处理植物后, MEKK1并不能激活MPK3/6, 但能够激活MPK4。所以, MEKK1可能不是MKK4/MKK5—MPK3/MPK6上游的MEKK[38-42]。进一步的研究发现, MPK3和MPK6磷酸化转录因子WRKY22和WRKY29, 来正调控植物的PTI反应[4]。2008年, 有两个研究组报道了拟南芥中的另外一条MAPK级联反应途径: MEKK1— MKK1/2—MPK4[42]。而MPK4通过与WRKY25、WRKY33和MKS1(MPK4-interacting protein)的互作来调节下游免疫相关基因的表达, 从而调控植物的PTI反应[43]。
4.4 CDPK在天然免疫信号转导中的功能
早在20世纪90年度初, Harper等[44]就在大豆()中发现了能够与Ca2+结合的CDPK (calcium-dependent protein kinase)蛋白。Cheng等[45]通过预测发现拟南芥CDPK基因家族共有34个成员。CDPK蛋白包含1个位于N端的可变结构域、1个丝氨酸/苏氨酸激酶结构域、1个类钙调蛋白结构域(calmodulin-like domain, CaM-LD)和1个自抑制结构域。CaM-LD结构域含有4个负责与Ca2+结合的EF-hand。在非激活状态下, 自抑制结构域与激酶结构域结合, 从而抑制了激酶结构域的活性。而当Ca2+存在时, 蛋白构象发生改变, 激酶结构域和自抑制结构域发生分离, 激活激酶结构域, 从而调节下游的信号转导[46-47]。
Boudsocq等[47]发现, 拟南芥的CDPK4、CDPK5、CDPK6和CDPK11能够参与天然免疫信号的传递。四重突变体中, flg22诱导的ROS的爆发和对病原菌的抗性都明显减弱(图1)。Dubiella等[32]发现flg22能够诱导CDPK5蛋白发生磷酸化, 而且CDPK5能够磷酸化RbohD蛋白, 由此来调控活性氧的爆发。然而, CDPK蛋白并不影响flg22诱导的MAPK的激活, 这表明CDPK和MAPK可能是两条独立的信号转导途径[47]。
5 MAPK和CDPK下游参与天然免疫的转录因子
植物免疫信号通路中, MAPK和CDPK可以通过磷酸化修饰下游的转录因子来调控植物免疫相关基因的表达。植物中有很多类型的转录因子, 目前发现的主要是ERF、MYB、TGA和WRKY这4个基因家族的转录因子, 它们通过调节下游基因的表达, 调控植物免疫[48]。
ERF家族的转录因子ERF6, 能够被MPK3/MPK6磷酸化。磷酸化的ERF6能够激活植物免疫相关基因的表达, 使植物增强对病原菌的抗性[49]。另外, 根据蛋白质空间结构, 预测到MYB家族的131个成员中有41个成员可能与MAPK3发生相互作用[50]。进一步研究表明, 当MAPK信号通路激活后, MYB家族的转录因子MYB44被MPK3磷酸化, 激活其转录活性, 调节植物免疫相关基因的转录[51]。
基因家族成员也广泛地参与植物免疫。WRKY46是MPK3的底物, WRKY46的过表达能够增强免疫相关基因的表达, 增强植物抗病能力[52]。烟草()的WRKY1能够被MAPK类激酶SIPK(salicylic acid-induced protein kinase)磷酸化, 从而引起植物的超敏反应, 造成植物细胞的死亡[53]。同样, SIPK也能催化WRKY8在多个位点发生磷酸化, 从而使下游免疫基因的表达增强[54]。
6 植物免疫反应的负调控
植物天然免疫信号必须受到精细的调节, 因为过度的免疫反应会对植物造成伤害。植物免疫反应的负调控可以通过对免疫信号通路中的一些主要组分进行泛素化、去磷酸化等修饰得以实现。
6.1 FLS2的降解
FLS2在配体诱导下可以发生内吞作用。植物被flg22处理后, FLS2从细胞质膜上转移到囊泡上, 最终可能发生降解, 从而负调控由flg22诱发的免疫反应[55-56]。2011年, Lu等[57]发现了两个E3泛素连接酶PUB12和PUB13, 它们在BAK1的介导下与FLS2互作, 使FLS2发生泛素化修饰, 最终使FLS2发生降解, 负调控flg22引起的免疫反应(图1)。
6.2 通过BAK1负调控天然免疫
Segonzac等[58]发现蛋白磷酸酶PP2A(protein Ser/Thr phosphatase type 2A)能作用于BAK1, 并使BAK1发生去磷酸化, 从而负调控天然免疫反应。Halter等[59]发现BIR2(BAK1-interacting RLK2)通过与BAK1互作调控天然免疫信号转导。当没有flg22时, BIR2能够与BAK1结合, 阻止BAK1与FLS2的结合; 而当植物受到flg22处理后, BIR2能够从BAK1上解离, 然后BAK1与FLS2组成复合物, 传递免疫信号。
6.3 通过BIK1负调控天然免疫
CDPK28能够与BIK1结合, 并磷酸化BIK1, 从而影响BIK1的稳定性, 实现对植物免疫的负调控[28,60]。蛋白磷酸酶PP2C38也能够负调控BIK1。PP2C38通过与BIK1、FLS2或EFR的动态结合, 调节PAMP引起的BIK1的磷酸化, 影响BIK1对RbohD的磷酸化, 最终抑制PAMP诱导的ROS产生以及气孔关闭, 负调控植物免疫[61](图1)。
6.4 LYK5的降解
最新研究发现, E3泛素连接酶PUB13不仅能够泛素化免疫受体FLS2, 也能泛素化几丁质受体LYK5, 从而影响其蛋白的稳定性, 最终调控由几丁质触发的植物免疫反应[62](图1)。
7 植物天然免疫在抗病育种中的应用
植物天然免疫研究中的一些重要发现已在作物抗病育种中体现出良好的应用前景。比如, 拟南芥基因只分布在十字花科植物中[13,63]。那么, 在烟草以及重要农作物水稻和小麦()中表达拟南芥的, 是否会使这些非十字花科植物也能够识别细菌延伸因子EF-Tu, 从而增强它们的抗性呢?研究表明, 在烟草中过表达拟南芥的EFR, 能够使烟草获得识别细菌EF-Tu的能力, 从而增强烟草的抗病能力[63]。在水稻中过表达拟南芥的基因, 能够使水稻识别白叶枯病菌(pv.,)的EF-Tu, 增强水稻细胞中ROS的爆发及MAPK级联反应的激活, 从而提高水稻对白叶枯菌的抗性[64]。研究表明, 在水稻中表达拟南芥的不会对水稻的生长和产量产生影响, 显示了很好的应用前景[65]。用flg22和几丁质处理小麦, 都能够诱导小麦PTI标志基因的表达, 说明小麦中也存在PTI信号通路。同样, 在小麦中转入拟南芥的基因, 发现转基因小麦能够对细菌的保守肽段elf18的处理做出响应, 并且能够增强小麦对丁香假单胞菌(pv)的抗性[66]。这些研究表明, 在单子叶植物中表达拟南芥的基因, 能够增强植物的天然免疫。这为植物抗病育种提供了一种新思路。
8 展望
20世纪90年代以来, 科学家对植物天然免疫信号转导已经进行了广泛而深入的研究。一系列重要的免疫受体和信号转导组分被陆续鉴定。信号转导的多种调控机制也被发现。但是, 这些研究主要集中于模式植物拟南芥与丁香假单胞菌的植物-病原菌互作系统。农作物如水稻和小麦, 它们的主要病害多数是由病原真菌引起, 如水稻的稻瘟病, 小麦的锈病、白粉病和赤霉病等。因此, 对于农作物天然免疫信号转导和作物与致病真菌互作系统的研究将会是未来研究的重点和方向。近年来, 基因编辑技术在植物领域取得了长足的发展和广泛的应用。白粉病是小麦的重要病害, 严重影响了小麦的生产。中国科学院遗传与发育生物学研究所高彩霞研究组, 利用基因组编辑技术, 在小麦中对基因的3个拷贝同时进行了突变, 获得了对白粉病具有广谱抗性的小麦材料[67]。因此, 天然免疫的重要理论与基因编辑技术的结合, 必将使作物抗病育种迎来新时代。
[1] 刘天华, 白姣姣, 吕东平. 农业气象因素影响稻瘟病发生分子机制初探[J]. 中国生态农业学报, 2016, 24(1): 1–7 LIU T H, BAI J J, LYU D P. A preliminary study on the effect of agro-meteorological factors on molecular mechanism of rice blast occurrence[J]. Chinese Journal of Eco-Agriculture, 2016, 24(1): 1–7
[2] LEMAITRE B, REICHHART J M, HOFFMANN J A.host defense: Differential induction of antimicrobial peptide genes after infection by various classes of microorganisms[J]. Proceedings of the National Academy of Sciences of the United States of America, 1997, 94(26): 14614–14619
[3] POLTORAK A, HE X L, SMIRNOVA I, et al. Defective LPS signaling in C3H/HeJ and C57BL/10ScCr mice: Mutations ingene[J]. Science, 1998, 282(5396): 2085–2088
[4] ASAI T, TENA G, PLOTNIKOVA J, et al. MAP kinase signalling cascade ininnate immunity[J]. Nature, 2002, 415(6875): 977–983
[5] KAKU H, NISHIZAWA Y, ISHII-MINAMI N, et al. Plant cells recognize chitin fragments for defense signaling through a plasma membrane receptor[J]. Proceedings of the National Academy of Sciences of the United States of America, 2006, 103(29): 11086–11091
[6] GÓMEZ-GÓMEZ L, BOLLER T. FLS2: An LRR receptor-like kinase involved in the perception of the bacterial elicitor flagellin in[J]. Molecular Cell, 2000, 5(6): 1003–1011
[7] GÓMEZ-GÓMEZ L, BAUER Z, BOLLER T. Both the extracellular leucine-rich repeat domain and the kinase activity of FLS2 are required for flagellin binding and signaling in arabidopsis[J]. The Plant Cell, 2001, 13(5): 1155–1163
[8] NÜRNBERGER T, BRUNNER F, KEMMERLING B, et al. Innate immunity in plants and animals: Striking similarities and obvious differences[J]. Immunological Reviews, 2004, 198(1): 249–266
[9] KUMAR H, KAWAI T, AKIRA S. Pathogen recognition by the innate immune system[J]. International Reviews of Immunology, 2011, 30(1): 16–34
[10] CHISHOLM S T, COAKER G, DAY B, et al. Host-microbe interactions: Shaping the evolution of the plant immune response[J]. Cell, 2006, 124(4): 803–814
[11] MEDZHITOV R. Recognition of microorganisms and activation of the immune response[J]. Nature, 2007, 449(7164): 819–826
[12] KUNZE G, ZIPFEL C, ROBATZEK S, et al. The N terminus of bacterial elongation factor Tu elicits innate immunity in Arabidopsis plants[J]. The Plant Cell, 2004, 16(12): 3496–3507
[13] ZIPFEL C, KUNZE G, CHINCHILLA D, et al. Perception of the bacterial PAMP EF-Tu by the receptor EFR restricts-mediated transformation[J]. Cell, 2006, 125(4): 749–760
[14] MIYA A, ALBERT P, SHINYA T, et al. CERK1, a LysM receptor kinase, is essential for chitin elicitor signaling in[J]. Proceedings of the National Academy of Sciences of the United States of America, 2007, 104(49): 19613–19618
[15] SHIMIZU T, NAKANO T, TAKAMIZAWA D, et al. Two LysM receptor molecules, CEBiP and OsCERK1, cooperatively regulate chitin elicitor signaling in rice[J]. The Plant Journal, 2010, 64(2): 204–214
[16] LIU T T, LIU Z X, SONG C J, et al. Chitin-induced dimerization activates a plant immune receptor[J]. Science, 2012, 336(6085): 1160–1164
[17] SHINYA T, MOTOYAMA N, IKEDA A, et al. Functional characterization of CEBiP and CERK1 homologs in arabidopsis and rice reveals the presence of different chitin receptor systems in plants[J]. Plant and Cell Physiology, 2012, 53(10): 1696–1706
[18] CAO Y R, LIANG Y, TANAKA K, et al. The kinase LYK5 is a major chitin receptor in Arabidopsis and forms a chitin-induced complex with related kinase CERK1[J]. eLife, 2014, 3(2): e03766
[19] WAN J R, TANAKA K, ZHANG X C, et al. LYK4, a lysin motif receptor-like kinase, is important for chitin signaling and plant innate immunity in Arabidopsis[J]. Plant Physiology, 2012, 160(1): 396–406
[20] CHINCHILLA D, ZIPFEL C, ROBATZEK S, et al. A flagellin-induced complex of the receptor FLS2 and BAK1 initiates plant defence[J]. Nature, 2007, 448(7152): 497–500
[21] HEESE A, HANN D R, GIMENEZ-IBANEZ S, et al. The receptor-like kinase SERK3/BAK1 is a central regulator of innate immunity in plants[J]. Proceedings of the National Academy of Sciences of the United States of America, 2007, 104(29): 12217–12222
[22] LI J, WEN J Q, LEASE K A, et al. BAK1, anLRR receptor-like protein kinase, interacts with BRI1 and modulates brassinosteroid signaling[J]. Cell, 2002, 110(2): 213–222
[23] SCHULZE B, MENTZEL T, JEHLE A K, et al. Rapid heteromerization and phosphorylation of ligand-activated plant transmembrane receptors and their associated kinase BAK1[J]. Journal of Biological Chemistry, 2010, 285(13): 9444–9451
[24] SUN Y D, LI L, MACHO A P, et al. Structural basis for flg22-induced activation of theFLS2-BAK1 immune complex[J]. Science, 2013, 342(6158): 624–628
[25] LU D P, WU S J, GAO X Q, et al. A receptor-like cytoplasmic kinase, BIK1, associates with a flagellin receptor complex to initiate plant innate immunity[J]. Proceedings of the National Academy of Sciences of the United States of America, 2010, 107(1): 496–501
[26] ZHANG J, LI W, XIANG T T, et al. Receptor-like cytoplasmic kinases integrate signaling from multiple plant immune receptors and are targeted by aeffector[J]. Cell Host & Microbe, 2010, 7(4): 290–301
[27] ZIPFEL C. Plant pattern-recognition receptors[J]. Trends in Immunology, 2014, 35(7): 345–351
[28] MONAGHAN J, MATSCHI S, SHORINOLA O, et al. The calcium-dependent protein kinase CPK28 buffers plant immunity and regulates BIK1 turnover[J]. Cell Host & Microbe, 2014, 16(5): 605–615
[29] KADOTA Y, SKLENAR J, DERBYSHIRE P, et al. Direct regulation of the NADPH Oxidase RBOHD by the PRR-associated kinase BIK1 during plant immunity[J]. Molecular Cell, 2014, 54(1): 43–55
[30] LI L, LI M, YU L P, et al. The FLS2-associated kinase BIK1 directly phosphorylates the NADPH oxidase RbohD to control plant immunity[J]. Cell Host & Microbe, 2014, 15(3): 329–338
[31] KADOTA Y, SHIRASU K, ZIPFEL C. Regulation of the NADPH oxidase RBOHD during plant immunity[J]. Plant & Cell Physiology, 2015, 56(8): 1472–1480
[32] DUBIELLA U, SEYBOLD H, DURIAN G, et al. Calcium-dependent protein kinase/NADPH oxidase activation circuit is required for rapid defense signal propagation[J]. Proceedings of the National Academy of Sciences of the United States of America, 2013, 110(21): 8744–8749
[33] RANF S, ESCHEN-LIPPOLD L, FRÖHLICH K, et al. Microbe-associated molecular pattern-induced calcium signaling requires the receptor-like cytoplasmic kinases, PBL1 and BIK1[J]. BMC Plant Biology, 2014, 14: 374
[34] GUPTA J, IGEA A, PAPAIOANNOU M, et al. Pharmacological inhibition of p38 MAPK reduces tumor growth in patient-derived xenografts from colon tumors[J]. Oncotarget, 2015, 6(11): 8539–8551
[35] ADACHI H, NAKANO T, MIYAGAWA N, et al. WRKY transcription factors phosphorylated by MAPK regulate a plant immune NADPH oxidase in[J]. The Plant Cell, 2015, 27(9): 2645–2663
[36] MIZOGUCHI T, ICHIMURA K, SHINOZAKI K. Environmental stress response in plants: The role of mitogen-activated protein kinases[J]. Trends in Biotechnology, 1997, 15(1): 15–19
[37] MENG X Z, ZHANG S Q. MAPK cascades in plant disease resistance signaling[J]. Annual Review of Phytopathology, 2013, 51: 245–266
[38] ICHIMURA K, CASAIS C, PECK S C, et al. MEKK1 is required for MPK4 activation and regulates tissue-specific and temperature-dependent cell death in[J]. Journal of Biological Chemistry, 2006, 281(48): 36969–36976
[39] NAKAGAMI H, SOUKUPOVÁ H, SCHIKORA A, et al. A mitogen-activated protein kinase kinase kinase mediates reactive oxygen species homeostasis in[J]. Journal of Biological Chemistry, 2006, 281(50): 38697–38704
[40] SU S H, SUAREZ-RODRIGUEZ M C, KRYSAN P. Genetic interaction and phenotypic analysis of theMAP kinase pathway mutationsandsuggests signaling pathway complexity[J]. FEBS Letters, 2007, 581(17): 3171–3177
[41] SUAREZ-RODRIGUEZ M C, ADAMS-PHILLIPS L, LIU Y D, et al. MEKK1 is required for flg22-induced MPK4 activation inplants[J]. Plant Physiology, 2007, 143(2): 661–669
[42] GAO M H, LIU J M, BI D L, et al. MEKK1, MKK1/MKK2 and MPK4 function together in a mitogen-activated protein kinase cascade to regulate innate immunity in plants[J]. Cell Research, 2008, 18(12): 1190–1198
[43] NICAISE V, ROUX M, ZIPFEL C. Recent advances in PAMP-triggered immunity against bacteria: Pattern recognition receptors watch over and raise the alarm[J]. Plant Physiology, 2009, 150(4): 1638–1647
[44] HARPER J F, SUSSMAN M R, SCHALLER G E, et al. A calcium-dependent protein kinase with a regulatory domain similar to calmodulin[J]. Science, 1991, 252(5008): 951–954
[45] CHENG S H, WILLMANN M R, CHEN H C, et al. Calcium signaling through protein kinases. The arabidopsis calcium-dependent protein kinase gene family[J]. Plant Physiology, 2002, 129(2): 469–485
[46] BOUDSOCQ M, SHEEN J. CDPKs in immune and stress signaling[J]. Trends in Plant Science, 2013, 18(1): 30–40
[47] BOUDSOCQ M, WILLMANN M R, MCCORMACK M, et al. Differential innate immune signalling via Ca2+sensor protein kinases[J]. Nature, 2010, 464(7287): 418–422
[48] CHEN W Q, PROVART N J, GLAZEBROOK J, et al. Expression profile matrix oftranscription factor genes suggests their putative functions in response to environmental stresses[J]. The Plant Cell, 2002, 14(3): 559–574
[49] MENG X Z, XU J, HE Y X, et al. Phosphorylation of an ERF transcription factor byMPK3/MPK6 regulates plant defense gene induction and fungal resistance[J]. The Plant Cell, 2013, 25(3): 1126–1142
[50] GIRI P, KUMAR A, TAJ G.-prediction of downstream MYB interacting partners of MAPK3 in[J]. Bioinformation, 2014, 10(12): 721–725
[51] PERSAK H, PITZSCHKE A. Tight interconnection and multi-level control of Arabidopsis MYB44 in MAPK cascade signalling[J]. PLoS One, 2013, 8(2): e57547
[52] SHEIKH A H, ESCHEN-LIPPOLD L, PECHER P, et al. Regulation of WRKY46 transcription factor function by mitogen-activated protein kinases in[J]. Frontiers in Plant Science, 2016, 7: 61
[53] MENKE F L H, KANG H G, CHEN Z X, et al. Tobacco transcription factor WRKY1 is phosphorylated by the MAP kinase SIPK and mediates HR-like cell death in tobacco[J]. Molecular Plant-Microbe Interactions, 2005, 18(10): 1027–1034
[54] ISHIHAMA N, YAMADA R, YOSHIOKA M, et al. Phosphorylation of theWRKY8 transcription factor by MAPK functions in the defense response[J]. The Plant Cell, 2011, 23(3): 1153–1170
[55] ROBATZEK S, CHINCHILLA D, BOLLER T. Ligand- induced endocytosis of the pattern recognition receptor FLS2 in[J]. Genes & Development, 2006, 20(5): 537–542
[56] SMITH J M, SALAMANGO D J, LESLIE M E, et al. Sensitivity to flg22 is modulated by ligand-induced degradation and de Novo synthesis of the endogenous flagellin-receptor FLAGELLIN- SENSING2[J]. Plant Physiology, 2014, 164(1): 440–454
[57] LU D P, LIN W W, GAO X Q, et al. Direct ubiquitination of pattern recognition receptor FLS2 attenuates plant innate immunity[J]. Science, 2011, 332(6036): 1439–1442
[58] SEGONZAC C, MACHO A P, SANMARTÍN M, et al. Negative control of BAK1 by protein phosphatase 2A during plant innate immunity[J]. The EMBO Journal, 2014, 33(18): 2069–2079
[59] HALTER T, IMKAMPE J, MAZZOTTA S, et al. The leucine-rich repeat receptor kinase BIR2 is a negative regulator of BAK1 in plant immunity[J]. Current Biology, 2014, 24(2): 134–143
[60] MONAGHAN J, MATSCHI S, ROMEIS T, et al. The calcium-dependent protein kinase CPK28 negatively regulates the BIK1-mediated PAMP-induced calcium burst[J]. Plant Signaling & Behavior, 2015, 10(5): e1018497
[61] COUTO D, NIEBERGALL R, LIANG X X, et al. Theprotein phosphatase PP2C38 negatively regulates the central immune kinase BIK1[J]. PLoS Pathogens, 2016, 12(8): e1005811
[62] LIAO D H, CAO Y R, SUN X, et al. Arabidopsis E3 ubiquitin ligase PLANT U-BOX13 (PUB13) regulates chitin receptor LYSIN MOTIF RECEPTOR KINASE5 (LYK5) protein abundance[J]. New Phytologist, 2017, 214(4): 1646–1656
[63] LACOMBE S, ROUGON-CARDOSO A, SHERWOOD E, et al. Interfamily transfer of a plant pattern-recognition receptor confers broad-spectrum bacterial resistance[J]. Nature Biotechnology, 2010, 28(4): 365–369
[64] LU F, WANG H Q, WANG S Z, et al. Enhancement of innate immune system in monocot rice by transferring the dicotyledonous elongation factor Tu receptor EFR[J]. Journal of Integrative Plant Biology, 2015, 57(7): 641–652
[65] SCHWESSINGER B, BAHAR O, THOMAS N, et al. Transgenic expression of the dicotyledonous pattern recognition receptor EFR in rice leads to ligand-dependent activation of defense responses[J]. PLoS Pathogens, 2015, 11(3): e1004809
[66] SCHOONBEEK H J, WANG H H, STEFANATO F L, et al. Arabidopsis EF-Tu receptor enhances bacterial disease resistance in transgenic wheat[J]. New Phytologist, 2015, 206(2): 606–613
[67] SHAN Q, WANG Y, LI J, et al. Targeted genome modification of crop plants using a CRISPR-Cas system[J]. Nature Biotechnology, 2013, 31(8): 686–688
Advances in signal transduction of PAMP-triggered immunity in plants*
YANG Jun1,2, LYU Dongping1**
(1. Center for Agricultural Resources Research, Institute of Genetics and Developmental Biology, Chinese Academy of Sciences, Shijiazhuang 050022, China; 2. University of Chinese Academy of Sciences, Beijing 100049, China)
Plant disease is one of the most important factors adversely affecting agricultural production. The resistance of plants to pathogens depends on the plant innate immunity system. The study on plant innate immunity will provide insight into the breeding of disease-resistant crops. Plant innate immunity is composed of two intertwined layers: PTI (PAMP-triggered immunity) and ETI (effector-triggered immunity). In recent years, a series of significance progress has been made in the study of PTI, which is triggered by PAMPs (pathogen-associated molecular patterns). Upon the perception of PAMPs by the cell surface-localized receptors, the immune signaling is transduced through receptor-like cytoplasmic kinase (RLCK) BIK1 (Botrytis-induced kinase 1), MAPK (mitogen-activated protein kinase) cascade, and CDPKs (calcium-dependent protein kinase), resulting in ROS (reactive oxygen species) burst, stomata closure, and expression of immune-related genes, which limit the colonization of infectious pathogens. Importantly, the innate immunity is regulated at different levels to ensure the optimal intensity and duration of immune responses. In this paper, we reviewed the advances in the molecular mechanisms and signal transduction of PTI in recent years, including the discoveries of FLS2 and other immune receptors, the functions of diverse components of innate immunity signal transduction pathway, the transcription factors involved in innate immunity, the regulation of immune signaling, and the application of innate immunity in the disease-resistance breeding. We also discussed future perspectives, and we thought that the studies on innate immunity signaling in crops and crop-fungi patho-system should be given the highest priority. Furthermore, the combination of the theories of plant innate immunity with the gene editing technologies would definitely provide new opportunities for crop disease-resistance breeding.
Plant innate immunity; Plant defense; PAMP (pathogen-associated molecular pattern); PTI (PAMP-triggered immunity)
Supported by the National Natural Science Foundation of China (31371247)
Corresponding author, E-mail: dplu@sjziam.ac.cn
May 10, 2018;
Jun. 6, 2018
10.13930/j.cnki.cjea.180533
S332.2
A
1671-3990(2018)10-1585-08
通信作者:吕东平, 主要研究方向为植物抗病信号转导。E-mail: dplu@sjziam.ac.cn
杨俊, 主要从事植物抗病信号转导途径的研究。E-mail: yangjun2116@126.com
2018-05-10
2018-06-06
*国家自然科学基金面上项目(31371247)资助
杨俊, 吕东平. 植物PTI天然免疫信号转导研究进展[J]. 中国生态农业学报, 2018, 26(10): 1585-1592
YANG J, LYU D P. Advances in signal transduction of PAMP-triggered immunity in plants[J]. Chinese Journal of Eco-Agriculture, 2018, 26(10): 1585-1592
