KGF-2对COPD小鼠保护性作用的免疫学研究
2018-10-10常美佳黄嘉楠宋元林白春学洪群英
张 鸽 常美佳 黄嘉楠 周 建 宋元林 白春学 洪群英
(复旦大学附属中山医院呼吸科 上海 200032)
慢性阻塞性肺病(chronic obstructive pulmonary disease,COPD)是呼吸系统的常见疾病,严重危害人类健康,以气道不完全可逆性气流受限为特征。COPD主要累及肺,也可以引起全身炎症及免疫环境的紊乱,具体机制尚未阐明。COPD可能是一种由烟草烟雾诱发、T细胞参与的炎症反应及自身免疫疾病[1-2]。角质细胞生长因子2 (keratinocyte growth factor-2,KGF-2)也被称为FGF10,是含有208个氨基酸残基的多肽,隶属于FGF家族,结构与KGF相似,能够高亲和力结合FGF-2受体。FGF-2受体广泛分布于各种上皮细胞[4]。KGF-2可由间质细胞分泌,能有效促进各种上皮细胞的增殖、迁移和分化,并直接作用于上皮细胞,促进伤口边缘细胞再生和修复,或间接刺激其他细胞因子的分泌,促进肉芽组织形成并减少瘢痕的产生,对脂多糖(lipopolysaccharide,LPS)引起的急性肺损伤有较强的保护性作用[5]。本文拟通过建立COPD小鼠模型,观察KGF-2对COPD小鼠肺部及全身炎症和免疫环境的影响,以探讨KGF-2对于COPD保护性作用的机制。
材 料 和 方 法
实验动物及分组15只雄性SPF级健康BALB/C小鼠,6~8周龄,体重20~25 g,购于上海斯莱克实验动物有限责任公司。复旦大学附属中山医院中心实验室按标准颗粒饲料喂养,自动取食饮水。将15只小鼠随机分为3组:正常对照组(对照组)、COPD模型组(COPD组)及KGF-2治疗组(KGF-2 组),每组5只。
主要药物和试剂KGF-2(上海新生源公司);市售大前门牌香烟:焦油量15 mg,气烟碱量1.1 mg;BCA试剂盒(碧云天公司);小鼠IL-6、肿瘤坏死因子(tumor necrosis factor α,TNF-α) ELISA试剂盒(美国eBioscience公司);戊巴比妥钠(德国默克公司);CD3+、CD4+、CD8+、PD-1流式荧光抗体(美国BD公司)。
主要仪器烟雾发生器(美国Data Sciences International公司),低温高速离心机(型号:5804R,德国Eppendorf公司),流式细胞检测仪(美国BD公司),有机玻璃毒染箱(120 cm×80 cm×80 cm)由复旦大学附属中山医院呼吸科自制。
动物模型复制利用烟熏加LPS气道内滴注的方法建立小鼠COPD模型。正常对照组自由饮水和摄食,不做任何处理;COPD组小鼠置于有机玻璃毒染箱(120 cm×80 cm×80 cm)内进行被动吸烟,每天2次,每次10支,每次持续30 min,2次间隔至少4 h,连续30天,并在第1天和第14天气管内滴入50μL LPS (1 mL/kg),滴注LPS当天暂停吸烟2次。
给药方法在烟熏第1天及第14天,对照组气管内滴注生理盐水50μL各1次。COPD组在烟熏第1天及第14天,气管内滴注LPS 25μg(50μL)/次。KGF-2组在烟熏第1天及第14天,气管内滴注LPS(1 mg/kg)及KGF-2 (5 mg/kg),共2次,50μL/次。
取材腹腔注射1.5%戊巴比妥钠(60 mg/kg)进行麻醉,眼球取血,于4 ℃下900×g离心5 min,分离血清于-80 ℃保存。取血后开胸,气管插管并固定,使用1 mL注射器以无菌PBS行右肺肺泡灌洗,回收率>80%,肺泡灌洗液(bronchoalveolar lavage fluid,BALF)于4 ℃下900×g离心10 min,取上清于-80 ℃保存。留取左肺(未灌洗过的肺组织)放入中性4%甲醛溶液,固定48 h后常规石蜡包埋、切片,肺组织HE染色,用于显微镜下观察肺内支气管损伤以及支气管、肺组织炎症细胞浸润情况,其余肺组织于-80 ℃保存。留取脾脏,研磨过滤后得到单细胞悬液,于-80 ℃保存。
指标检测运用BCA法测定BALF中蛋白质浓度,全自动酶标仪在562 nm处检测各孔的吸光度值(D)。运用ELISA方法测定血清和BALF中IL-6和TNF-α的水平,严格按照试剂盒说明书操作,全自动酶标仪在450 nm处检测各孔的吸光度(D)值。运用流式细胞术测定脾脏中CD4+T细胞、CD8+T细胞及PD+T细胞的比例,运用Flowjo V9软件进行分析。

结 果
小鼠肺组织HE染色对照组可见支气管和肺泡结构清晰,黏膜无明显破坏及炎症细胞浸润的表现;COPD组小鼠肺结构杂乱,破坏较明显,肺泡壁断裂,支气管黏膜上皮细胞变形、坏死,纤毛不齐、变短、倒伏甚至脱落,管壁增厚,周围有大量炎症细胞浸润,管腔狭窄或扭曲扩张;与COPD组比较,KGF-2治疗组肺泡结构破坏减轻,炎症细胞浸润减少(图1)。

图1 各组小鼠肺组织HE染色Fig 1 HE staining in lung tissues of different mice groups
小鼠BALF中蛋白质浓度与对照组比较,COPD组和KGF-2组BALF中蛋白质浓度明显升高(P<0.05),但是KGF-2组与COPD组差异无统计学意义(图2,表1)。
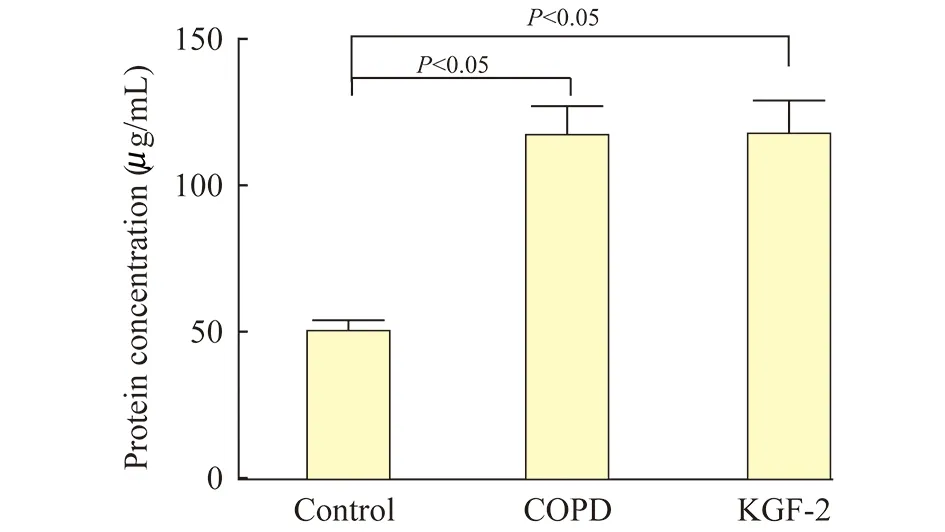
图2 各组小鼠BALF中蛋白浓度的比较Fig 2 Protein concentration in BALF of different mice groups
小鼠BALF及血浆中IL-6和TNF-α水平与对照组比较,COPD组BALF和血浆中IL-6和TNF-α显著升高,差异有统计学意义(P<0.05);与COPD组比较,KGF-2组BALF和血浆中IL-6和TNF-α稍有下降,差异无统计学意义(图3,表1)。
小鼠脾脏CD4+T细胞和CD8+T细胞的比例与对照组比较,COPD组小鼠脾脏CD4+细胞比例明显减少,差异有统计学意义(P<0.05);与COPD组比较,KGF-2组小鼠脾脏CD4+T细胞比例明显上升,差异有统计学意义(P<0.05)。与对照组比较,COPD组小鼠脾脏CD8+T细胞比例明显减少,差异有统计学意义(P<0.05);与COPD组比较,KGF-2组小鼠脾脏CD8+T细胞比例稍有上升,差异无统计学意义。与对照组比较,COPD组小鼠脾脏CD4+T/CD8+T明显升高,差异有统计学意义(P<0.05);与COPD组比较,KGF-2组CD4+T/CD8+T未见明显改变(图4)。

图3 各组小鼠BALF和血浆中IL-6和TNF-α水平Fig 3 IL-6 and TNF-α levels in BALF and plasma of different mice groups

图4 各组小鼠脾脏中T细胞的分布情况Fig 4 Distribution of T cells in spleen of different mice groups
小鼠脾脏细胞PD-1的表达与对照组比较,COPD组小鼠脾脏CD4+T细胞中PD-1的表达比例明显升高,差异有统计学意义(P<0.05);与COPD组比较,KGF-2组小鼠脾脏CD4+T细胞中PD-1的表达比例明显下降,差异有统计学意义(P<0.05)。与COPD组比较,KGF-2组小鼠脾脏CD8+T细胞中PD-1的表达比例明显升高,差异有统计学意义(P<0.05,图4)。
讨 论
KGF-2对LPS引起的急性肺损伤有较强的保护性作用。在急性肺损伤模型中,我们分别验证了KGF-2在1、2、5及10 mg/kg时的保护性作用,结果显示在5 mg/kg时保护性作用最强。基于之前的结果[4],本次实验采用5 mg/kg、气管插管、共给药2次(分别在第14天和第30天)的实验方法。
KGF-2可有效促进各种上皮细胞的增殖、迁移和分化,并直接作用于上皮细胞,促进伤口边缘细胞再生和修复,或间接刺激其他细胞因子的分泌,促进肉芽组织形成并减少瘢痕的产生[5]。此外,KGF-2可以通过减少炎症因子的释放,从而减少T细胞的过度增殖[6-7]。经KGF-2治疗的小鼠CD4+T细胞及CD8+T细胞的比例明显高于COPD组小鼠,PD-1表达阳性的T细胞比例降低。此结果说明KGF-2可以减轻T细胞介导的炎症反应,提高免疫功能。
COPD的主要特征是肺部及全身的慢性炎症及免疫失调,巨噬细胞、T淋巴细胞和嗜中性粒细胞在肺部浸润增加[8-11]。活化的炎症细胞释放各种炎症介质,包括IL-6和TNF-α等[12]。IL-6作为一种多效应的细胞因子可由多种细胞产生,它能抑制巨噬细胞释放TNF-α,减轻炎症反应[13-14]。TNF-α是导致COPD慢性炎症损伤和肺实质毁损的重要细胞因子。吸烟可导致支气管上皮细胞受损,组织或肺泡巨噬细胞和上皮细胞分泌TNF-α,促进炎症因子的趋化和活化,导致气道结构破坏[15]。TNF-α还能诱导支气管上皮细胞INF-γ受体表达,后者能够上调细胞PD-L1的表达[16]。TNF-α可诱导气道黏液细胞化生和分泌增多,导致小鼠肺气肿性损害和肺泡壁胶原沉积[17]。本研究发现在COPD模型小鼠的BALF和血浆中IL-6和TNF-α的含量明显升高,经KGF-2治疗后的COPD小鼠IL-6和TNF-α水平较COPD组小鼠有所下降,由此说明KGF-2对COPD小鼠的肺部及全身炎症有一定的改善作用。
近年来研究发现,香烟等有害气体刺激机体启动固有免疫,固有免疫破坏肺组织,裂解出来的弹力蛋白片段成为抗原,又启动了T细胞介导的获得性免疫[18-19]。PD-1是表达在效应T细胞表面的一个负向调控共刺激分子,在持续的炎症性免疫应答中表达会上调,通过与配体PD-L1和PD-L2相互作用,抑制外周组织中持续免疫反应,并阻止自身组织受到免疫损伤[20]。吸烟的COPD患者肺内存在寡克隆CD4+T细胞聚集,COPD可能是一种由烟草烟雾诱发、T细胞参与的炎症反应及自身免疫疾病。COPD患者常常存在气道及全身炎症及免疫失调,导致容易发生感染及急性加重。T淋巴细胞亚群各细胞成分间比例的维系是正常免疫反应的细胞学基础,T淋巴细胞在抗原的刺激下呈现亚群比例紊乱,导致免疫反应不恰当增强或减弱,造成组织损伤或炎症的持久存在,这可能是COPD病情进展的机制之一[20]。已有研究证实,在COPD缓解期,外周血CD4+T细胞数目及CD4+/CD8+T细胞相对于对照组有所降低[16]。在我们的研究中,COPD小鼠CD4+T细胞和CD8+T细胞比例明显低于对照组,PD-1表达阳性的T细胞比例升高,提示COPD小鼠免疫反应减弱。经KGF-2治疗的小鼠CD4+T细胞及CD8+T细胞的比例明显高于COPD组小鼠,PD-1表达阳性的T细胞比例降低,提示KGF-2可以提高小鼠脾脏中CD4+T细胞及CD8+T细胞数量,并部分恢复CD4+T细胞的免疫活性。
本研究结果说明KGF-2对于炎症损伤的保护性作用有限,但是对于增强免疫功能有一定的作用,提高了CD4+T细胞的比例和活性及CD8+T细胞的数量。CD4+T细胞的分类及机制有待进一步探讨。
综上所述,KGF-2通过降低肺部及全身IL-6和TNF-α水平及提高CD4+T细胞和CD8+T细胞比例,降低T细胞PD-1的表达来改善COPD,提示KGF-2在一定程度上能改善COPD慢性炎症反应及增强免疫力。
