CRISPR/Cas9敲低环氧合酶2表达对黄曲霉毒素B1诱导肝细胞核DNA损伤与脂质蓄积的影响
2018-10-09韩佩宇陈圆圆段军燕孙宝芳何承勇林育纯林忠宁
韩佩宇,车 琳,陈圆圆,江 珊,段军燕,孙宝芳,何承勇,林育纯,林忠宁
(厦门大学 公共卫生学院,分子疫苗学和分子诊断学国家重点实验室,福建厦门361102)
黄曲霉毒素B1 (aflatoxin B1, AFB1)是毒性极强的环境污染物[1],主要经被污染的花生等食品进入人体,靶向肝脏发挥毒性效应,由其造成的人群健康危害已成为一个重要的公共卫生问题.已有报道指出AFB1诱导肝细胞毒性的机制主要有氧化应激[2]、核DNA损伤[3]、细胞周期阻滞、增殖抑制以及脂质蓄积等[4].已知环氧合酶(cyclooxygenases, COXs)是花生四烯酸代谢合成前列腺素家族的限速酶[5],分为COX-1和COX-2两个亚型[6],分别由PTGS1和PTGS2基因编码;其中COX-2为诱导型酶,与炎症反应、细胞增殖、细胞凋亡等多种病理过程有关,并参与肝细胞脂质蓄积的调节[5].有研究表明,氧化应激可诱导DNA双链断裂,与脂质蓄积等并发症有关[7].本课题组前期研究发现AFB1可由细胞应激诱导COX-2 表达升高[8];然而目前COX-2是否作为调控AFB1诱导肝细胞DNA损伤与脂质蓄积的靶点仍未阐明.
簇状规律性间隔性短回文重复序列(clustered regularly interspaced short palindromic repeats, CRISPR)/Cas9系统是古生菌在长期演化过程中形成的一种用于对抗入侵的病毒及外源DNA的适应性防御体系[9].Cas9基因在CRISPR位点附近,其编码的蛋白具有解旋酶和核酸酶作用;通常Cas9蛋白以无活性形式存在,当与crRNA (CRISPR-derived RNA)结合后,三维结构发生改变,在其指引下与相应DNA结合并对特定序列进行剪切[10].近年来,借助于CRISPR/Cas9系统,通过设计小向导RNA (small guide RNA, sgRNA)与下游Cas9形成核糖核蛋白复合物,引导Cas9到相应DNA位置,可利用其对哺乳动物细胞目的基因进行高效编辑.本研究拟采用CRISPR/Cas9系统构建稳定敲低PTGS2基因表达的HepG2细胞株,用于探讨COX-2在AFB1诱导肝细胞核DNA损伤和脂质蓄积中的作用和潜在调控机制.
1 材料与方法
1.1 实验材料
1.1.1 质粒、菌株及细胞株
CRISPR/Cas9质粒lentiCRISPR v2购自Addgene公司;pCMV-dR8.9、VSV-G、pCMV、pCMV-PTGS2质粒,HepG2和HEK293T细胞由本实验室保存.大肠杆菌(Escherichiacoli)感受态细胞Stbl3购自上海唯地生物技术有限公司.
1.1.2 试 剂
Quick Ligase购自美国New England Biolabs公司;氨苄青霉素、高效质粒抽提试剂盒购自美国Life Technologies公司;TRIzol RNA提取试剂盒、X-tremeGENE HP DNA 转染试剂、嘌呤霉素、OPTI-MEM®Ⅰ Reduced Serum 培养液、Esp3Ⅰ*内切酶、二甲基亚砜(DMSO)购自美国Thermo Scientific公司;RPMI-1640培养基、胎牛血清、青霉素链霉素双联抗生素、0.25%(质量分数)胰蛋白酶购自美国Gibco公司;cDNA合成试剂盒、SYBR PrimeScriptTMRT-PCR试剂盒购自日本TaKaRa公司;羊抗鼠/兔-辣根过氧化物酶(HRP)-IgG二抗、驴抗鼠-Alexa Fluor-IgG荧光二抗、甘油醛-3-磷酸脱氢酶(GAPDH)抗体、COX-2抗体、过氧化物酶体增殖物激活受体γ(pe-roxisome proliferator-activated receptors γ,PPARγ)抗体购自美国Cell Signal Technology公司;磷酸化组蛋白H2AX(phosphor-histone H2AX (Ser139), γH2AX)抗体购自美国Millipore公司;AFB1购自美国EnzoLife公司;4,6-二脒基-2-苯基吲哚(DAPI)购自上海碧云天生物有限公司;总胆固醇(TC)、总甘油三酯(TG)检测和油红O染色试剂盒购自南京建成生物技术有限公司;其他常规试剂购自厦门绿茵公司.
1.2 实验方法
1.2.1 sgRNA序列设计与合成
利用http:∥crispr.mit.edu网站,按照sgRNA设计原则设计靶向PTGS2基因的2对sgRNA寡核苷酸片段,序列见表1.
1.2.2 重组质粒的构建与鉴定
质粒lentiCRISPR v2用限制性内切酶Esp3Ⅰ*酶切,产物进行琼脂糖凝胶电泳鉴定,切胶回收质粒大片段产物;将合成的sgRNA片段稀释为10 μmol/L,分别取正、反链各0.25 μL,加入5 μL 10×退火缓冲液和超纯水至50 μL,混匀后95 ℃孵育5 min,自然冷却至室温,形成双链寡核苷酸片段;然后将50 ng酶切回收的线性化lentiCRISPR v2载体、1 μL退火后的双链sgRNA片段、1 μL连接酶、5 μL 2×连接缓冲液,加超纯水至11 μL,室温连接10 min;再将连接产物转化Stbl3感受态细胞,涂布于氨苄青霉素抗性的LB平板,37 ℃培养过夜;次日挑取分别含有sgRNA1或sgRNA2的单克隆菌落各3个于LB培养基中,37 ℃振荡培养12 h,提取质粒进行测序鉴定.
1.2.3 HepG2-Cas9-PTGS2敲低细胞的构建
采用HEK293T细胞包装含有目的质粒或对照质粒的假病毒,收集病毒上清,使用X-tremeGENE HP DNA转染试剂,感染预先接种于直径6 cm的细胞培养皿的HepG2细胞,8 h后更换含有10%(体积分数)胎牛血清的RPMI-1640培养基;36 h后,使用0.6 μg/mL嘌呤霉素进行细胞筛选,直至空白对照HepG2细胞全部死亡时终止,重复筛选2次.获取靶向PTGS2基因稳定敲低COX-2表达的细胞,经鉴定分别命名为HepG2-Cas9-PTGS2-sgRNA1 (简称Cas9-PTGS2-sgRNA1)和-sgRNA2 (简称Cas9-PTGS2-sgRNA2)敲低细胞;转入空质粒的细胞命名为HepG2-Cas9-NC (简称Cas9-NC)对照细胞.
1.2.4 PTGS2基因敲低COX-2表达效率鉴定
将筛选得到的细胞以每孔3.5×105个接种于6孔板,采用蛋白免疫印迹(WB)方法检测PTGS2敲低效率,选择敲低效率较高的细胞株用于后续实验.同时,采用本课题组前期优化的条件进行实时荧光定量PCR (qRT-PCR)[11],检测PTGS2和PTGS1的mRNA水平,引物序列见表1.
1.2.5 细胞分组处理和目的基因mRNA水平检测
细胞以每孔3.5×105个接种于6孔板,分为处理组(2 μmol/L AFB1)和对照组(等体积的溶剂DMSO)处理48 h,提取总RNA,逆转录成cDNA,采用qRT-PCR检测包括参与代谢活化的细胞色素P450家族相关基因CYP2B6和CYP3A4、人肝型脂肪酸结合蛋白1(FABP1)基因和肝脏脂质合成相关基因PPARG的mRNA水平.以ACTB作为内参基因,结果将循环数Ct值转换成2-ΔΔCt来进行比较,相关基因的引物序列详见表1.

表1 本研究涉及的寡核苷酸与引物序列
1.2.6 蛋白表达的WB检测
各处理组细胞采用十二烷基磺酸钠(SDS)裂解法提取总蛋白,检测细胞中COX-2、PPARγ、γH2AX的蛋白表达水平,以GAPDH为内参.各目的蛋白条带采用Image J软件进行半定量分析.
1.2.7 细胞核DNA损伤的免疫荧光检测
细胞以每孔1.5×104接种于24孔板,分组处理至终点,用4%(质量分数)多聚甲醛室温固定20 min,0.5%(体积分数)TritonX-100打孔5 min,1%(体积分数)胎牛血清封闭30 min,检测细胞核DNA双链损伤标志物γH2AX.4 ℃下避光孵育γH2AX抗体8 h,室温下避光孵育荧光二抗1 h,DAPI染色1 min,各步骤间均用磷酸盐缓冲液(PBS)清洗3次.使用共聚焦显微镜观察,图像拍照并分析荧光焦点形成数目.
1.2.8 细胞内TC与TG含量检测
细胞分组处理至终点,收集细胞,依据试剂盒说明书进行操作,用PBS清洗2次后超声匀浆,匀浆液加入显色试剂,分别使用分光光度计检测546和570 nm处光密度,标准曲线法计算TC和TG含量.
1.2.9 细胞内脂质的油红O染色
细胞以每孔8×104个接种于12孔板,分为处理组(2和5 μmol/L AFB1)和对照组(DMSO)处理48 h,按试剂盒方法进行油红O染色,使用正置显微镜观察细胞内脂质分布并拍照;采用Image J软件测定视野内脂滴所占面积,统计细胞个数后进行半定量分析.
1.2.10 细胞内野生型COX-2的回补实验
采用构建的pCMV-PTGS2质粒(1 μg/mL)作为回补组,以pCMV质粒(1 μg/mL)为对照组,分别瞬时转染HepG2-Cas9-NC对照细胞和HepG2-Cas9-PTGS2敲低细胞12 h,分为处理组(2 μmol/L AFB1)或对照组(DMSO)处理48 h.提取细胞总RNA,逆转录成cDNA,采用qRT-PCR检测PTGS2的mRNA水平;收获细胞,采用SDS裂解法提取总蛋白,WB检测细胞中COX-2与γH2AX的蛋白表达水平;采用检测试剂盒进行油红O染色,按1.2.9方法进行细胞内脂质分布观察、拍照和半定量分析.
1.2.11 统计学分析
每项实验至少重复3次,使用SPSS 18.0软件进行统计学分析.定量分析数据以平均值±标准差表示,两组间比较采用t-检验,多组间比较采用单因素方差分析(one-way ANOVA),p<0.05表示差异显著.
2 结果与分析
2.1 lentiCRISPR-PTGS2重组质粒的构建
载体lentiCRISPR v2酶切后得到特异性大片段,测序结果显示,设计的sgRNA序列位于质粒酶切位点序列之间,与设计序列一致(图1),说明2个重组质粒构建成功,分别命名为lentiCRISPR-PTGS2-sgRNA1和lentiCRISPR-PTGS2-sgRNA2.
2.2 HepG2-Cas9-PTGS2稳定敲低COX-2表达细胞株的鉴定
细胞形态学观察结果显示:与Cas9-NC对照细胞相比,Cas9-PTGS2敲低细胞的形态无明显改变(图2(a)).Cas9-PTGS2-sgRNA1和-sgRNA2敲低细胞中PTGS2 mRNA水平分别减少到(49.1±1.8)%和(73.5±2.2)%,且与Cas9-NC对照细胞相比均有显著差异(p<0.05);而PTGS1 mRNA水平未见显著差异(图2(b)).Cas9-PTGS2-sgRNA1和-sgRNA2敲低细胞中COX-2蛋白表达水平降低(图2(c)),分别为Cas9-NC对照细胞的(48.1±0.7)%和(63.2±1.1)%,差异均显著(p<0.05,图2(d)).由结果可见HepG2-Cas9-PTGS2-sgRNA1敲低细胞具有更高的COX-2敲低表达效率,故选择其(下文简称Cas9-PTGS2敲低细胞)用于后续实验.
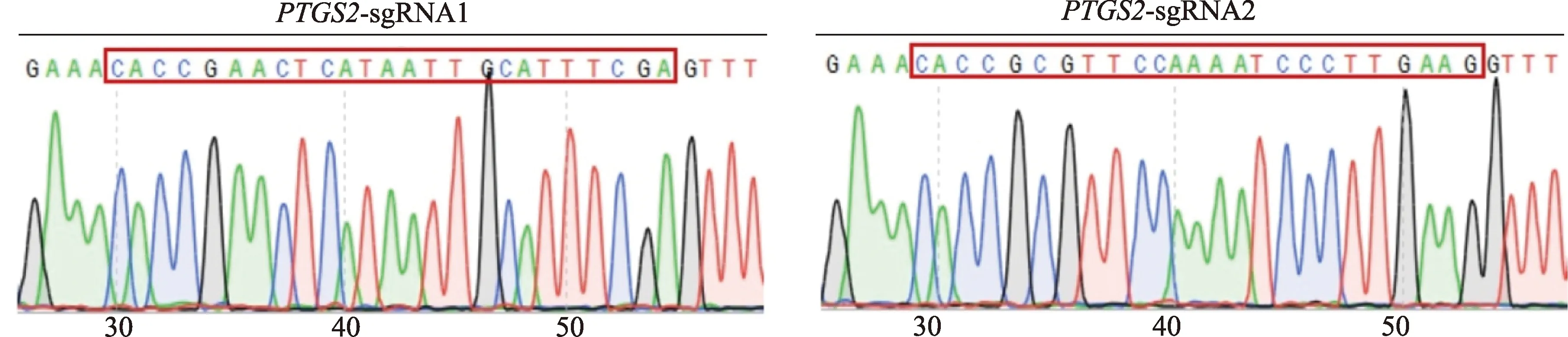
图1 lentiCRISPR-PTGS2-sgRNA重组质粒的测序验证Fig.1 Sequencing verification of lentiCRISPR-PTGS2-sgRNA recombinant plasmids
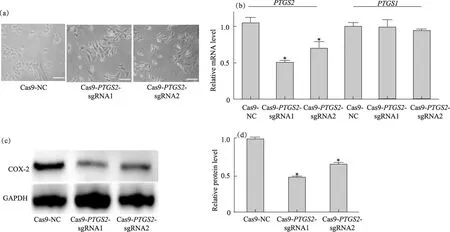
(a)细胞形态学观察,标尺为50 μm;(b)PTGS2和PTGS1 mRNA水平;(c)和(d)COX-2蛋白表达水平的WB检测和半定量分析.*表示与Cas9-NC对照细胞相比,p<0.05.图2 Cas9-PTGS2细胞的鉴定Fig.2 Identification of Cas9-PTGS2 cells
2.3 COX-2敲低表达对AFB1诱导肝细胞核DNA损伤的抑制作用
如图3(a)所示,AFB1处理组Cas9-PTGS2敲低细胞与Cas9-NC对照细胞中,CYP2B6和CYP3A4 mRNA水平较对照组均显著升高(p<0.05),而2种细胞间无显著差异,说明AFB1诱导肝细胞反应性的染毒细胞模型建立成功,但COX-2敲低表达对肝细胞代谢无显著影响.

(a)CYP2B6和CYP3A4的mRNA水平变化;(b)COX-2和γH2AX的蛋白水平变化;(c)细胞核内γH2AX荧光焦点形成图像,标尺为10 μm;(d)每个细胞中γH2AX荧光焦点数目.*表示与Cas9-NC对照细胞的对照组相比,p<0.05;#表示与Cas9-NC对照细胞的AFB1处理组相比,p<0.05.图3 AFB1处理Cas9-PTGS2敲低细胞中CYP2B6和CYP3A4 mRNA以及COX-2和γH2AX蛋白水平Fig.3 Levels of CYP2B6 and CYP3A4 mRNA, COX-2 and γH2AX protein in AFB1-treated Cas9-PTGS2 cells
由图3(b)可见:与Cas9-NC对照细胞相比,Cas9-PTGS2敲低细胞中COX-2表达水平降低;AFB1处理组Cas9-NC对照细胞中COX-2表达水平明显升高,Cas9-PTGS2敲低细胞中COX-2蛋白也受AFB1诱导,但表达水平明显低于Cas9-NC对照细胞中.AFB1处理组Cas9-NC对照细胞中γH2AX表达较对照组明显升高,而Cas9-PTGS2敲低细胞中γH2AX表达无明显变化.相应地,AFB1处理组Cas9-NC对照细胞核中γH2AX荧光焦点形成较对照组增多(图3(c)),数目显著增加(p<0.05,图3(d));而在AFB1处理组Cas9-PTGS2敲低细胞中,细胞核中γH2AX荧光焦点形成较少(图3(c)),数目显著低于AFB1处理组Cas9-NC对照细胞中(p<0.05,图3(d)).上述结果表明靶向抑制COX-2表达可减弱AFB1诱导的肝细胞核DNA损伤.
2.4 COX-2敲低表达对AFB1诱导肝细胞脂质蓄积的影响
2.4.1 脂质合成相关基因mRNA和蛋白表达水平
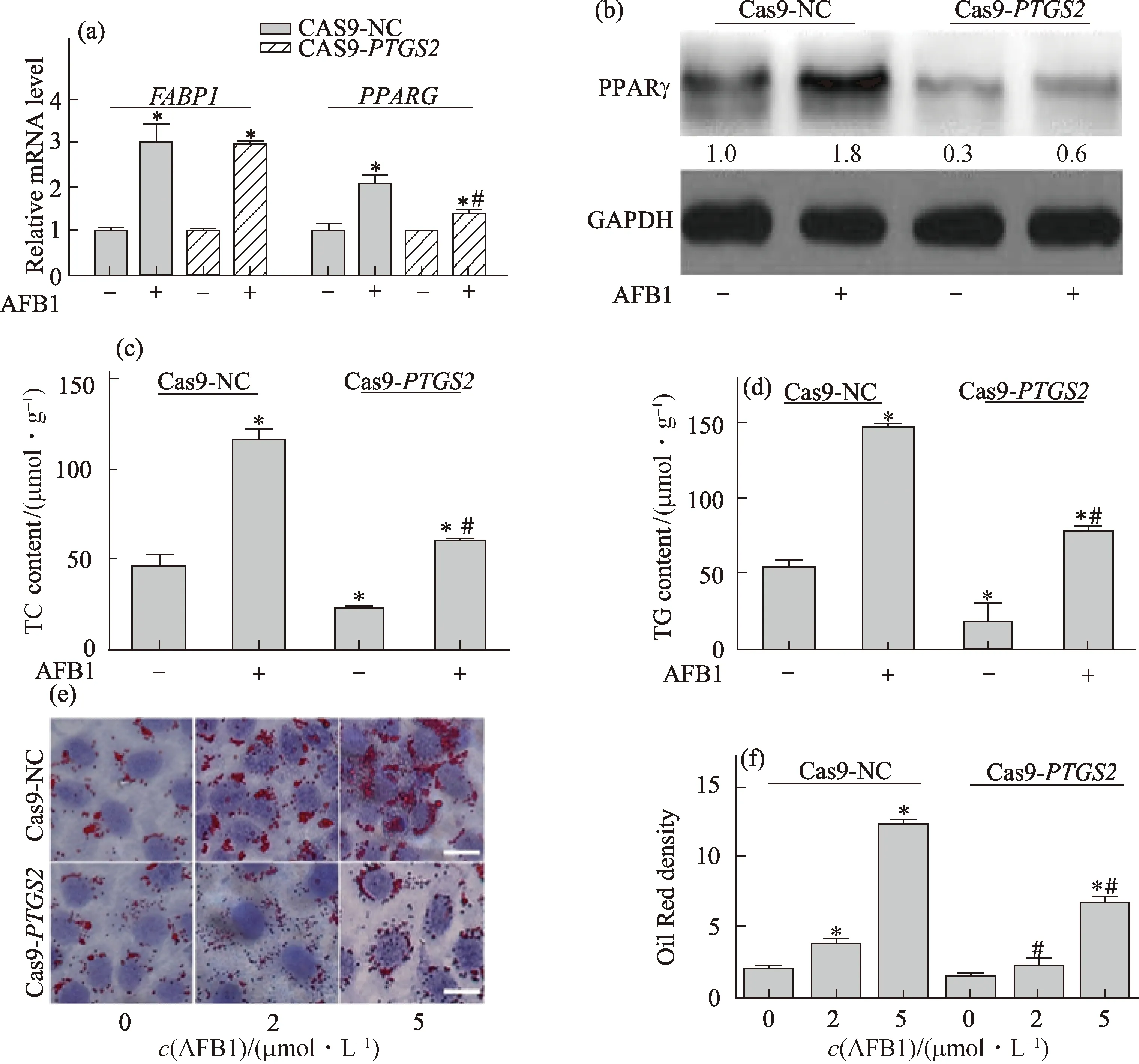
(a)脂质合成相关基因的mRNA水平变化;(b)PPARγ蛋白表达水平变化;(c)TC含量;(d)TG含量;(e)油红O染色照片,标尺为50 μm;(f)脂滴密度半定量分析.*表示与Cas9-NC对照细胞的对照组相比,p<0.05;#表示与Cas9-NC对照细胞中相同剂量AFB1处理组相比,p<0.05.图4 AFB1处理诱导Cas9-PTGS2细胞中脂质合成的变化Fig.4 Changes of lipid synthesis in AFB1-treated Cas9-PTGS2 cells
AFB1处理组Cas9-NC对照细胞和Cas9-PTGS2敲低细胞中,脂质合成相关基因FABP1与PPARG的mRNA水平较对照组均显著升高(p<0.05),且AFB1处理组Cas9-PTGS2敲低细胞中PPARG的mRNA水平显著低于Cas9-NC对照细胞中(p<0.05,图4(a)).AFB1处理组Cas9-NC对照细胞和Cas9-PTGS2敲低细胞中的PPARγ蛋白表达水平较相应对照组均升高;但在Cas9-PTGS2敲低细胞中,PPARγ蛋白的表达水平明显低于Cas9-NC对照细胞中(图4(b)).上述结果表明COX-2敲低表达可抑制AFB1诱导肝细胞中PPARGmRNA和PPARγ蛋白的表达.
2.4.2 肝细胞中TC和TG含量
如图4(c)和(d)所示:Cas9-PTGS2敲低细胞中TC和TG含量均显著低于Cas9-NC对照细胞中(p<0.05);2种细胞中AFB1处理组的TC和TG含量较对照组均显著升高(p<0.05),但在Cas9-PTGS2敲低细胞中显著低于Cas9-NC对照细胞中(p<0.05).
2.4.3 肝细胞中脂质分布和蓄积
由图4(e)和(f)可见:AFB1处理组Cas9-NC对照细胞和Cas9-PTGS2敲低细胞中,油红O染色阳性脂滴在细胞内的分布密度显著增加(p<0.05),并呈现AFB1的剂量依赖性;且在Cas9-PTGS2敲低细胞中的密度显著低于同剂量AFB1处理组的Cas9-NC对照细胞中(p<0.05).上述结果表明COX-2敲低表达可抑制AFB1诱导肝细胞中TC和TG含量升高而引起的脂质蓄积.
2.5 COX-2回补对AFB1诱导肝细胞核DNA损伤和脂质蓄积的影响
2.5.1 COX-2的回补作用
与pCMV对照组相比,pCMV-PTGS2回补组Cas9-NC对照细胞中PTGS2的mRNA水平显著升高(p<0.05,图5(a)),COX-2表达水平也明显升高(图5(b));且pCMV-PTGS2回补组Cas9-PTGS2敲低细胞中PTGS2的mRNA水平显著升高(p<0.05,图5(a)),COX-2表达水平也明显升高(图5(b)),但均低于回补组Cas9-NC对照细胞中(p<0.05,图5(a)和(b)).上述结果表明在Cas9-PTGS2敲低细胞中回补COX-2表达的模型建立成功.
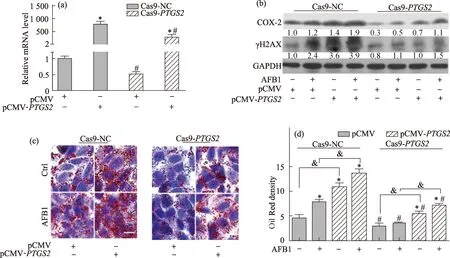
(a)PTGS2的mRNA水平变化;(b)COX-2和γH2AX的蛋白水平变化;(c)和(d)油红O染色照片及脂滴密度半定量分析.*表示与2种细胞各自pCMV对照组相比,p<0.05;#表示与Cas9-NC对照细胞相同处理组相比,p<0.05;&表示pCMV-PTGS2回补组与pCMV对照组相比,p<0.05.图5 AFB1处理Cas9-PTGS2细胞的COX-2回补试验中COX-2、γH2AX和脂质蓄积的水平Fig.5 Levels of COX-2, γH2AX, and lipid in AFB1-treated Cas9-PTGS2 cells in COX-2 rescue assay
2.5.2 γH2AX诱导表达和脂质蓄积的恢复
Cas9-NC对照细胞中,与pCMV对照组相比,p-CMV-PTGS2回补组细胞中γH2AX蛋白表达水平(图5(b))明显升高,脂滴密度(图5(c)和(d))显著增加(p<0.05); 且pCMV-PTGS2回补组细胞在AFB1处理后γH2AX蛋白表达水平(图5(b))和脂滴密度(图5(c)和(d))进一步增加.上述结果表明COX-2表达水平升高与AFB1诱导γH2AX蛋白表达和脂质蓄积有潜在关联性.
Cas9-PTGS2敲低细胞中,与pCMV对照组相比,pCMV-PTGS2回补组细胞中γH2AX蛋白表达水平(图5(b))明显升高,脂滴密度(图5(c)和(d))显著增加(p<0.05);且pCMV-PTGS2回补组细胞在AFB1处理后γH2AX蛋白表达水平(图5(b))和脂滴密度(图5(c)和(d))进一步增加,但均显著低于Cas9-NC对照细胞中(图5(b)、(c)和(d)).上述结果表明COX-2回补对AFB1诱导γH2AX蛋白表达和脂质蓄积有恢复作用.
3 讨论与结论
CRISPR/Cas9系统利用sgRNA引导Cas9核酸酶在N20介导的靶位点处进行DNA特异性剪切,从而达到敲除基因的目的.本研究利用CRISPR/Cas9系统中Cas9的核酸酶活性,设计针对PTGS2特定序列(位于第3外显子区域)的sgRNA,靶向干预COX-2 蛋白表达,充分利用了CRISPR/Cas9系统操作简便、成本低、成功率高的优点[9].在通常情况下,用CRISPR/Cas9剪切目的基因时,该基因mRNA转录水平不受影响,但本研究构建的Cas9-PTGS2细胞中,COX-2蛋白靶向敲低表达的同时,PTGS2的mRNA 水平也降低.根据已有文献[12-13]提示,可能原因为采用CRISPR/Cas9系统对基因进行选择性切割和导致修复过程中出现缺失、移码等形式突变,由此导致RNA二级结构的改变,从而损害mRNA稳定性并加快其降解速度.
本研究采用的lentiCRISPR v2是CRISPR/Cas9系列中改进的单质粒系统[14],质粒上同时含有Cas9 基因序列以及sgRNA的酶切位点,可经过一轮转染得到目的细胞以加快进程,而且该质粒同样适用于原代细胞转染[15].本研究根据序列评分设计了5条sgRNA,经过质粒酶切、连接、鉴定、感染、筛选等步骤构建获得了含有2条不同sgRNA的lentiCRISPR-Cas9-PTGS2细胞,对COX-2蛋白敲低效率分别为51.9%和26.8%;另有文献报道,可以通过向目的细胞分次转染多个插入不同sgRNA序列的质粒来提高目的基因剪切敲除效率[16].此外,为了排除CRISPR/Cas9技术潜在“靶外效应”的影响,本研究还在构建的Cas9-PTGS2敲低细胞中瞬时转染COX-2表达进行回补实验,进一步证实了COX-2诱导表达和干预与肝细胞核DNA损伤和脂质蓄积的潜在关联性.
目前国内外研究中,COX-2表达的干预多集中在选择性抑制剂,如塞来昔布、白藜芦醇、非甾体类抗炎药上.然而,塞来昔布与非甾体类抗炎药在抑制COX-2的同时会引起肝功能指标改变的副作用[8];白藜芦醇除了抑制COX-2外,还存在抵抗氧化损伤、抑制肿瘤增殖等特异性不高的问题[11].本研究构建的特异性靶向PTGS2基因的Cas9-PTGS2敲低细胞中,敲低COX-2表达时未见对COX-1(PTGS1基因)表达产生明显影响,且可通过靶向回补的方式使COX-2表达部分回升和进行功能效应调节.因此,在降低PTGS2的靶外效应、提高特异性方面显现出优势,为其应用于COX-2调控机制和实验研究提供了新策略.
AFB1被国际癌症研究组织(IARC)划定为Ⅰ类致癌物,通过CYP3A4等代谢形成AFB1-8,9-环氧化物,继而与DNA共价结合形成AFB1-DNA加合物,造成各种形式的DNA损伤.组蛋白H2AX磷酸化产生的γH2AX可作为反映DNA双链断裂和修复的一种生物标志物,其水平增高提示细胞核DNA损伤的发生[17].本研究中,AFB1急性暴露可显著改变CYPmRNA与γH2AX蛋白表达水平,验证了AFB1被代谢活化而诱导细胞核DNA损伤的毒性作用.进一步分析发现,COX-2敲低表达可以部分抑制γH2AX形成,并在Cas9-PTGS2敲低细胞中回补COX-2后γH2AX水平升高,说明COX-2的诱导表达参与了AFB1暴露引发DNA损伤的调节作用[18].
有研究表明,塞来昔布通过抑制COX-2可以减少由高脂饮食引起的非酒精性脂肪肝[5];在鸡肝细胞中,AFB1暴露诱导COX-2表达,可引起肝脏炎症与脂质蓄积;PPARγ参与糖类和脂类合成过程,多种降脂类及抗糖尿病药物均以其作为治疗靶点[19].Fujimori等[20]发现,在烟酸处理的小鼠3T3-L1细胞中,COX-2表达可以增高PPARγ表达而促进脂肪形成;同时会产生活性氧导致DNA损伤[21].An等[22]的研究表明,PPARγ抑制剂延缓了宫颈癌细胞中γH2AX的形成.而DNA损伤会抑制胆固醇流出,最终促进细胞内脂质的蓄积[23].本研究通过油红O染色发现COX-2敲低表达可使AFB1引起的脂滴分布密度降低,在Cas9-PTGS2敲低细胞中回补COX-2后脂滴分布密度回升.同时,AFB1可引起肝细胞FABP1和PPARG的mRNA水平上升,说明AFB1可通过FABP1和PPARγ促进肝细胞脂质蓄积;而在Cas9-PTGS2敲低细胞中,PPARG的mRNA水平下降,但FABP1的mRNA水平无显著变化,暗示COX-2可能通过PPARγ而非FABP1调控AFB1引起的肝细胞脂质蓄积.蛋白水平检测也证明COX-2介导了AFB1引起的肝细胞脂质蓄积.
综上可得出结论:AFB1作用于肝细胞经过CYP450代谢酶代谢活化产生毒性效应,通过诱导COX-2表达上调PPARγ水平,启动脂质代谢失稳态并导致细胞核DNA损伤,而DNA修复障碍会进一步加剧脂质蓄积.本研究通过CRISPR/Cas9技术靶向基因干预使COX-2敲低表达,可以有效抑制AFB1引发的肝细胞核DNA损伤和脂质代谢失调,为靶基因编辑细胞模型的构建及其应用于外源化学物诱导肝毒性的机制探讨和安全性评价,提供了理想的研究工具.
