温室不同管理模式对土壤微生物生物量碳和原生动物丰度的影响①
2018-10-08李钰飞李吉进杨合法
李钰飞,李 季,李吉进,杨合法
温室不同管理模式对土壤微生物生物量碳和原生动物丰度的影响①
李钰飞1,2,李 季2*,李吉进1,杨合法3
(1 北京市农林科学院植物营养与资源研究所,北京 100097;2 中国农业大学资源与环境学院,北京 100193; 3 中国农业大学曲周试验站,河北曲周 057250)
为了解温室环境下不同的农业管理模式对土壤微生物生物量碳和原生动物的影响,以中国农业大学曲周日光温室长期定位试验为研究对象,于2012年8—12月进行了5次取样,测定了有机、无公害和常规管理模式下的土壤真菌、细菌生物量碳和原生动物丰度。结果表明:温室环境土壤以细菌分解途径占优势;原生动物中鞭毛虫占绝对优势。管理模式对土壤真菌生物量碳、细菌生物量碳、微生物生物量总碳、原生动物各类群(鞭毛虫、纤毛虫和肉足虫)丰度及总数均有显著影响,但对真菌/细菌比率、鞭毛虫和肉足虫的相对丰度没有显著影响。细菌、真菌和微生物生物量碳在不同管理模式间总体呈现相同的规律,即有机模式>无公害模式>常规模式;对于原生动物,不同类群呈现出复杂的动态变化规律,总体上有机模式下原生动物数量高于无公害和常规模式的。管理模式对微生物生物量碳和原生动物的影响主要体现在生物量上,而对功能群结构的影响较小。
微生物生物量碳;原生动物;真菌/细菌比率;温室;有机模式;无公害模式
土壤微生物作为土壤生态系统的分解者,是土壤生物类群的重要组成部分。其既是土壤养分循环过程的动力,又可作为土壤中植物有效利用的有机质动态库[1]。土壤微生物生物量碳、氮可较为直观地反映土壤肥力状况[2]。土壤食物网研究中,微生物常划分为真菌和细菌;由于土壤碎屑分解难易程度的差异,在不同土壤环境下二者的比例及所起的作用也不同[3]。因此,了解土壤微生物生物量及真菌/细菌比率对了解土壤养分转化、碳氮循环具有重要的意义[4]。土壤原生动物在地下食物网中联结着分解者和捕食者,其可取食细菌,同时又被大型原生动物和小型土壤动物所摄食[5],从而参与了微生物所介导的物质循环和能量转化。有研究发现原生动物对土壤动物呼吸作用的贡献达将近70%[6],对碳、氮矿化率的贡献分别为14% ~ 66% 和20% ~ 40%[7-8]。
在农业生态系统中,各种农业措施可通过直接或间接作用影响土壤生物的丰度和群落结构。例如,有机肥的施入对细菌数量和原生动物丰度均有促进作用[9-10]。化肥在低产农田中可提高微生物生物量碳[11],但在高产农田系统对微生物生物量碳和原生动物丰富均有抑制作用[9,12]。蔡冰杰等[13]发现,添加白三叶草有利于变形虫和鞭毛虫数量增加。相比常规耕作,免耕有利于细菌、真菌生物量,以及微生物生物量碳的增加[14-15]。Foissner[16]认为杀虫剂对原生动物的毒害作用大于除草剂。Griffiths[17]则发现在使用杀菌剂的土壤中,肉足虫和纤毛虫显著低于对照处理。
常规农业系统下,大量的化肥和农药投入在维持作物高产的同时也引发了一系列的环境问题。有机和无公害种植模式以有机投入为主,并通过避免或减少化学品输入而降低对土壤环境的破坏,此前的研究表明这两种农业管理模式相比常规农业有利于土壤结构的改善、土壤养分的提高[18-20],并在病害防控方面表现出一定优势[21]。
对于有机农业和无公害农业土壤生物的研究,主要集中在室外农田系统,对于蔬菜日光温室的研究则鲜有报道。与室外农田相比,温室常处于半封闭状态,扰动更为强烈,并具有高温、高湿、高投入等特点[22]。强烈的扰动通过作用于土壤环境进而影响土壤生物。本研究是“温室环境下不同管理模式对土壤食物网影响”课题的一部分,试验以中国农业大学曲周日光温室长期定位试验为研究对象,对比了有机、无公害和常规管理模式下土壤微生物生物量碳和原生动物丰度,一方面为丰富温室条件下土壤生物学指标作出贡献,同时也为进一步研究管理模式对土壤食物网的影响打下基础。
1 材料与方法
1.1 试验地点与设计
本研究依托于中国农业大学曲周试验站的日光温室有机蔬菜生产长期定位试验(2002年6月至今)。试验地点位于河北省邯郸市曲周县北部 (36°52′N, 115°01′E),该区域属于温带半湿润季风气候区,光、热、水等气候条件良好,但冬春寒冷干燥,夏季温暖多雨,干湿季节更替明显。试验区年均降雨量604 mm,60% 发生在7—9月;年均温度13.2℃。试验所采用的日光温室为长52 m、宽7 m的拱圆式大棚,棚内年均温度18.7 ℃,土壤为改良后的盐化潮土。温室内主要以春季番茄和冬季黄瓜种植为主,并包括茄子、芹菜和菜花等多种蔬菜轮作(每年2 ~ 3茬)。本试验取样前的最后一茬蔬菜为西红柿,取样期间所种蔬菜为黄瓜。
试验设置有机 (ORG)、无公害(LOW)和常规(CON) 3种种植模式,每个模式为一个独立的温室。有机模式只施用有机肥,不使用任何化肥和农药;病虫害防治采取人工防治、物理防治、硫磺熏蒸和高温闷棚等措施。无公害模式以施用有机肥为主,并施用少量化肥;病虫害防治以生物防治为主,在严重时使用化学农药,总体上化学品(包括化肥和农药)的投入量为常规模式的一半。常规模式为根据当地农户传统的温室管理模式,以施用化肥为主,少量施用有机肥;并采用化学防治防控病虫害,使用的化学农药包括多种杀菌剂和杀虫剂。3种种植模式详细信息及取样间管理措施详见文献[23]。
1.2 取样方法
土样采集根据黄瓜的生长期分5次进行,分别为2012年的8月(种植前)、9月(幼苗期)、10月(生长中期)、11月(收获期)和12月(收获末期)。每个温室设置3个9 m×7 m的样方作为3个重复,样方之间间隔4 m。分两层取样:0 ~ 10 cm,10 ~ 20 cm。因此共计3×5×2×3 = 90个样。在每个样方内采取“Z”字形钻取土壤样约750 g(5 ~ 7钻),充分混匀后马上保存于4 ℃冰箱中备用。
1.3 土壤生物指标测定
为了区分细菌与真菌生物量碳,本研究采用荧光染色-显微镜计数法测定微生物生物量碳[24-25]。分别制作真菌和细菌的染色涂片,其中真菌染色使用荧光增白剂(fluorescent brightener, FB),细菌染色使用二氯三嗪基氨基荧光素(5-(4,6-dichlorotriazin-2-yl) aminofluorescein , DTAF)。随机选取20 ~ 25个视野,于40倍物镜下观察真菌菌丝,100倍物镜下观察细菌细胞。假定细菌为球体,真菌为圆柱体,测得细菌和真菌体积,分别乘以各自的单位体积碳含量而得到生物量碳。细菌单位体积碳含量为C 3.2×10−13g/μm3[24],真菌为C 1.3×10−13g/μm3[25]。
原生动物的测定采用稀释培养计数法[26],本研究采用的稀释梯度为10–4~ 10–6。
1.4 数据分析
所有指标均进行多因素方差分析。在进行此分析前,微生物生物量碳和原生动物丰度(除纤毛虫外)采用ln数据转换;其余指标采用arsin数据转换。处理间的比较采用单因素方差分析,多重比较方法为LSD。统计分析及微生物生物量碳与原生动物的相关性分析(Pearson 指数)均在SPSS 16.0中进行,显著性差异水平为<0.05。
2 结果
2.1 管理模式对微生物生物量碳的影响
如表1所示,取样时间、取样深度和管理模式3因素对真菌、细菌生物量碳和微生物生物量总碳均有显著影响(<0.05)。整个取样期间,细菌生物量碳、真菌生物量碳和微生物生物量总碳平均值的变动范围 (0 ~ 20 cm) 分别为53.4 ~ 302.2 mg/kg、15.2 ~ 76.2 mg/kg和71.1 ~ 343.5 mg/kg。尽管8月份表层细菌生物量和10月份深层真菌生物量无显著差异(>0.05),但3项微生物生物量指标在不同管理模式间的对比均总体表现为有机模式>无公害模式>常规模式的规律,并在部分时间点和土层达到显著差异(<0.05)(图1)。对于三者的垂直分布,呈现出表聚性。但这种差异对于无公害和常规温室的真菌生物量碳并不明显。生物量碳的动态变化在3种管理模式下是一致的。其中细菌生物量碳和微生物生物量总碳的较为相似,在3个温室中,二者均在10月份达到峰值。真菌生物量碳则表现出先受到抑制,后升高的规律。其中表层土壤在11月份达到峰值。
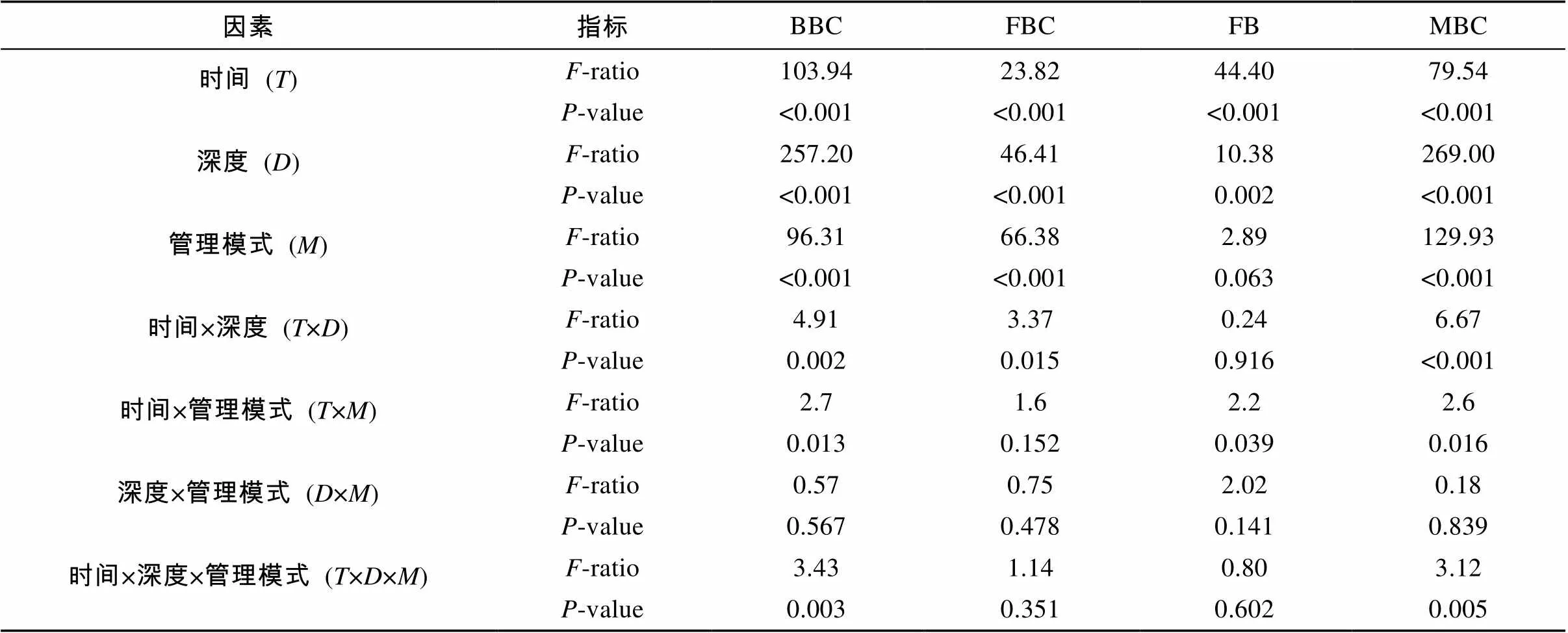
表1 取样期间微生物指标多因素方差分析
注:BBC:细菌生物量碳;FBC:真菌生物量碳;FB:真菌/细菌比率;MBC:微生物生物量总碳。<0.05表示差异显著。
取样时间和深度对真菌/细菌比率有显著影响(<0.05),而管理模式总体对其没有显著影响(> 0.05)(表1),尽管在8月份表层土壤和9月及12月的深层土壤出现了显著差异(<0.05)(图1)。在整个取样期间,不同管理模式下的真菌/细菌比率均小于1,反映出温室土壤的降解以细菌途径占优势。此外,其在3个温室中的动态变化规律相似,呈现出一定的波动,并在10月份达到最低值。

(ORG:有机模式;LOW:无公害模式; CON:常规模式。左侧图表示0 ~ 10 cm土层的指标;右侧图表示10 ~ 20 cm 土层的指标。ns表示同一时间同一土层处理间无显著差异;不同字母表示处理间差异显著(P<0.05),下图同)
2.2 管理模式对原生动物的影响
原生动物丰度和相对丰度的多因素方差分析如表2所示。管理模式和取样深度对鞭毛虫、纤毛虫、肉足虫和总原生动物丰度均有显著影响(<0.05),但取样时间对纤毛虫丰度没有显著影响。取样时间对原生动物各类群的相对丰度均有显著影响(<0.05),与之相反的是取样深度均无显著影响。管理模式仅对纤毛虫的相对丰度有显著影响(<0.05)。
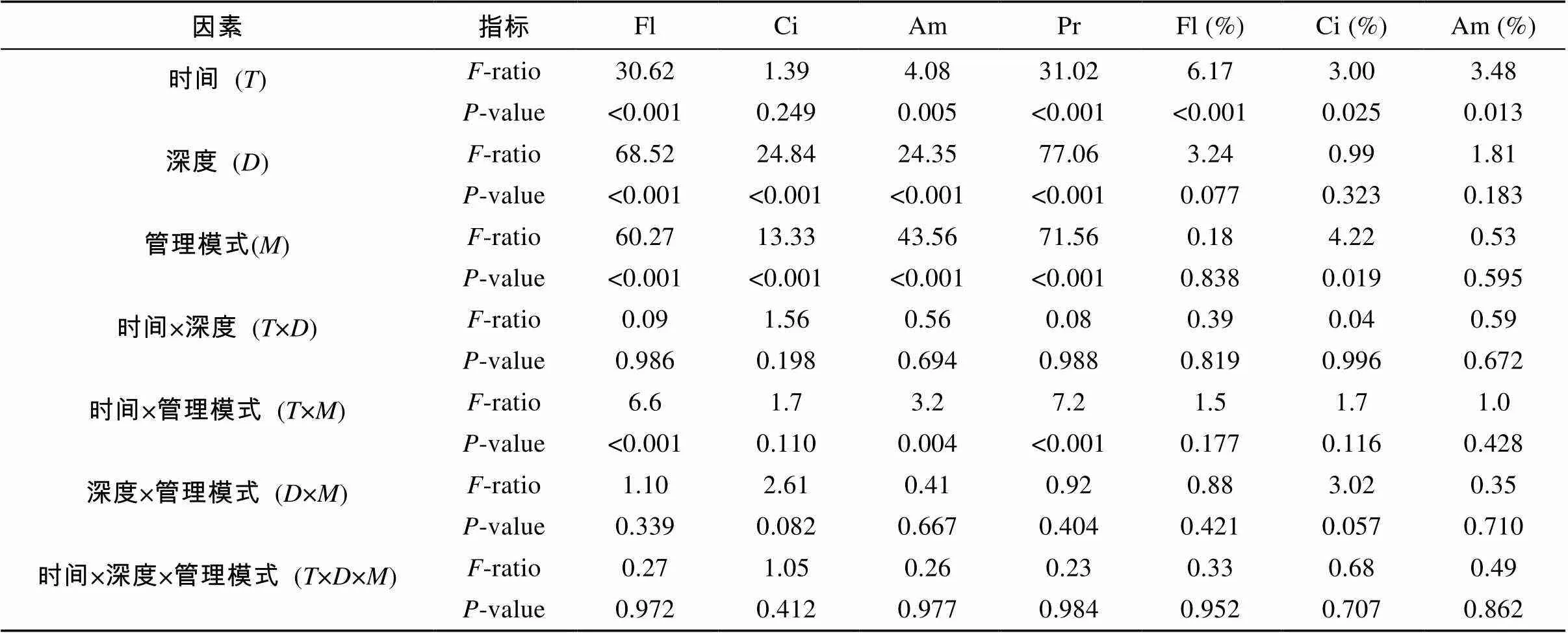
表2 取样期间原生动物指标多因素方差分析
注:Fl:鞭毛虫丰度;Ci:纤毛虫丰度;Am:肉足虫丰度;Pr:原生动物总丰度;Fl(%):鞭毛虫相对丰度;Ci(%):纤毛虫相对丰度;Am(%):肉足虫相对丰度。<0.05表示差异显著。
无论哪种种植模式,鞭毛虫均占绝对优势 (85.2%,= 90),其次是肉足虫 (13.1%,= 90),纤毛虫的比例最小 (1.7%,= 90)(图2)。原生动物丰度在不同管理模式下的变化见图3,在取样前期和末期,鞭毛虫在不同管理模式下的差异并不明显,但在中后期表现出有机模式高于无公害和常规模式的特征 (<0.05),鞭毛虫数量的动态规律为有机模式和无公害模式下均在10月份达到峰值,常规模式在9月份达到峰值。肉足虫在60% 的取样时间和土层中未发现处理间的显著差异(>0.05),但在11月份表现出有机模式明显大幅高于无公害和常规模式的规律(<0.05)。有机模式的肉足虫在11月份出现峰值,而无公害和常规模式的在10月份出现峰值。纤毛虫丰度在3种管理模式下的对比较为复杂,其中表层总体呈现为ORG>LOW>CON。在无公害和常规模式下,纤毛虫数量呈现出强烈的波动,而有机模式的较为平缓。对于原生动物的垂直分布,有机模式下各类群在整个取样期间均表现出明显的表聚性,而此情况在无公害和常规模式下仅在部分时间明显。各因素对原生动物总数的影响与鞭毛虫相似。

图2 不同管理模式下原生动物的相对丰度
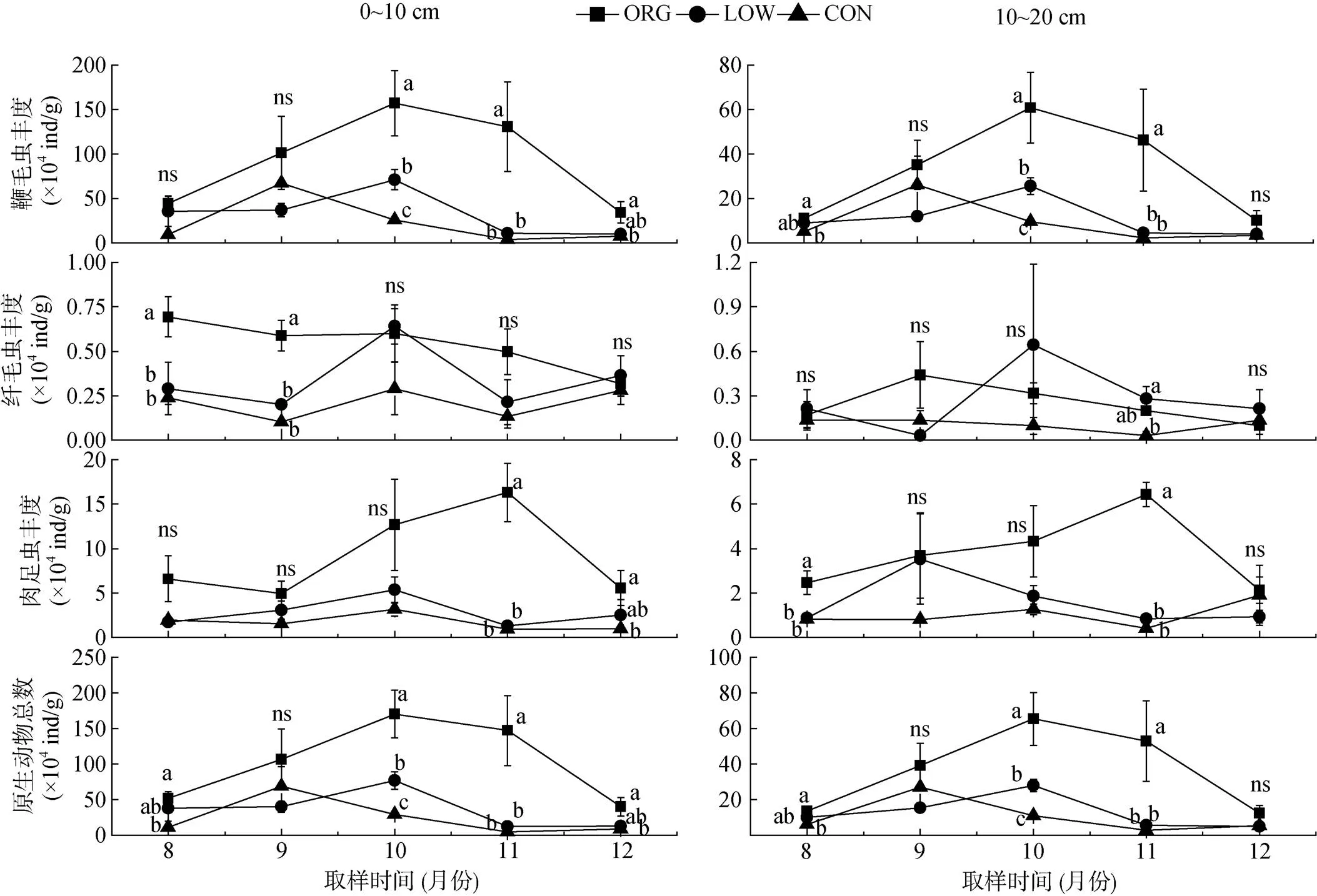
图3 取样期间不同管理模式下原生动物丰度动态
原生动物总数与各类群的丰度,均与细菌生物量碳、真菌生物量碳和微生物生物量总碳呈极显著正相关(<0.01)(表3)。
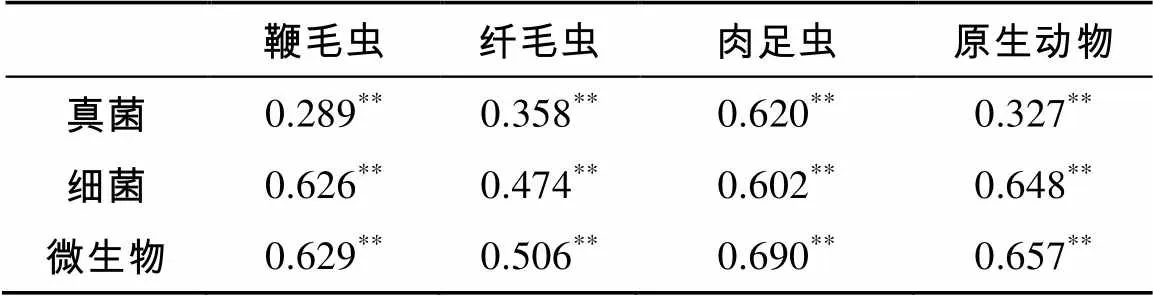
表3 原生动物丰度与微生物生物量碳的相关性分析
注:**表示相关性达到<0.01显著水平。
3 讨论
本研究涉及处理为3个独立的温室,不能够实现取样小区的随机排列,因此严格来讲属于伪重复试验设计。这样设计主要是由于在定位试验建立前考虑了兼顾研究、生产和维护成本等因素。土壤生物群落与土壤环境密切相关,因此独立温室的设计可能存在土壤本底异质性带来的系统误差,从而使试验结果具有一定的局限性。然而,本研究取样时定位试验已运转十多年,在集约化的、反复的农业措施影响下,经过多年土壤已形成成熟的生物群落特征,而农业措施的影响大于土壤空间本底异质性的影响,因此本研究的结果仍具有科学意义的代表性。
在农业生态系统中,土壤微生物生物量碳的变动范围通常为200 ~ 1 000 mg/kg[27]。胡诚[28]发现不同施肥处理农田的土壤微生物生物量碳的变动范围是104.6 ~ 399.3 mg/kg。而在此前的研究中(与本研究的处理设置相同),梁丽娜等[29]报导的范围是117.2 ~ 364.3 mg/kg。本研究所获得微生物生物量碳的变动范围 (71.1 ~ 343.5 mg/kg) 略低于以上的报导,这可能与采取的测定方法不同有关。以上报导均采用熏蒸法,而熏蒸法常高估微生物生物量碳[30-31];另一方面,本研究使用的荧光染色法又有可能造成低估。Scheu 和 Parkinson[32]认为细菌可能被土壤颗粒包裹而未被着色,或者染色不够充分。真菌菌丝与植物残骸常难以分辨,从而影响真菌生物量的准确测定[33]。
本试验中,细菌、真菌和微生物生物量碳在不同管理模式间的对比表现出一致的规律,即有机模式>无公害模式>常规模式。Fliessbach等[34]也发现有机模式下微生物生物量碳高于常规模式。有机模式中更高的微生物生物量碳源于更多的有机肥投入。有机肥可刺激土壤中细菌的大量繁殖[35], 同时增加真菌生物量[36]。刘益仁等[37]在一个有机无机肥配施的研究中发现提高有机肥施用的比例有助于增加细菌和真菌的数量。另一方面,无公害和常规温室中化肥的使用可能对微生物生物量碳产生抑制作用[12,38]。随着种植期的深入,培肥中养分逐渐释放到土壤中,细菌生物量碳逐渐升高,并在10月份达到峰值。真菌生物量碳则先出现了降低(9月份),主要原因是定殖前的整地翻土措施。物理扰动容易破坏菌丝从而影响真菌的生长[39],相比而言细菌则不受影响[40]。真菌生物量碳的峰值出现于11月,晚于细菌。可能与真菌生长速度较慢,周转周期更长有关[41]。
真菌/细菌比率是土壤食物网研究中的重要指标,其反映了整个食物网的结构和功能对不同土壤条件的响应[3]。在自然生境中,土壤降解以真菌途径支配[42],而农业系统中由于耕作、灌溉以及农业投入等因素,细菌途径在能量周转过程中的作用增强。本研究中,3种管理模式下均显示细菌途径占优势,反映出土壤中富含有机质,有较快的碳周转和养分循环速度[43-44]。尤其在作物生长的中期(10月份),真菌/细菌比率达到了最低值。在本试验中,尽管真菌和细菌的生物量碳在不同管理模式下均存在显著差异(<0.05),但真菌/细菌比率并没有显著差异(>0.05),说明3个温室具有相似的土壤条件;综合了施肥措施和病害防控措施的管理模式对土壤降解途径没有显著影响。
原生动物三大类群的比例在不同种植模式下均表现为鞭毛虫占优势,这点与此前的报导一致[45]。Chen等[46]也发现在温室土壤中,鞭毛虫在大部分取样时间中占绝对优势。而对于室外农田,大多研究显示肉足虫的比例最高[9,27,47-48]。由此体现了温室土壤原生动物群落结构与大田存在着较大差异[45]。本研究中无公害和常规模式下原生动物各类群数量及总数较为接近,并且低于有机模式,这与不同模式下的管理措施有很大关系。曹志平等[9]认为,有机肥的投入可以明显提高原生动物丰度。有机肥施入后通过食物网中强烈的上行效应,刺激以细菌为食的鞭毛虫和肉足虫的生长;其次,无公害和常规模式中化肥的投入可能对原生动物产生抑制作用[9],杀虫剂和杀菌剂的使用也会不同程度地抑制原生动物某些类群的数量[16]。相似的报导如Foissner[49]发现有机农田中有壳肉足虫的数量显著高于常规农田。整个研究期间原生动物丰度呈现不同程度的时空波动,一方面与人为扰动造成的直接影响有关;另一方面,间接作用如原生动物的食物和捕食者丰度也是重要影响因素。本试验中原生动物各类群丰度与细菌生物量碳均呈极显著正相关,反映了食物可能是原生动物较为明显的限制因素。但由于未对原生动物类群做进一步分类,尚不好判断其中的捕食者与被捕食者数量是否存在明确的对应关系。仅可以推断,温室土壤中大量鞭毛虫以取食细菌的异养型鞭毛虫为主。原生动物的捕食者包括大型原生动物和线虫,因此对原生动物动态的解释,还应结合其他土壤动物的动态变化[9]。
管理模式对原生动物各类群相对丰度的影响明显小于对绝对数量的影响,尤其对于鞭毛虫和肉足虫,管理模式对二者没有显著影响。由此看出管理模式对原生动物的影响主要表现在生物量上,而对结构的影响较小。这点与本试验得到的真菌细菌比率结果具有相似之处。Postma-Blaauw[50]认为集约化农业体系对大型土壤动物(如蚯蚓,捕食性螨)功能群多样性和组成的影响大于小型土壤生物(如线虫)。相应地,管理模式对土壤生物的影响也可能因生物体型的大小而异。因此,对于日光温室条件下不同管理模式的土壤食物网结构及功能是否存在差异,以及差异的程度,尚需结合其他土壤动物类群的试验结果作进一步分析。
4 结论
对微生物生物量碳和原生动物丰度的监测显示:温室条件下土壤有机物的降解以细菌途径占优势,鞭毛虫是最为丰富的原生动物。细菌、真菌和微生物生物量碳在不同温室间总体均呈现有机模式>无公害模式>常规模式的规律;对于原生动物,不同类群呈现出复杂的动态变化规律,总体上有机模式下原生动物数量高于无公害和常规模式的。真菌细菌比率、鞭毛虫和肉足虫的相对丰度在不同温室间则无显著差异。由此说明,管理模式对微生物生物量碳和原生动物的影响主要体现在生物量上,而对功能群结构组成的影响较小。
[1] 徐阳春, 沈其荣, 冉炜. 长期免耕与施用有机肥对土壤微生物生物量碳、氮、磷的影响[J]. 土壤学报, 2002, 39(1): 89–96
[2] 王继红, 刘景双, 于君宝, 等. 氮磷肥对黑土玉米农田生态系统土壤微生物量碳、氮的影响[J]. 水土保持学报, 2004, 18(1): 35–38
[3] 曹志平, 李德鹏, 韩雪梅. 土壤食物网中的真菌/细菌比率及测定方法[J]. 生态学报, 2011, 31(16): 4741–4748
[4] Malik A A, Chowdhury S, Schlager V, et al. Soil fungal: Bacterial ratios are linked to altered carbon cycling[J]. Frontiers in Microbiology, 2016, 7: 1247
[5] Foissner W. Soil protozoa as bioindicators: Pros and cons, methods, diversity, representative examples[J]. Agriculture, Ecosystems and Environment, 1999, 74(1): 95–112
[6] Foissner W. Soil protozoa: Fundamental problems, ecological significance, adaptations in ciliates and testaceans, bioindicators, and guide to the literature[J]. Progress in Protistology, 1987, 2: 69–212
[7] Ekelund F, Rønn R. Notes on protozoa in agricultural soil with emphasis on heterotrophic flagellates and naked amoebae and their ecology[J]. FEMS Microbiology Reviews, 1994, 15(4): 321–353
[8] Griffiths B S. Soil nutrient flow//Darbyshire J F. Soil Protozoa[M]. Oxford: CAB, 1994: 65–91
[9] 曹志平, 陈国康, 张凯, 等. 不同土壤培肥措施对华北高产农田原生动物丰度的影响[J]. 生态学报, 2005, 25(11): 2992–2996
[10] Bonanomi G, De Filippis F, Cesarano G, et al. Organic farming induces changes in soil microbiota that affect agroecosystem functions[J]. Soil Biology and Biochemistry, 2016, 103: 327–336
[11] 胡诚, 曹志平, 叶钟年, 等.不同的土壤培肥措施对低肥力农田土壤微生物生物量碳的影响[J]. 生态学报, 2006, 26(3): 808–814
[12] 曹志平, 胡诚, 叶钟年, 等. 不同的土壤培肥措施对低肥力农田土壤微生物生物量碳的影响[J]. 生态学报, 2006, 26(5): 1486–1493
[13] 蔡冰杰, 范文卿, 王慧, 等. 不同有机物料对微域内土壤原生动物和线虫的影响[J]. 土壤学报, 2017, 54(3): 713–721
[14] 路怡青, 朱安宁, 张佳宝, 等. 免耕和秸秆还田对潮土酶活性及微生物量碳氮的影响[J]. 土壤, 2013, 45(5): 894–898
[15] Helgason B L, Walley F L, Germida J J. Fungal and bacterial abundance in long-term no-till and intensive-till soils of the Northern Great Plains[J]. Soil Science Society of America Journal, 2009, 73(1): 120–127
[16] Foissner W. Protozoa as bioindicators in agroecosystems, with emphasis on farming practices, biocides, and biodiversity[J]. Agriculture, Ecosystems and Environment, 1997, 62(2): 93–103
[17] Griffiths B S. Enhanced nitrification in the presence of bacteriophagous protozoa[J]. Soil Biology and Biochemistry, 1989, 21(8): 1045–1051
[18] Bulluck L R, Brosius M, Evanylo G K, et al. Organic and synthetic fertility amendments influence soil microbial, physical and chemical properties on organic and conventional farms[J]. Applied Soil Ecology, 2002, 19(2): 147–160
[19] Clark M S, Horwath W R, Shennan C, et al. Changes in soil chemical properties resulting from organic and low-input farming practices[J]. Agronomy Journal, 1998, 90(5): 662–671
[20] Reganold J P, Palmer A S, Lockhart J C, et al. Soil quality and financial performance of biodynamic and conventional farms in New Zealand[J]. Science, 1993, 260(5106): 344–349
[21] Reganold J P, Wachter J M. Organic agriculture in the twenty-first century[J]. Nature Plants, 2016, 2(2): 15221
[22] 杨合法, 范聚芳, 戈志奇, 等. 有机、无公害及常规生产模式番茄病害及防治效果比较研究[J]. 中国生态农业学报, 2009, 17(5): 933–937
[23] 李钰飞, 郑春燕, 李吉进, 等. 不同管理模式对温室土壤螨群落结构的影响[J]. 生态学报, 2016, 36(12): 3802–3811
[24] Bloem J, Vos A. Fluorescent staining of microbes for total direct counts//Kowalchuk G A, de Bruijn F J, Head F J, et al. Molecular Microbial Ecology Manual[M]. Dordrecht: Kluwer Academic Publishers, 2004: 861–873
[25] Pual E A, Harris D, Klug M, et al. The determination of microbial biomass//Robertson G P, Coleman D C, Bledsoe C S, et al. Standard soil methods for long-term ecological research[M]. New York: Oxford University Press, 1999: 291–317
[26] 尹文英. 中国亚热带土壤动物[M]. 北京: 科学出版社, 1992: 83–86
[27] Martens R. Current methods for measuring microbial biomass C in soil: Potentials and limitations[J]. Biology and Fertility of Soils, 1995, 19(2/3): 87–99
[28] 胡诚. 不同施肥条件下土壤线虫群落结构及其生态功能研究[D]. 北京: 中国农业大学, 2007
[29] 梁丽娜, 李季, 杨合法, 等.不同蔬菜生产模式对日光温室土壤质量的影响[J]. 农业工程学报, 2009, 25(8): 186–191
[30] Bloem J, Lebbink G, Zwart K B, et al. Dynamics of microorganisms, microbivores and nitrogen mineralisation in winter wheat fields under conventional and integrated management[J]. Agriculture, Ecosystems and Environment, 1994, 51(1): 129–143
[31] Ingham E R, Horton K A. Bacterial, fungal and protozoan responses to chloroform fumigation in stored soil[J]. Soil Biology and Biochemistry, 1987, 19(5): 545–550
[32] Scheu S, Parkinson D. Changes in bacterial and fungal biomass C, bacterial and fungal biovolume and ergosterol content after drying, remoistening and incubation of different layers of cool temperate forest soils[J]. Soil Biology and Biochemistry, 1994, 26(11): 1515–1525
[33] Frey S D, Elliott E T, Paustian K. Bacterial and fungal abundance and biomass in conventional and no-tillage agroecosystems along two climatic gradients[J]. Soil Biology and Biochemistry, 1999, 31(4): 573–585
[34] Fliessbach A, Oberholzer H R, Gunst L, et al. Soil organic matter and biological soil quality indicators after 21 years of organic and conventional farming[J]. Agriculture, Ecosystems and Environment, 2007, 118(1): 273–284
[35] Bulluck L R, Ristaino J B. Effect of synthetic and organic soil fertility amendments on southern blight, soil microbial communities, and yield of processing tomatoes[J]. Phytopathology, 2002, 92(2): 181–189
[36] Mabuhay J A, Nakagoshi N, Isagi Y. Microbial responses to organic and inorganic amendments in eroded soil[J]. Land Degradation and Development, 2006, 17(3): 321–332
[37] 刘益仁, 郁洁, 李想, 等. 有机无机肥配施对麦-稻轮作系统土壤微生物学特性的影响[J]. 农业环境科学学报, 2012, 31(5): 989–994
[38] Hopkins D W, Shiel R S. Size and activity of soil microbial communities in long-term experimental grassland plots treated with manure and inorganic fertilizers[J]. Biology and Fertility of Soils, 1996, 22(1/2): 66–70
[39] Strickland M S, Rousk J. Considering fungal: Bacterial dominance in soils–Methods, controls, and ecosystem implications[J]. Soil Biology and Biochemistry, 2010, 42(9): 1385–1395
[40] Hendrix P F, Parmelee R W, Crossley D A, et al. Detritus food webs in conventional and no-tillage agroecosystems[J]. Bioscience, 1986, 36(6): 374–380
[41] Blagodatskaya E V, Anderson T H. Interactive effects of pH and substrate quality on the fungal-to-bacterial ratio and qCO2of microbial communities in forest soils[J]. Soil Biology and Biochemistry, 1998, 30(10/11): 1269–1274
[42] Bardgett R D, Hobbs P J, Frostegård Å. Changes in soil fungal: Bacterial biomass ratios following reductions in the intensity of management of an upland grassland[J]. Biology and Fertility of Soils, 1996, 22(3): 261–264
[43] Holtkamp R, Kardol P, van der Wal A, et al. Soil food web structure during ecosystem development after land abandonment[J]. Applied Soil Ecology, 2008, 39(1): 23–34
[44] Ingwersen J, Poll C, Streck T, et al. Micro-scale modelling of carbon turnover driven by microbial succession at a biogeochemical interface[J]. Soil Biology and Biochemistry, 2008, 40(4): 864–878
[45] 陈云峰, 曹志平. 甲基溴消毒对番茄温室土壤食物网的抑制[J]. 生态学报, 2010, 30(24): 6862–6871
[46] Chen Y F, Cao Z P, Popescu L, et al. Survey of the soil food web structure in a greenhouse environment[J]. Pedosphere, 2014, 24(2): 258–270
[47] Brussaard L, Bouwman L A, Geurs M, et al. Biomass, composition and temporal dynamics of soil organisms of a silt loam soil under conventional and integrated management[J]. Netherlands Journal of Agricultural Science, 1990, 38(3A): 283–302
[48] Zwart K B, Burgers S L G E, Bloem J, et al. Population dynamics in the belowground food webs in two different agricultural systems[J]. Agriculture, Ecosystems and Environment, 1994, 51(1): 187–198
[49] Foissner W. Comparative studies on the soil life in ecofarmed and conventionally farmed fields and grasslands of Austria[J]. Agriculture, Ecosystems and Environment, 1992, 40(1): 207–218
[50] Postma-Blaauw M B, de Goede R G M, Bloem J, et al. Soil biota community structure and abundance under agricultural intensification and extensification[J]. Ecology, 2010, 91(2): 460–473
Effects of Different Management Practices on Microbial Biomass Carbon and Protozoa Abundance Under Greenhouse Conditions
LI Yufei1,2, LI Ji2*, LI Jijin1, YANG Hefa3
(1 Institute of Plant Nutrition and Resources, Beijing Academy of Agriculture and Forestry Sciences, Beijing 100097, China; 2 College of Resources and Environmental Science, China Agricultural University, Beijing 100193, China; 3 Quzhou Experimental Station of China Agricultural University, Quzhou, Hebei 057250, China)
Soil microbes and protozoa, as important members of soil biota, play key roles in soil ecological processes due to their abundances and communities closely associated with various agricultural activities. In this paper, a comparative study was conducted to study the effects of organic (ORG), low input (LOW), and conventional (CON) vegetable greenhouse systems on soil microbial biomass carbon (bacterial and fungal biomass carbon) and protozoa abundance. Soil samples were collected five times from August to December 2012 (an entire cucumber growing season) in the Quzhou Experimental Station of China Agricultural University. The results showed that the management practices significantly affected soil fungal biomass carbon, bacterial biomass carbon, microbial biomass carbon, flagellate abundance, ciliate abundance, amoeba abundance and total protozoa abundance, but did not affect the fungal to bacterial (FB) ratio and the relative abundances of flagellates and amoebae. Generally, soil bacterial, fungal, and microbial biomass carbon values were in an order of ORG > LOW > CON, and this trend was more obvious in 0-10 cm soil. FB ratio indicated a bacterial-based decomposition pathway in all three systems, which exhibited similar dynamic characteristics. For protozoa, flagellates dominated under all three management practices, with a mean proportion of 85.2%, followed by amoebae (13.1%), and ciliates (1.7%). The total protozoa under ORG management practice were higher than those under LOW and CON management practices. In conclusion, management practice mainly affects the biomass of microbes and protozoa, whereas little effect on the functional group structure of soil biota.
Microbial biomass carbon; Protozoa; Fungal to bacterial ratio; Greenhouse; Organic management practices; Low input management
北京市农林科学院青年科研基金项目(QNJJ201612)、北京市自然科学基金青年项目(5174034)、北京市优秀人才青年骨干个人项目(2016000020060G128)和国家重点研发计划项目(2016YFD0800602)资助。
(liji@cau.edu.cn)
李钰飞(1985—),男,北京人,博士,助理研究员,主要从事土壤生态学研究。E-mail: liyf15@163.com
10.13758/j.cnki.tr.2018.04.007
S154
A
