污水处理厂中典型内分泌干扰物的去除效果研究
2018-09-28周开茹龚剑熊小萍许素哗唐焕文刘小山
周开茹,龚剑,熊小萍,许素哗,唐焕文*,刘小山*
1. 广东医科大学公共卫生学院/东莞市环境医学重点实验室,广东 东莞 523808;2. 广州大学环境科学与工程学院,广东 广州 510006
内分泌干扰物(Endocrine disrupting chemicals,EDCs)是对保持动态平衡的生物体内天然激素起干扰作用的外源物质,可通过核受体或内分泌激素的合成、分泌、传递和清除两种途径影响生物的发育、繁殖和行为,其作为一类新型的环境污染物逐渐引起了国内外学者的广泛关注(Kang et al.,2014)。大量数据表明,世界各大水体均受到不同程度的EDCs污染,EDCs在极低浓度下就可引起水生生物的生殖发育障碍(Hampl et al.,2016)。EDCs蓄积于水生生物体内,可通过食物链或饮用水等被人体吸收进而影响人体健康。人群流行病学研究显示,EDCs可使女性不孕、胎儿早产、早期卵巢功能衰退、激素水平异常;使男性前列腺癌发病率增加,精子量减少(Costa et al.,2014;Patel et al.,2015;Sweeney et al.,2015)。现有数据显示,污水处理厂中的污水是水体中EDCs的主要来源(Wang et al.,2016)。现有的污水处理工艺主要采用生物降解法,包括活性污泥法、厌氧/缺氧/好氧法(Anaerobic/Anoxic/Oxic,A/A/O)法、氧化沟法(Oxidation ditch,OD)法、膜生物反应器法等,这些处理工艺主要针对有机污染物、氮磷的去除,对微污染物如 EDCs的处理效果未知。研究显示,城市污水中 EDCs的处理效果受多种因素影响,如处理的工艺类型及操作的条件等(聂亚峰等,2011)。
化学分析法常被用于EDCs的测定,但应用此方法大规模检测环境样品时,往往费时费力,且此方法仅限于对已知目标物的分析,不能反映多种化合物可能产生的累加、协同等生物效应。目前已建立多种生物测试方法用于检测城市污水处理厂出厂水中的内分泌干扰活性,主要生物测试法有细胞增殖法、报告基因法、酶联免疫吸附法和重组酵母法等(马军等,2009),这些方法主要是用来检测与雌激素受体结合启动雌激素应答元件而产生内分泌干扰效应的环境雌激素类化合物。MVLN细胞试验法就是一种报告基因法,是在人乳腺癌细胞MCF-7雌激素应答原件上游插入了荧光素酶报告基因,能够通过荧光量强度检测化合物的雌激素受体结合活性(Pons et al.,2009)。事实上,许多EDCs是通过非受体介导的途径干扰内分泌系统,如干扰内分泌激素的合成、激活、转运与代谢等。研究发现,来源于人肾上腺皮质癌细胞NCI-H295R保留了类固醇激素合成途径,可以从激素水平、酶的活性及基因表达水平研究外源化合物类固醇激素的干扰效应(Wang et al.,2015)。USEPA已经将H295R作为EDCs第一阶段筛查的工具。前期研究显示,除了用来研究已知外源化合物的类固醇激素干扰效应外,H295R细胞试验还可用来研究环境样本中化合物的干扰效应(Liu et al.,2018;Kim et al.,2014)。
本研究选取东莞市2种不同处理工艺的城市污水处理厂,采用体外细胞法对工艺流程污水样品中的类固醇激素干扰物及雌激素活性物进行评价;同时结合化学分析方法,检测水中8种EDCs在工艺流程中的分布,进一步阐明污水处理厂工艺对此类EDCs的去除效果。
1 材料与方法
1.1 材料
化学分析实验材料:8种EDCs目标物为壬基酚(Nonlyphenol,NP)、辛基酚(Octylphenol,OP)、双酚A(Bisphenol A,BPA)、雌酮(Estrone,E1)、雌二醇(17β-Estradiol,E2)、雌三醇(Estriol,E3)、17α-乙炔基雌二醇(17α-Ethinglestradiol,EE2)和己烯雌酚(Diethylstilbestrol,DES)。甲醇与乙酸乙酯(HPLC级)购自Sigma Aldrich;玻璃纤维膜(GF/F,0.7 µm)购自Whatman;Oasis HLB固相萃取柱(500 mg,6 mL)购自Waters公司。
细胞实验材料:H295R、MVLN细胞获赠于韩国首尔大学公共卫生学院环境毒理学实验室(Kyungho Choi教授)。实验中使用的DMEM/F12培养基、丙酮酸钠和胎牛血清(Fetal Bovine Serum,FBS)均购自 Gibco;碳吸附胎牛血清(charcoal-stripped FBS)、腺苷酸环化酶激活剂(Forskolin)和胰酶购自 Sigma;Nu-serum 和ITs+Premix购自 BD;双抗和细胞级二甲基亚砜(DMSO)购自 Solarbio;ELISA 试剂盒(Estradiol 582251、Testosterone 582701)购自 Cayman Chemical;荧光素酶检测试剂盒 Steady-Glo Luciferase购自 Promega;细胞计数试剂盒(Cell Counting Kit,CCK-8)购自同仁公司;实时荧光定量试剂盒和 SYBR Premix Ex TaqTM II酶(Tli RNaseH Plus)购自 Takara;RT-PCR 仪(Thermo Fisher公司),Synergy多功能酶标仪(Bio Tek公司)。
1.2 采样方法
1.2.1 样品采集与前处理
选择东莞市 2个污水处理厂(Wastewater treatment plants,WWTPs)作为研究对象,A 厂(WWTP A)采用A/A/O处理工艺,B厂(WWTP B)采用OD处理工艺(图1),A厂取样点包括格栅出水(A1)、好氧池(A2)和紫外消毒(A3);B厂取样点包括格栅出水(B1)、氧化沟(B2)及紫外消毒(B3)。于2017年3月采集水样,为瞬时一次采样。采集后,水样储存于2.5 L棕色玻璃瓶中,4 ℃保存,24 h内完成处理。实验前分别用8 mL乙酸乙酯、甲醇与超纯水活化固相萃取(HLB)柱。污水样品经过玻璃纤维滤膜过滤后,用活化后的HLB柱富集。15 mL乙酸乙酯分3次,每次5 mL淋洗,将淋洗液分成两份,一份用氮气仪吹脱干燥后用DMSO定容至1 mL,-20 ℃冰箱保存,用于细胞实验(张秋亚等,2017);另一份制成 1 mL浓缩液后分次转移至250 µL内衬管,用温和氮气缓慢吹干,然后加入50 µL乙酸乙酯和100 µL衍生化试剂MSTFA,在70 ℃下反应30 min,冷却至室温后加入一定量内标物(terphenyl-d14),最后用乙酸乙酯定容至200 µL,进行GC-MS分析(龚剑等,2011)。
1.2.2 仪器分析
使用气质联用 GC-MS法检测水中常见 8种EDCs(BPA、NP、OP、DES、E1、E2、EE2、E3)浓度,分析方法见龚剑等(2011)。GC条件:载气为氦气,流速1 mL·min-1;水样以无分流方式进样。程序升温:初始温度为50 ℃,保持 1 min,以 20 ℃·min-1升至 200 ℃,然后以 3 ℃·min-1升至 280 ℃保持 2 min,最后以 30 ℃·min-1升至290 ℃保持5 min。MS条件:传输线温度为280 ℃,离子源温度为250 ℃,离子源为电子轰击源(EI),电子轰击能量为 70 eV。采用全扫模式(m/z=50~550)对样品进行定性分析,采用选择离子监测模式(SIM)对样品进行定量分析。在分析过程中同时运行QA/QC控制样品:方法空白、空白加标和样品重复样,并在分析前对所有样品进行添加回收率指示物标样。空白加标中目标化合物OP、NP、BPA、DES、E1、E2、EE2和E3的平均回收率和相对标准偏差(n=3)分别为(94.5%±4.4%)、(100.1%±7%)、(100.6%±8.8%)、(104.2%±17.4%)、(92.1%±8.8%)、(81.7%±2.9%)、(124.3%±10%)、(97.7%±12.2%)。方法空白中仅检测出 NP和 BPA,平均质量浓度分别为 1.6 ng·L-1和 10 ng·L-1,远低于样品中的含量,已在样品中扣除了空白。所有样品中回收率指示物NP-d4、BPA-d16、E1-d4 的回收率分别为(90%±5.2%)、(93.6±8.1%)、(104.2%±10%)。NP和BPA的校正曲线线性范围分别为 100~2000 ng·mL-1、20~500 ng·mL-1,其他目标化合物的校正曲线线性范围均为5~100 ng·mL-1,拟合度R2均大于0.99。BPA、NP、OP、DES、E1、E2、EE2、E3的检出限 LOQ分别为<1.0、5.0、1.6、<1.0、1.5、1.1、3.0、3.2 ng·L-1。

图1 春季A、B污水厂的工艺流程及采样点设置Fig. 1 Process and sampling points setting of WWTP A and WWTP B plants in spring
1.3 细胞实验
1.3.1 H295R与MVLN细胞培养
H295R细胞完全培养基的配置:DMEM/F12基础培养液,加入 2.5%(V/V)Nu-serum、1%ITS-Premix及1%双抗,细胞置于37 ℃、5% CO2培育箱中传代培养,每周换液2~3次。取对数生长期生长良好的细胞进行实验。
MVLN细胞完全培养基配置:DMEM/F12基础培养液加入10% FBS、1%丙酮酸钠、0.1%胰岛素、0.5%双抗。细胞置于 37 ℃、5% CO2培育箱中传代培养。
1.3.2 H295R细胞实验
H295R细胞是筛选环境类固醇激素干扰物的体外工具,本研究从激素和基因表达水平两个层次检测污水处理厂对此类干扰物的去除效果(周景明等,2009)。H295R 细胞以 3×105cells·mL-1接种于24孔板中(每孔1 mL),贴壁24 h后染毒。每个测试样品准备3个浓度梯度(100%、33%、11%),设置 DMSO溶剂对照组和空白对照组,以及阳性对照组(Forskolin处理),每个处理设置3个重复。为避免H295R细胞毒性的影响,首先进行CCK-8细胞活力测试,在无毒剂量下(细胞存活率>80%)分析水中EDCs对H295R细胞类固醇激素雌二醇(下文简称E2)和睾酮(Testosterone,下文中简称T)的水平及基因表达量的影响(Liu et al.,2012)。染毒48 h后收集培养基用于检测激素水平的变化,收集细胞用于检测类固醇合成的基因表达量变化,检测方法参照文献(Huang et al.,2011)。简而言之,培养液中E2和T经乙醚萃取后采用酶联免疫吸附法(ELISA)进行检测。细胞中总RNA用Trizol试剂提取,逆转录成cDNA后进行RT-PCR检测。RT-PCR检测的 10个类固醇合成基因为 StAR、HMGR、3βHSD2、CYP21、17βHSD4、17βHSD1、CYP19、CYP17、CYP11B2和CYP11A(Caron-Beaudoin et al.,2017;Kim et al.,2016),引物序列见表1。RT-PCR反应体系(10 μL):5 μL SYBR Green、1 μL cDNA 和 1 μL 正义/反义引物(表 1),DEPC水补足10 µL。RT-PCR程序:95 ℃保持30s,95 ℃ 30 s,60 ℃保持1 min,40个循环。以β-actin作为内参,倍数的变化采用 2-ΔΔCT法计算(Ding et al.,2007)。

表1 引物序列表Table 1 Sequence of all gene primers
1.3.3 MVLN细胞试验
利用 MVLN细胞检测污水中雌激素受体诱导的雌激素效应,为避免FBS中phenols对试验结果的影响,试验前24 h将FBS转换成charcol-stripped FBS。试验时,MVLN细胞用胰酶消化后离心制备单细胞悬液,以1.25×105cells·mL-1接种于96孔培养板中(每孔250 µL),贴壁24 h后染毒72 h。每个测试样品准备4个浓度梯度(100%、33%、11%、3.4%),设置DMSO溶剂对照组和空白对照组,每个浓度处理设置3个重复。为避免MVLN细胞毒性的影响,利用 CCK-8检测细胞活力,在无毒剂量下(细胞存活率>80%),用Steady-Glo Luciferase检测细胞内荧光量。实验中将E2稀释成6个浓度梯度(370、120、40、13、4、1.3 nmol·L-1),分别绘制剂量效应图,计算EC20(指毒性效应达到20%的剂量或浓度),按如下公式计算样品的雌二醇当量(Estradiol Equivalency quotient,EEQ,ng·L-1):

式中,EC20(S)为样品中的EC20。
1.4 数据分析
运用 SPSS 19.0软件进行数据统计分析,GraphPad Prism软件作图。实验结果用±s表示。组间差异采用单因素方差Dunnett法分析。两个统计变量的相关性评价采用 Spearman相关分析。P<0.05认为差异具有统计学意义(P<0.05记作*,P<0.01记作**)。
2 结果分析
2.1 化学分析结果
结果显示,A、B污水厂进水中OP、NP和BPA浓度最高(表2),其在A污水厂进水中的质量浓度分别为10782、9892、4543 ng·L-1,B污水厂中分别为2664、999、317 ng·L-1。A、B污水厂进水中雌激素类化合物浓度较低,DES、EE2均低于检出限。雌激素类物质浓度最高的是A污水厂进水中的E3,为24.5 ng·L-1。A、B两污水厂对酚类的去除率均在90%以上,而A污水厂出水中NP、BPA、OP依然分别高达808、584、74.8 ng·L-1;B污水厂出水中NP、BPA、OP质量浓度分别为61.8、12.6、5.6 ng·L-1。处理后,除E1在A污水厂出水中的质量浓度高达0.8 ng·L-1,其他雌激素化合物在两厂出水中均低于检出限,去除率达到100%。
2.2 H295R细胞实验结果
CCK8细胞毒性测试结果显示,所有样品及其稀释样对H295R与MVLN细胞无细胞毒性作用。

表2 两污水处理厂中8种EDCs在各个处理阶段的浓度及整体去除率Table 2 Concentrations and overall removal of eight EDCs in each treatment processes of two wastewater treatment plants
ELISA结果显示,A污水厂3个采样点水样初始浓度处理后E2水平均显著升高,T浓度水平呈下降趋势。B污水厂中进水B1及出水B3采样点水样初始浓度处理下E2水平均显著上升,T浓度水平没有显著变化或呈轻微的下降趋势。两污水厂间类固醇激素的变化没有显著差异(图2)。

图2 污水处理厂各采样点水样萃取物暴露后对H295R细胞中E2、T浓度的影响Fig. 2 Effects of WWTPs water sample raw extract on E2 and T level in H295R cell bioassay
A、B两污水厂水样经有机萃取后,类固醇基因StAR、17βHSD4、17βHSD1和CYP11A的表达没有显著变化(表3),HMGR、CYP11B2和CYP19基因表达均显著上升,而3βHSD2、CYP17和CYP21基因表达量在A厂污水处理后显著下降而在B厂出厂水处理后显著上升(图3)。

表3 污水萃取物对H295R细胞10种类固醇激素合成基因的表达量影响Table 3 Effects of water sample raw extracts on 10 major steroidogenesis gene expression in H295R cell
2.3 MVLN细胞实验结果
MVLN细胞染毒72 h后,检测荧光量,计算雌激素当量EEQ值。结果显示,A厂中EEQ值先上升后下降,A2处的雌激素活性最高,达 48.86 ng·L-1;B厂从B1到B3,雌激素活性依次下降。A、B厂出水EEQ分别为19.25、14.21 ng·L-1(表4)。

表4 A、B两厂各个处理阶段的EEQTable 4 EEQ in each treatment phase of WWTP A and WWTP B ng·L-1
2.4 相关性分析
Spearman相关性分析结果显示,春季A、B厂酚类物质OP、NP、BPA与E2浓度的变化没有显著相关性(P>0.05)(图4);烷基酚类物质(OP与NP相加之和)与E2浓度的变化也没有显著相关性(P>0.05)(图5)。
3 讨论
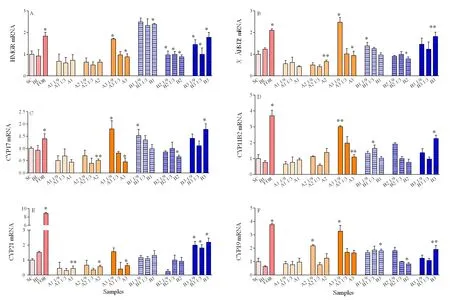
图3 污水处理厂各采样点水样萃取物暴露后对H295R细胞中类固醇合成基因表达量的影响Fig. 3 Effects of WWTPs water sample raw extracts on the expression of steroidogenesis genes in H295R Cells

图4 OP、NP、BPA在春季A、B厂中各个处理阶段的浓度与E2浓度变化的相关性分析Fig. 4 Correlation between concentrations of OP, NP, BPA and concentration of E2 in WWTP A and WWTP B plants

图5 烷基酚(Alkyl phenol,AP)在A、B厂中各个处理阶段的浓度与E2浓度变化的相关性分析Fig. 5 Correlation between concentrations of AP and concentration of E2 in WWTP A and WWTP B plants
两污水处理厂进水中均测出高浓度的酚类化合物,而雌激素化合物浓度较低。NP在A、B污水厂进水中分别高达 10782 ng·L-1,2664 ng·L-1,高于云南、浙江等其他污水厂进水中的浓度(Huang et al.,2014;Lv et al.,2016)。此外,BPA及OP的浓度也高于其他污水中浓度,而A、B污水厂中雌激素化合物在进水中的浓度均低于北京、捷克、阿根廷等其他污水厂(Garriz et al.,2015;Vymazal et al.,2015;Zhou et al.,2012)。王凌云等(2012)等报道深圳污水厂进水中EE2含量高达60.4~895.5 ng·L-1,而 NP 含量较低(8.1~34.6 ng·L-1)。经过处理后,A、B污水厂出水中酚类浓度依然很高,尤其是 A污水厂出水中 NP、BPA浓度分别高达808、584 ng·L-1,远高于受体水域东江中此类化合物的浓度(周自严,2015)。龚剑等(2011)研究发现在东莞东河段的沉积物中 BPA的污染水平高于珠江广州河段,天然雌激素类物质则在珠江广州河段污染较严重。本研究显示,东莞污水排放可能是导致这种分布特征的原因之一。BPA是工厂生产聚碳酸酯塑料、铝罐的原材料之一;而NP主要来源于工厂生产烷基酚乙氧酚表面活性剂的代谢物(Jagne et al.,2016)。A污水厂中的EDCs含量整体高于B污水厂,可能与A污水厂经常受到工业废水污染有关。生物降解法主要是通过污泥吸附与生物降解的作用实现对EDCs的去除。有研究显示,污水处理工艺及处理时的温度、pH值、季节、污泥停留时间等均会影响有机污染物的去除效果(Nie et al.,2012)。本研究中,A/A/O和OD污水处理工艺对BPA、OP和NP等不同EDCs均有较高的去除率,去除率达90%以上,对雌激素类物质去除率达到100%,而Huang et al.(2014)研究显示,A/A/O法对EE2的去除率仅为75.4%。Xu et al.(2012)研究发现,在水力停留时间为1 h的条件下,活性污泥法对E2的去除率为95%,在水力停留时间为5 h时去除率可达100%。同等条件下,同一类物质受季节影响去除率也各不相同。冬秋季温度低,降低了污泥中酶的活性,间接影响去除率的高低。相关研究发现,BPA在夏季的去除率为99%,而在冬季的去除率仅为44%;EE2在夏季的去除率为100%,而在秋季的去除率仅为75.7%(Nie et al.,2012)。
H295R细胞实验结果显示,A、B污水厂进水粗提物经处理后,相比于对照组,E2浓度显著增加而T浓度呈下降趋势,出水粗提物经处理后,与进水的变化一致,提示经过处理后,A、B污水厂对通过内固醇激素途径导致的雌激素效应物的去除效率不高。Kim et al.(2014)利用H295R细胞研究了钢铁厂污水及城市污水的内分泌干扰活性,也观察到了类似的现象,并推测产生这个效应的主要物质是水中多环芳烃类及酚类物质。而本研究中,A、B污水厂出水粗提物中依然存在较高浓度的BPA、NP和OP,这些化学物单独处理H295R细胞后,通过不同的机制导致 E2浓度的上升(Bistakova et al.,2017)。虽然化学分析结果显示,相对于进水,出水中酚类化合物浓度均大大降低,但通过内固醇途径产生的雌激素效应没有显著降低,说明出水中BPA、NP和OP的浓度较高。此外,污水中其他具有此类雌激素效应的污染物如多环芳烃等不容忽视(Villeneuve et al.,2002)。生物学方法与化学方法的相关性检验结果显示,春季A、B污水厂酚类物质OP、NP、BPA与E2浓度变化无相关关系,提示两个污水处理厂出水中除了酚类化合物,其他可干扰类固醇激素合成通道的化合物或者酚类化合物的混合效应不容忽视。
类固醇合成基因表达量检测结果显示,A、B污水厂的出水处理后HMGR、CYP19、CYP11B2表达量显著上升,与E2浓度增加的结果吻合。HMGR基因表达的是3-羟基-3-甲基戊二酰辅酶A还原酶,是一种催化胆固醇合成的限速反应酶(Wang et al.,2015),CYP19基因表达的芳香化酶可催化睾酮转化为雌二醇(Lee et al.,2013;Ding et al.,2007),这两个基因的高表达解释了 E2浓度的增加;而CYP11B2基因的高表达揭示除性激素外,污水中还有一些化合物可通过醛固醇激素水平,影响机体正常的代谢平衡(Kang et al.,2016)。3βHSD2、CYP17和CYP21是类固醇合成通道上3个重要的基因,这3种基因在A3处高表达而在B3处低表达,揭示A、B污水厂中类固醇激素合成干扰物的干扰机制并不完全一致。
MVLN细胞实验结果显示,A污水厂中的雌激素活性呈先上升后下降趋势,出水A3处的EEQ跟进水A1处一样,而B污水厂中随着雌激素的降解或吸附,雌激素活性降低,B3处的雌激素活性明显低于 B1。张照韩等(2011)研究也发现,经过二沉池后EEQ轻微上升,推测可能是沉降过程中,污泥中所含的雌激素活性物质重新溶解所致。而本研究中,A污水厂进入二沉池后EEQ明显下降,推测可能是吸附在污泥上的雌激素活性物随着污泥沉淀而致。杨先海等(2016)研究发现,酚类物质包括 BPA也具有雌激素活性。虽然化学分析结果显示,处理后酚类化合物和雌激素化合物浓度均呈显著降低,但是雌激素活性并没有降低,A、B污水厂出水中EEQ分别高达19.25、14.21 ng·L-1,明显高于其他污水处理厂出厂水 EEQ及自然水域中EEQ(张秋亚等,2017;李红萍等,2016;刘芸等,2011)。隋倩等(2009)等通过对4类32种EDCs的生态风险熵和雌二醇当量浓度进行评分和排序,得出炔雌醇、雌酮、壬基酚、双酚A是中国城市污水处理厂优先控制的4种污染物。本研究结果显示,A、B污水厂中优先控制的污染物是壬基酚和双酚A。虽然化学分析结果显示A、B污水厂出厂水中雌激素化合物已经基本去除,但是雌激素效应依然存在。究其原因,OP、NP或BPA也具有雌激素受体结合活性(Laws et al.,2000)。此外,李清雪等(2016)研究发现,污水厂中含有高浓度的多氯联苯、多环芳烃、邻苯二甲酸酯类、酚类和有机氯农药,这些化合物具有不同程度的雌激素效应(Tiwari et al.,2016)。
4 结论
化学分析结果显示,两个污水厂进水中 3种酚类化学物浓度较高,而5种雌激素化学物浓度较低,污水厂对这8种常见EDCs的去除主要发生在生物处理阶段,去除率均超过 90%。虽然去除效果较好,但是污水中尤其是A污水厂进水中3种酚类化合物浓度高,且出水中浓度依然较高,应作为A污水厂去除控制重点。H295R与MVLN细胞实验结果显示,污水处理厂出厂水中类固醇激素合成干扰效应及雌激素活性依然存在。Spearman相关性分析结果显示,类固醇激素水平与水中酚类物质浓度没有显著的相关性。相对于化学分析,生物学效应更能体现污水厂的出水中EDCs可能引起的生态与健康风险。
