溶解氧对短程硝化稳定性及功能菌群的影响
2018-09-25杨玉兵杨忠启黄斯婷周薛扬刘秀红
杨 庆,杨玉兵,杨忠启,黄斯婷,周薛扬,刘秀红
溶解氧对短程硝化稳定性及功能菌群的影响
杨 庆,杨玉兵,杨忠启,黄斯婷,周薛扬,刘秀红*
(北京工业大学城镇污水深度处理与资源化利用技术国家工程实验室,北京 100124)
在常温条件下,采用序批式反应器(SBR)研究不同溶解氧(DO)浓度对短程硝化稳定性的影响.在低DO(0.5mg/L)条件下,前75个周期可以一直维持短程硝化,亚硝积累率(NAR)在80%以上,但是随着运行周期增加,NAR逐渐减少,到105个周期已完全变为全程硝化.通过接种同一污泥提高DO浓度到2.5mg/L,经过180个周期,NAR始终在90%以上,能够长期维持短程硝化的稳定运行.通过不同DO条件下AOB和NOB的氧半饱和常数对比分析及qPCR试验研究,结果表明长期低DO条件下容易使的生长获得优势,是影响短程硝化稳定的重要因素,高DO条件下,AOB对溶解氧具有更高的亲和力,通过提高供氧浓度的策略,可以维持短程硝化的长期稳定.
溶解氧;短程硝化;氨氧化菌;亚硝酸盐氧化菌;氧半饱和常数
与传统硝化反硝化工艺相比,短程硝化工艺能够节省曝气能耗、缩短反应时间、节省反硝化碳源、减少污泥生成量等优点[1-2],实现短程硝化的关键在于氨氧化细菌(AOB)的富集以及亚硝酸氧化菌(NOB)的抑制和淘洗[3].迄今为止,已建立了一些可行的实现短程硝化的控制手段和策略,主要包括低溶解氧(DO)、高温、SRT控制、游离氨抑制、运行方式及曝气时间控制等[4-5].普遍认为,AOB的氧半饱和常数小于NOB[6],在低DO条件下,氨氧化菌(AOB)的活性大于亚硝酸盐氧化菌(NOB),NOB在低DO条件下受到抑制而逐步被淘汰.Blackburne等[7]基于该理论在低DO(0.4mg/L)和SRT为2.4d的条件下,实现90%的亚硝积累,张功良等[8]控制DO(0.9~1.5)mg/L也实现了短程硝化,可见大多数研究在低DO条件下实现了短程硝化.然而有研究表明长期低溶解氧会导致活性污泥解体和发生丝状菌膨胀[9],此外,溶解氧浓度会影响反应器内微生物的群落结构与活性[10].因此,即使某些条件实现了短程硝化,但是并未能够长期维持稳定,短程硝化是实现一些主流脱氮技术(短程-厌氧氨氧化、CANON)的关键,实现该工艺的关键是维持短程硝化长期稳定,本文采用Monod方程拟合AOB和NOB的氧半饱和常数并结合qPCR的分析方法,研究维持短程硝化长期稳定的策略,对其实际应用具有重要作用.
1 材料与方法
1.1 试验装置与方法
1.1.1 短程硝化SBR反应装置 SBR反应装置材质为有机玻璃,有效容积19.5L,高1100mm,内径150mm,试验装置如图1所示.每天运行一个周期,整个反应过程中,由加热棒和温控系统控制反应温度在25℃,好氧反应阶段由空气压缩机曝气,低DO系统和高DO系统分别控制溶解氧浓度为(0.5±0.1)mg/L和(2.5±0.5)mg/L;缺氧阶段投加乙醇作为反硝化碳源,整个反应过程一直进行搅拌,以保持系统内泥水混合状态,好氧缺氧反应时间按照实时控制策略[11]运行,反应结束后沉淀30min,排水12L.

图1 SBR试验装置示意
1.1.2 氧半饱和常数批次试验装置与方法 分别取1L低DO系统运行第105d和高DO系统运行第125d曝气结束后的混合污泥,洗涤3次后,加入到1L烧杯中,利用磁力搅拌器搅拌,流量计控制流量,保持25℃恒定,试验装置如图2.采用SBR反硝化出水作为批次试验进水.批次试验过程中,加入反硝化出水后,先曝气30min以去除剩余COD,之后再加入硫酸铵或亚硝酸钠作为基质.NH4+-N(硫酸铵):25mg/L, NO2--N(亚硝酸钠):10mg/L,利用1mol/L NaHCO3调节初始pH值为7.8.低DO小试系统控制DO为0.2,0.4,0.6,0.8,1.2mg/L,高DO小试系统控制DO为0.2,0.6,1.2,1.8,2.4mg/L.
每一个DO浓度做3个平行周期,每个DO浓度先做AOB的氧半饱和常数(只加硫酸铵),之后再做NOB的氧半饱和常数(只加亚硝酸钠).DO浓度从低到高.根据数据绘制得出每个DO浓度水平下的比氨氧化速率和比亚硝酸盐氧化速率.最后用Origin拟合Monod方程,得出活性污泥中AOB和NOB的氧半饱和常数.

图2 批次试验反应装置
1.2 进水水质与测定方法
1.2.1 接种污泥与进水水质 试验所用种泥取自稳定运行的大型中试短程SBR内活性污泥,污水取自北京市某家属小区实际生活污水.进水水质和控制参数如表1.
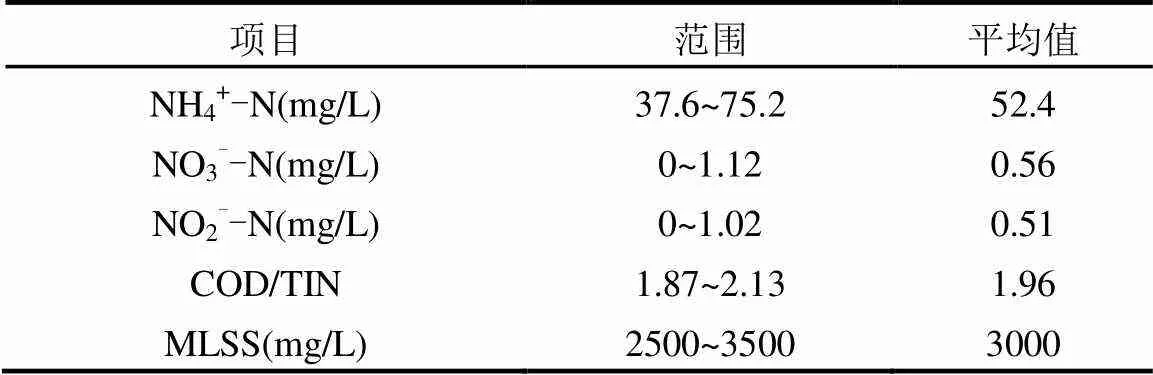
表1 试验水质情况
1.2.2 水质测定方法 COD采用快速消解分光光度法测定; NO2--N采用N-(1-萘基) -乙二胺光度法测定[12],NO3--N采用麝香草酚分光光度法测定[12], NH4+-N采用纳氏试剂分光光度法测定[12];MLSS采用滤纸重量法测定; Multi340i型便携式多功能pH值和DO测定仪在线测定反应过程中的pH值和DO浓度.
1.3 DNA的提取与实时荧光定量PCR分析方法
提取活性污泥样品DNA前,将样品置于冻干机中冻干3d.称取约0.05g冻干污泥样品,按照FastDNA®SPIN Kit for Soil试剂盒的操作说明书提取DNA,之后利用BioSpec-nano(SHIMADZU,Japan)测定DNA浓度和纯度.
将所得的质粒标准品用灭菌纯水进行10倍梯度稀释,分别稀释成1×102~1×109copies/µL,建立标准曲线.对于标准品和未知样品,每个样品分别做3个平行,并设置阴性对照,即模板用等量的无菌纯水替代.qPCR反应体系为20µL,采用SYBR®Premix Ex Taq™ II(Taraka,Japan)试剂.反应所使用的引物见表2,各引物反应程序分别总结如下[13]:
(1)AOB的qPCR定量,按照预变性:95℃30s;基因扩增:95℃5s,58℃30s,72℃40s (40个循环);溶解曲线:95℃15s,60℃30s,95℃15s(1个循环).
(2)r(NOB)的16s基因qPCR定量,按照预变性:95℃30s;基因扩增:95℃5s,52℃30s,72℃40s (40个循环);溶解曲线:95℃15s,60℃30s,95℃15s(1个循环).
(3)(NOS)的16s基因qPCR定量,按照预变性:95℃30s;基因扩增:95℃5s,60℃20s,72℃30s (40个循环);溶解曲线:95℃15s,60℃30s,95℃15s(1个循环).
试验完成,确认扩增效率 Efficiency 为 90%~ 120%之间,标准曲线线性关系2>0.98, 溶解曲线为单一峰,满足以上条件后,由反应标准曲线计算得到未知样品的定量结果.

表2 qPCR反应引物总结
2 结果与讨论
2.1 不同DO条件下短程硝化维持情况
2.1.1 低DO条件下短程硝化破坏 低DO (0.5mg/L)条件下SBR的运行效果如图3,短程硝化过程中,NO2--N的生成量随着进水NH4+-N波动,当进水NH4+-N浓度较高时,NO2--N生成量也较高.NO3--N在运行期间生成量很小,维持在2mg/L以下.到45周期,NAR为92.8%,但是NAR随着运行周期增加逐渐降低,说明系统已经不稳定.在105周期时,NAR明显下降,到130周期,逐渐降低至7.3%,短程硝化已经破坏,到162周期NAR为4.5%.短程硝化破坏后,SBR运行以全程硝化反硝化的形式运行,DO浓度和温度控制策略不变.到185周期,依然为全程硝化,短程硝化无法恢复.
在低DO条件下,AOB和NOB的增殖速率均下降,而AOB对于有限DO的竞争力强于NOB,补偿了由于低DO所造成的代谢活性下降,使得氨氧化阶段没有受到明显的影响,即使可以实现短程硝化,而长期低DO将导致短程破坏.此外,这种方式以牺牲AOB的生长量为代价,在有效抑制NOB的同时也在一定程度上削弱了对NH4+-N的高效转化,同时低DO也不利于好氧异养菌的生长,Regmi等[14]的试验证明高DO(大于1.5mg/L)条件下,AOB对DO的竞争力大于NOB,Ruiz等[15]以高NH4+-N废水为研究对象,控制DO为1.5mg/L,获得了较高的亚硝积累率和氨氧化速率,Park等[16]的研究表明,AOB的某些种属(如)很适合在高DO条件下生长,因此较高DO也可以实现稳定的短程硝化,鉴于这些研究结果,可寻求能够长期维持短程硝化的方法.

图3 低DO系统NH4+-N、NO2--N、NO3--N去除情况
2.1.2 高DO条件下短程硝化长期维持稳定 接种同一中试短程SBR内活性污泥,在高DO(2.5mg/L)条件下,采用实时控制的运行方式,短程硝化SBR运行效果如图4,出水NO2--N随着进水NH4+-N波动,出水NO3--N低于2mg/L,亚硝累积率稳定达到90%以上,长期运行180d,能够维持稳定的短程硝化.
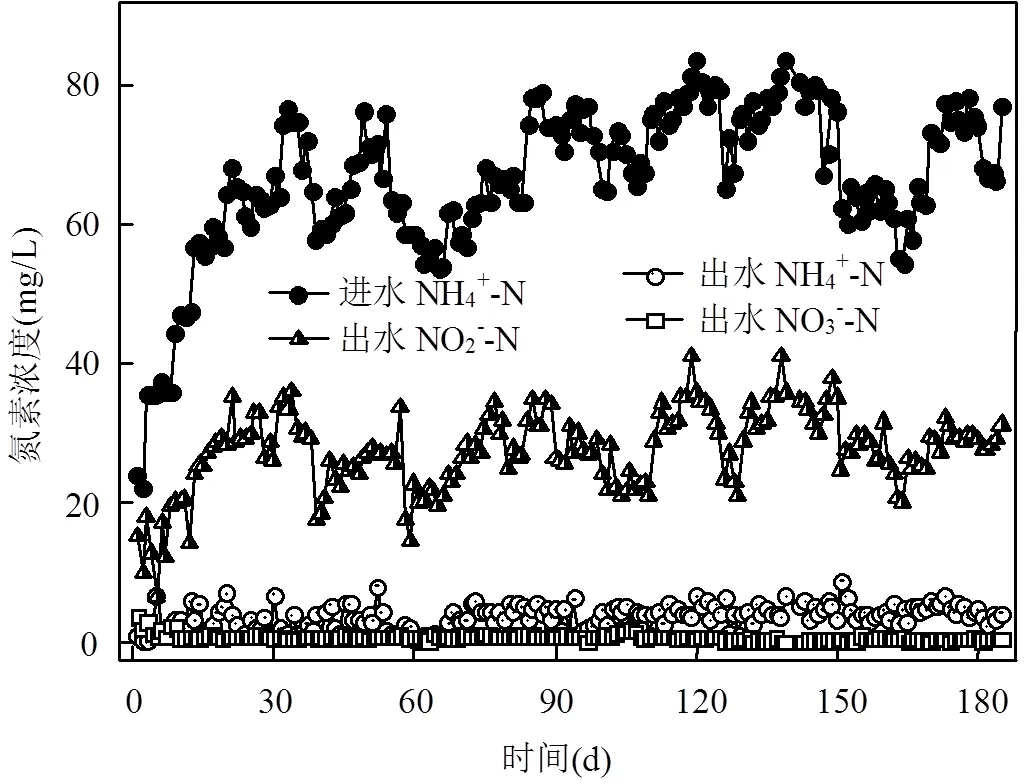
图4 高DO系统NH4+-N、NO2--N、NO3--N去除情况
2.2 不同供氧策略对维持短程硝化稳定的影响
大多数研究表明,AOB和NOB的种群结构对短程硝化具有重要影响,此外,通过Monod方程得出的氧半饱和常数代表了AOB和NOB对氧的亲和性,因此研究两种硝化污泥的功能菌及氧半饱和常数可进一步分析长期低DO短程破坏,而提高DO可以维持短程硝化长期稳定的原因.
2.2.1 低DO条件下硝化污泥功能菌群结构分析 低DO系统AOB和NOB在运行期间的菌群数量如图5,S1、S2、S3、S4分别代表接种污泥、第45、90、156个周期的污泥,随行运行周期的增加,NAR积累逐渐降低,短程硝化转变为全程硝化, AOB的数量在趋势上是逐渐增大的,由1.89× 104copies/g dry sludge增加到8.27×104copies/g dry sludge,说明AOB可能不是影响NAR积累的主要因素.同时,SBR系统长期在低DO条件下运行,但NOB数量并没有降低,说明NOB生长在低DO环境中并没有受到抑制.
NOB的菌群和丰度对短程硝化具有关键作用,因此,NOB菌群的2个主要种属(和)与短程硝化的稳定性密切相关,以前的研究认为是NOB的主要种属,而目前认为,在大多数污水处理系统中,是主要的种属,由于其具有更低的亚硝半饱和常数(s= 0.25mgN/L),为(s=0.39mgN/L),在低氨氮和亚硝浓度下,更可能去主导亚硝酸盐氧化[17-18],随着亚硝积累率的下降,迅速生长,导致短程系统逐步变为全程硝化系统,而则适应于基质浓度较高的环境,通过qPCR定量分析,由结果可知,从短程到全程硝化过程中,的数量基本没有变化,而的数量却大幅度增加,进一步说明是影响短程硝化转变成全程硝化的重要微生物.同时,长期低DO使得NOB种群数量发生变化.在短程硝化情况良好的种泥中,NB-NOB数量为1.51×107copies/g dry sludge,而NS-NOB数量为1.10×106copies/g dry sludge,NB-NOB的数量比NS-NOB的数量多1个数量级.在低DO环境运行后,NS-NOB的数量增长明显,达到全程硝化后,数量级远高于NB-NOB,成为NOB的主要菌群.Liu等[10]研究表明,当DO浓度小于0.5mg/L,且SRT为40d时,NS-NOB数量远大于NB-NOB数量,并且很快形成全程硝化,本研究结果与其类似.

图5 低DO系统不同周期的菌群数量变化
2.2.2 低DO条件下硝化污泥特性 (1)低DO条件下硝化污泥的比氨氧化速率:由图6可知,当DO浓度在0.2~2.0mg/L范围内,初始氨氮和亚硝浓度分别为25mg/L和10mg/L时,DO浓度水平越高,氨氧化速率和亚硝酸盐氧化速率越高,且在相同DO浓度下,亚硝酸盐氧化速率远大于氨氧化速率,这表明系统中NOB已成为优势菌群,使得短程硝化难以恢复,而一直保持全程硝化.
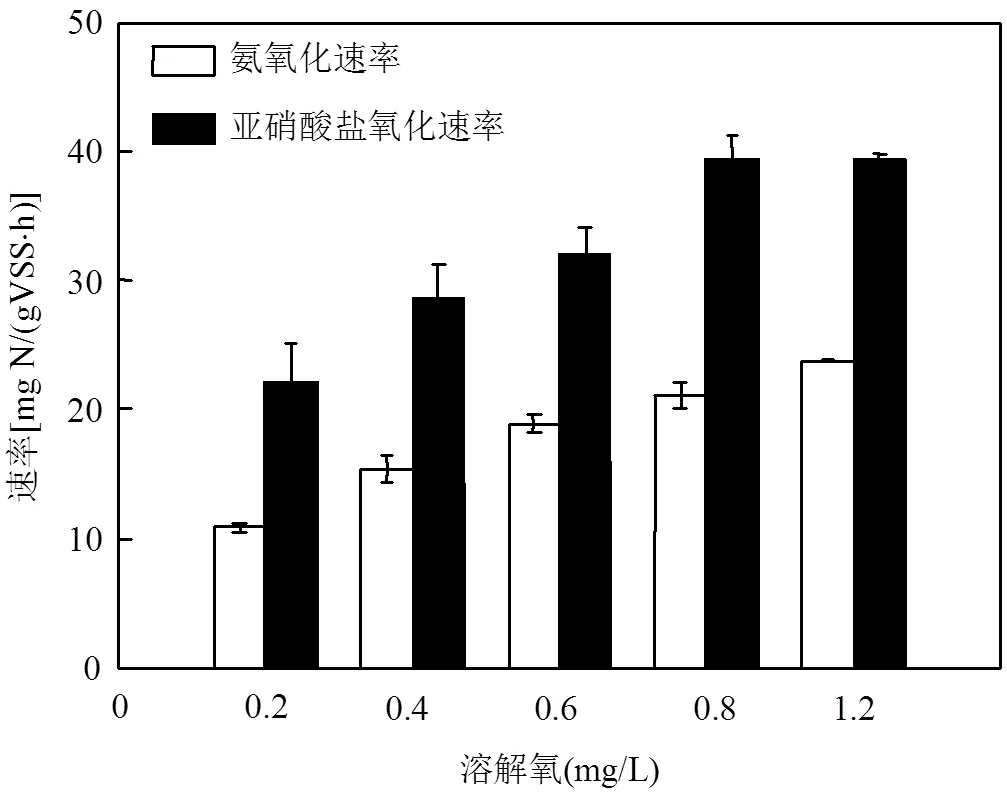
图6 低DO浓度水平下的氨氧化速率和亚硝酸盐氧化速率曲线

种属的亚硝酸盐氧化菌为-对策者生长,这种物种值较小,生长速率较低,但是对底物基质的亲和力较强.而种属的亚硝酸盐氧化菌正好相反,它是-对策者,这种物种具有较高的生长速率,但对底物基质的亲和力较弱[21].因此,在低DO条件下,种属比种属更能竞争溶解氧,其生长速率更高,故而会导致以为优势种群的NOB的氧半饱和常数小于AOB.另一方面,据报道缺乏对抗氧胁迫的保护机制,这也可能是因为其起源于缺氧或微氧环境中导致[22].本研究中,NOB的氧半饱和常数小于一般值(1.2~1.5)mg/L,为0.280mgO2/L,且与AOB的氧半饱和常数基本相同,这是NOB种群中为优势种群造成的,这与功能菌的结果一致.综合以上分析可知,低DO有利于SBR反应器中种属的生长,最终导致低DO条件短程硝化破坏.

图7 低DO系统AOB和NOB的Monod方程拟合结果
2.2.3 高DO条件下硝化污泥功能菌群结构 菌群数量如图8,S1、S2、S3、S4分别代表接种污泥、第78、106、146个周期的污泥,随着运行周期的增加,亚硝积累率始终维持在90%以上,形成稳定的短程硝化,AOB的数量随运行周期增加呈现增长趋势,由3.177×104copies/g干污泥增加到2.655× 105copies/g干污泥,这与低DO系统的结果相同.这表明溶解氧的高低不会对AOB产生抑制作用,随着运行周期的增加,高DO系统中的数量呈增加趋势,由8.511×105copies/g干污泥增加到5.657×106copies/g干污泥,Huang等[23]研究表明高DO(大于1.0mg/L)环境有利于的增长,本研究结果与其类似,然而的数量基本没有变化,且小于的数量,说明高DO可以抑制的生长,即使高DO系统中NOB的数量远高于AOB,但是依然可以形成稳定的短程硝化,进一步说明AOB在菌群中的数量不是影响稳定短程硝化的主要原因,因此,通过提高DO的控制策略,抑制种属的亚硝酸盐氧化菌的生长,便可以达到长期稳定短程硝化的目的.

图8 高DO系统运行期间的菌群数量及NAR变化
2.2.4 高DO条件下硝化污泥特性 (1)高DO条件下硝化污泥的比氨氧化速率:图9中,初始氨氮浓度为25mg/L时,DO浓度由0.2mg/L升高到0.6mg/L,氨氧化速率极大的增加,由31.7mgN/(gVSS·h)升高到45.5mgN/(gVSS·h)当DO浓度在(0.6~2.4) mg/L范围内,随着DO浓度升高,氨氧化速率升高,但变化较小,而在高DO条件下,可以维持较高的比氨氧化速率.与低DO全程硝化相比,相同DO下,短程硝化具有更高的比氨氧化速率,说明长期高DO运行的短程硝化污泥AOB具有更高的活性.该短程硝化污泥基本没有NOB的作用,NOB的活性受到抑制.

图9 高DO浓度水平下的氨氧化速率曲线
(2)高DO条件下硝化污泥的氧半饱和常数:图10为高DO系统内AOB的Monod方程,利用Origin拟合后得出AOB的Monod方程为
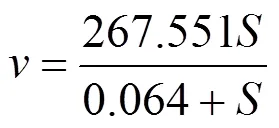
式中:vmax=267.55mgN/(L·d),KO2,AOB=(0.064±0.008) mgO2/L(95%的置信区间).由于是短程硝化污泥,故基本没有亚硝酸盐氧化作用.从结果可以看出,AOB的氧半饱和常数低于理论值(0.2~0.4)mg/L,这表明AOB对溶解氧具有很高的亲和力.以前的研究发现Nitrosomonas是AOB的主要菌种,Kim等[24]报道Nitrosomonas-like AOB对溶解氧有极高的亲和力,这也可能是造成氧半饱和常数较低的原因.Bao等[25]的研究发现,在高DO环境下,短程硝化AOB/NOB的丰度极大地增加,在高DO条件下,AOB更有能力竞争溶解氧,随着AOB菌群丰富的增加,这导致溶解氧优先用于氨氧化,NOB的活性受到抑制.本研究在高DO条件下,短程硝化污泥始终保持稳定,这与AOB对氧的高亲和力有极大关系.
3 结论
3.1 低DO条件下,SBR在短程硝化运行过程中,随着运行周期的增加,亚硝积累率从100%逐渐降至4.5%,说明在长期运行过程中低DO条件并不利于短程硝化实现长期稳定,这是由于AOB和NOB菌群结构发生变化造成的.通常认为,低DO条件更有利于实现短程硝化,但是长期低DO条件会导致短程硝化破坏,而通过提高溶解氧浓度,短程硝化可以长期维持稳定.
3.2 低DO系统内AOB和NOB的氧半饱和常数分别为0.281mgO2/L和0.280mgO2/L,两者非常接近,并且NOB的生长速率远大于AOB,故NOB作为优势菌发挥作用.高DO系统内AOB的氧半饱和常数为0.064mgO2/L,表明AOB对溶解氧有极高的亲和力.并且在高DO环境下,可以维持很高的氨氧化速率.
3.3 在低DO系统种泥中,数量大于,而随着亚硝积累率的下降,数量逐渐增大并超过数量,说明低DO条件下容易使Nitrospira的生长获得优势是影响短程硝化稳定的重要因素,而在长期高DO条件下,可以抑制的生长,即使高DO系统中NOB的数量远高于AOB,但是依然可以形成稳定的短程硝化.
[1] 张可方,凌忠勇,荣宏伟,等.SBBR中DO对亚硝酸型同步硝化反硝化的影响[J]. 广州大学学报(自然科学版), 2008,7(6):54-58.
[2] 张立秋,韦朝海,张可方,等.常温下SBBR反应器中亚硝酸型同步硝化反硝化的实现[J]. 环境工程, 2009,27(1):40-43.
[3] Park H D, Nogura D R. Evaluating the effect of dissolved oxygen on ammonia-oxidizing bacterial communities in activated sludge [J]. Water Research, 2004.38(14):3275–3286.
[4] 孙洪伟,尤永军,赵华南,等.游离氨对硝化菌活性的抑制及可逆性影响[J]. 中国环境科学, 2015,35(1):95-100.
[5] Siripong S, Rittmann B E. Diversity study of nitrifying bacteria in full-scale municipal wastewater treatment plants [J]. Water Research, 2007,41(5):1110−1120.
[6] Hanaki K, Wantawin C, Ohagki S. Nitrification at low-levels of dissolved oxygen with and without organic loading in a suspended- growth reactor [J]. Water Research, 1990,24(3):297–302.
[7] Blackburne R, Yuan Z. Partial nitrification to nitrite using low dissolved oxygen concentration as the main selection:factor [J]. Biodegradation, 2008,19,303–312.
[8] 张功良,李 冬,张肖静,等.低温低氨氮SBR短程硝化稳定性试验研究[J]. 中国环境科学, 2014,34(3):610-616.
[9] Zeng W, Li L, Yang Y, et.al. Nitritation and denitritation of domestic wastewater using a continuous anaerobic–anoxic–aerobic (A2O) process at ambient temperatures [J]. Bioresource Technology, 2010, 101(21):8074–8082.
[10] Liu G, Wang J. Long-term low DO enriches and shifts nitrifier community in activated sludge [J]. Environment. Science. Technology, 2013,47(10):5109–5117.
[11] Yang Q, Peng Y Z, Liu X H, et al. Nitrogen Removal via Nitrite form Municipal Wastewater at Low Temperatures using real-time Control to Optimize Nitrifying Communities [J]. Environment Science Technology, 2007,41(23):8159-8164.
[12] 复 盛,国家环境保护总局,水和废水监测分析方法编委会,水和废水监测分析方法[M]. 北京:中国环境科学出版社, 2002:38-47.
[13] Nittami T, Ootake H, Imai Y, et al. Partial nitrification in a continuous pre-denitrification submerged membrane [J]. Biochemical Engineering Journal, 2011,55(2):101-107.
[14] Regmi P. Control of aeration, aerobic SRT and COD input for mainstream nitritation/denitritation [J]. Water Research, 2014,57(2): 162–171.
[15] Ruiz G, Jeison D, Rubilar O. Nitrification–denitrification via nitrite accumulation for nitrogen removal from wastewaters [J]. Bioresource, 2016,8(2):113-119.
[16] Hee D P, Daniel R N. Evaluating the effect of dissolved oxygen on ammonia-oxidizing bacterial communities in activated sludge [J]. Water Research, 2004,38(5):3275–3286.
[17] Daverey A, Su S H, Huang Y T. Partial nitrification and anammox process: A method for high strength optoelectronic industrial wastewater treatmen [J]. Water Research, 2013,47(2):2929−2937.
[18] Blackburne R, Vadivelu V M, Yuan Z. Kinetic characterisation of an enriched Nitrospira culture with comparison to Nitrobacter [J]. Water Research, 2007,41(14):3033-3042.
[19] Downing L S, Nerenberg R. Effect of oxygen gradients on the activity and microbial community structure of a nitrifying membrane-aerated biofilm [J]. Biotechnology and Bioengineering, 2008,101(6):1193- 1204.
[20] 吴 军,张 悦,徐 婷,等.AOB溶解氧亲和力低于NOB条件下序批反应器中NOB淘汰的实现机制[J]. 中国环境科学, 2016,36(12): 3583-3590.
[21] Stenstrom M K. The effect of dissolved oxygen concentration on nitrification [J]. Water Research, 1990,14(6):643–649.
[22] Lucker S, Wagner M A. Nitrospirametagenome illuminates the physiology and evolution of globally important nitrite-oxidizing bacteria [J]. Water Research, 2010,107(30):13479–13484.
[23] Guo J, Peng Y Z, Wang S Y. Long-term effect of dissolved oxygen on partial nitrification performance and microbial community structure [J]. Water Research, 2009,100(2):2796-2802.
[24] Kim Y M, Cho H U. influence of operational parameters on nitrogen removal efficiency and microbial communities in a full-scale activated sludge process [J]. Water Research, 2011,17(1):5785−5795.
[25] Bao P, Peng Y Z. Achieving partial nitrification by inhibiting the activity of-like bacteria under high-DO conditions in an intermittent aeration reactor [J]. Journal Of Environment science, 2016,8(2):113-119.
Effect of dissolved oxygen on the stability and functional microbial communities of the partial nitrification.
YANG Qing, YANG Yu-bing, YANG Zhong-qi, HUANG Si-ting, ZHOU Xue-yang, LIU Xiu-hong*
(National Engineering Laboratory for Advanced Municipal Wastewater Treatment and Reuse Technology, Beijing University of Technology, Beijing 100124, China)., 2018,38(9):3328~3334
The stability of partial nitrification at different dissolved oxygen (DO) concentration was studied in SBR at room temperature. Under the low DO concentration of 0.5mg/L, the partial nitrification kept stable for 75cycles with the nitrite accumulation rate (NAR) higher than 80%. Until 105cycles, the NAR gradually decreased and the partial nitrification transformed to the complete nitrification. However, using the same sludge, the partial nitrification kept long-term stable of 180cycles under the DO concentration of 2.5mg/L. Furthermore, NAR was higher than 90%. These results indicated under high DO concentration, the stable operation of partial nitrification can be maintained for a long period of time. The oxygen half saturation constant of AOB and NOB, and qPCR tests indicated that low DO might be benefit to the growth ofthat resulted in the unstable of the partial nitrification. Moreover, under high DO concentration, AOB had higher affinity for oxygen. Therefore, high oxygen concentration could maintain long-term stability of partial nitrification.
dissolved oxygen;partial nitrification;ammonia-oxidizing bacteria;nitrite-oxidizing bacteria;half-saturation constants of oxygen
X703
A
1000-6923(2018)09-3328-07
杨 庆(1979-),男,黑龙江哈尔滨人,副教授,博士,主要从事污水生物处理研究.发表论文90余篇.
2018-01-23
国家自然科学基金资助项目(51508561);北京市自然科学基金资助项目(8182012)
* 责任作者, 副研究员, lxhfei@163.com
