维甲酸对异位内膜基质细胞Beclin-1的影响研究*
2018-09-22董少瑞李绍波路会侠
董少瑞,李绍波,路会侠△
(1.大理大学2013级临床医学专业,云南大理 671000;2.大理大学临床医学院,云南大理 671000)
子宫内膜异位症(EMs)是育龄妇女常见病,其发病机制至今不明,有研究发现自噬(Autophagy)[1]可能与EMs的发生、发展密切相关[2];而抑癌基因Beclin-1作为自噬过程重要的正向调控因子,参与自噬体形成[3-4]。维甲酸(RA)是天然维生素A的代谢产物,有研究显示RA可能与子宫内膜细胞的激素调节有关,但RA对EMs的具体机制尚不清楚。本研究拟通过检测不同剂量RA作用于正常子宫内膜基质细胞和异位内膜基质细胞(ESC)时Beclin-1表达的变化,探讨RA治疗EMs的作用机制。
1 材料与方法
1.1材料
1.1.1标本 选取20例EMs患者标本,年龄24~45岁,均已婚,月经规则,术前3个月未使用激素类药物,均于2016年1-12月在大理大学第一附属医院行手术,术中剥离卵巢异位囊肿壁待用,病检证实为EMs。另选同期20例因不孕症行诊刮术患者,年龄23~47岁,无激素治疗,术后取子宫内膜待用,病检证实为正常子宫内膜。本研究的所有患者均知情并签字同意,且由医院学术伦理委员会讨论批准。所有标本在离体30 min内保存于液氮内,需要时分别取出解冻后行正常子宫内膜基质细胞或ESC培养,进行细胞试验。
1.1.2主要试剂 Beclin-1多克隆抗体(美国Cell Signal公司),微管结合蛋白轻链 3(microtubule-associated protein light chain 3,LC3)-Ⅱ多克隆抗体(美国 Cell Signal 公司),氯喹(CQ,美国 Selleckchem 公司),兔抗人Beclin-1抗体(美国 Santa Ctuz 公司),山羊抗兔二抗(联科生物技术公司),Alexa Fluor 488标记山羊抗兔IgG(美国Jackson公司),DAPI(美国Sigma公司)。
1.2方法
1.2.1细胞培养 正常子宫内膜基质细胞或ESC均培养于37 ℃、5%CO2的细胞孵箱内,培养基为RPMI-1640(美国HyClone公司)+10% 新生牛血清(兰州民海公司),分为空白对照组(正常子宫内膜基质细胞)、CQ组(ESC)、CQ+RA组(ESC),于对数生长期进行实验。
1.2.2免疫荧光检测 LC3是自噬标志物,最初位于细胞质,自噬形成时,胞质型LC3(LC3-Ⅱ)转变为胞膜型LC3(LC3-Ⅱ)。LC3-Ⅱ在自噬体膜内外都有结合,检测LC3荧光斑点是观察细胞自噬最直观的方法。两种内膜基质细胞采用免疫荧光染色,观察细胞内LC3荧光斑点。分别取正常子宫内膜基质细胞及ESC,接种在6孔板中,每个细胞设置3复孔,待48 h细胞融合时开始实验。PBS洗涤3次,每孔加入固定液200 μL固定15 min。PBS洗涤3次,每孔加入细胞通透液200 μL(含0.1% Triton X-100的PBS),室温放置10 min。PBS洗涤3次,每孔加入封闭液200 μL,室温湿盒内放置2 h。去除封闭液,每孔加入50 μL稀释的一抗(Anti-LC3-Ⅱ抗体稀释度 1∶2 000)。4 ℃冰箱湿盒内放置过夜。去除一抗,PBST洗涤3次。每孔加入50 μL荧光标记的二抗,Alexa Fluor 488标记山羊抗兔IgG稀释度1∶400。37 ℃孵箱内孵育30 min(避光操作)。去除二抗,PBST洗涤3次。每孔加入100 μL DAPI(2 μg/mL),室温放置10 min。PBST充分洗涤3次。每孔加入200 μL PBS。倒置荧光显微镜观察(避光操作)。
1.2.3RT-PCR 正常子宫内膜基质细胞和 ESC分别接种于6孔板中,待生长至大于80%时,空白对照组不做任何处理,CQ组加入CQ,CQ+RA组加入CQ和RA,药物处理6 h后,用Trzol法(美国 Invitrogen 公司)进行总RNA提取(每100 g组织中),1 μg mRNA用AMV反转录酶(美国Promage公司)合成cDNA。反应条件为预变性95 ℃ 30 s,变性94 ℃ 45 s,退火55 ℃ 45 s,延伸72 ℃ 1 min,40个循环。GAPDH:上游引物5′-GGTCTCCTCTGACTTCAACA-3′,下游引物5′-AGCC AAATTCGTTGTCATAC-3′;LC3-Ⅱ:上游引物5′-GACGGCTTCCTGTACATGGTTT-3′,下游引物5′-TGGAGTCTTACACAGCCATTGC-3′;Beclin-1:上游引物5′-GCTCCATGCTTTGGCCAATAAC-3′,下游引物5′-ATGGTCAAACTTGTTGTCCCAG-3′。
1.2.4Western blot 正常子宫内膜基质细胞和 ESC分别用不同浓度RA(5、10、20、40、60、80、100 μmol/L)和(或)CQ处理。取30 g细胞总蛋白经10%凝胶进行电泳分离,转入PVDF膜,0.1% Tween 20(TBST;50 mmol/L Tris Cl,pH 7.5,150 mmol/L NaCl)和3% BSA封闭3 h,按稀释浓度Beclin-1 1∶500加入一抗,4 ℃孵育过夜,按稀释浓度1∶1 000加入HRP标记的二抗,室温孵育1 h,TBST洗涤3次,加入发光剂进行成像分析,观察各实验分组Beclin-1光密度差异。
1.2.5转染Beclin-1 siRNA 实验分为对照组、阴性对照组、转染组及RA处理组,每组设3 复孔。转染在24 孔板中进行,转染前1 d 接种细胞,使得转染时细胞融合达30%。转染前1 h 将孔中培养基更换为无血清的RPMI-1640。24 孔板转染分别用50 μL RPMI-1640稀释20 pmol siRNA和1 μL Lipo 2000 Reagent,将100 μL复合物滴入细胞中,4 h 后换液,待细胞生长约80%融合时,荧光显微镜下观察荧光及转染情况。
1.2.6MTT 96孔板中分别培养ESC,待细胞生长为70%~90%时,加入RA(浓度分别为1、2、4、6、8 μmol/L),同时设置调零孔(培养液、 MTT、 DMSO),对照孔(培养液、MTT、DMSO),每个样品和对照均设3个平行样,孵育24 h后,弃上清液,每孔加入90 μL含1%胎牛血清的RPMI-1640和10 μL的5 mg/mL MTT溶液,培养4 h弃上清液,每孔再加入110 μL的DMSO,置于37 ℃ 10 min至紫色结晶完全溶解后,利用酶标仪在490 nm测其吸光度值(A值),计算出细胞存活率。
2 结 果
2.1正常子宫内膜基质细胞及ESC中LC3-Ⅱ的表达 正常子宫内膜基质细胞内仅个别细胞有少量的LC3荧光斑点,细胞维持低水平自噬。ESC中出现了明显的LC3荧光斑点(自噬囊泡),见图1。
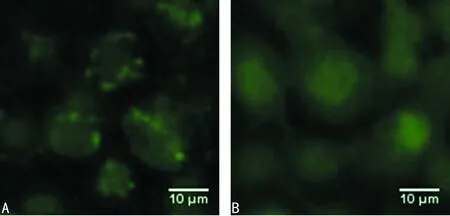
A:正常子宫内膜基质细胞;B:ESC
2.2RA对LC3-Ⅱ、Beclin-1 mRNA表达的影响 CQ组LC3-Ⅱ、Beclin-1 mRNA表达较空白对照组减少,而CQ+RA组较CQ组增加,差异有统计学意义(P<0.05)。CQ+RA组与空白对照组比较,Beclin-1 mRNA表达差异有统计学意义(P<0.05),LC3-ⅡmRNA表达差异无统计学意义(P>0.05),见图2。

图2 RA对ESC中LC3-Ⅱ、Beclin-1 mRNA表达的影响
2.3不同浓度RA对ESC Beclin-1蛋白表达的影响 随着RA浓度的增加,ESC Beclin-1蛋白表达逐渐升高,差异有统计学意义(P<0.05),见图3。

图3 不同浓度RA作用下ESC Beclin-1蛋白表达变化

A:PCR;B:Western blot
2.4RA对siRNA Beclin-1的影响 siRNA Beclin-1在确定的转染条件下可有效沉默ESC中Beclin-1 基因的表达,而RA可解除siRNA对Beclin-1的沉默作用,见图4。
2.5RA细胞毒性 通过CQ或siRNA Beclin-1抑制自噬,不同浓度RA对细胞的存活率与对照组比较,差异无统计学意义(P>0.05),见图5。
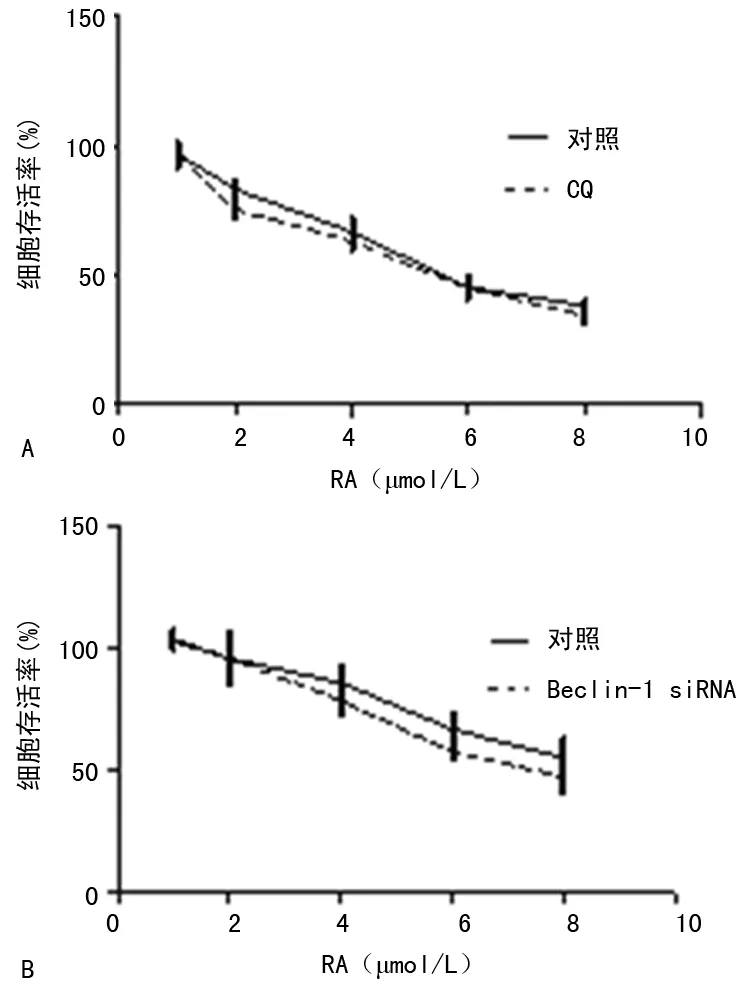
A:CQ抑制;B:siRNA抑制
3 讨 论
自噬是细胞的胞质降解并循环利用产生能量的过程。作为细胞“自我消化”的过程广泛贯穿于真核细胞的诸多生命活动,并在多种疾病的病理过程中扮演重要的角色,尤其在肿瘤的发生、发展过程中起到了极为重要的作用。已有研究发现,与自噬相关的核心调控通路 PI3K/Akt/mTOR在包括乳腺癌、子宫内膜癌等多种恶性肿瘤的研究中备受关注[5]。PI3K/Akt 通路激活 mTOR 表达调节细胞增殖,通过调节 缺氧诱导因子1-α(HIF-1)表达诱导 VEGF及胚胎干细胞产生,诱发血管形成和血管通透性增加[6-7]。新陈代谢、炎性反应、神经退行性病变等都会对细胞形成应激刺激,mTOR通路被抑制,使自噬能顺利被诱导。自噬信号的激活可抑制肿瘤血管生成[6]。但自噬在EMs中的作用机制尚不十分清楚。Beclin-1 作为一种单倍体不足的肿瘤抑制基因,Beclin-1/PI3K-Ⅲ复合物参与了自噬体的形成及自噬的启动[8],Beclin-1的表达亦被用于检测自噬的活性。Beclin-1下调或缺失可促使肿瘤细胞的恶性生物学效应,而上调其表达将成为某些特定肿瘤的有效治疗手段[9]。Beclin-1在卵巢癌中的过表达可有效抑制 SKOV3/DDP 细胞的体外增殖能力及侵袭转移能力[10]。不同临床分期的EMs中Beclin-1表达不同,分期越高其表达越低[11-12]。REN等[13]报道Beclin-1在异位内膜中的表达远低于在位内膜;HAMACHER-BRADY等[14]也发现EMs患者Beclin-1 mRNA 及蛋白表达低于健康女性。笔者在实验中亦发现EMs患者Beclin-1 mRNA表达较健康人群减少,与文献报道一致。
RA有着广泛的生物学作用,如参与调节炎症细胞、免疫细胞的激活,促进发育组织上皮细胞的增殖、分化等[15]。RA在人体细胞内的转化受到严格的代谢通路调控,应用于治疗某些细胞增殖性疾病(如白血病)和高VEGF表达的恶性肿瘤疾病。TEE等[16]发现RA对VEGF含量丰富的人早幼粒细胞(HL-60)内膜细胞效果明显,主要通过Tie2信号途径抑制血管内皮细胞及血管平滑肌细胞的生长。廖伟超等[17]报道依维莫司联合RA能诱导NB4-R1细胞分化,且能阻滞细胞周期而不致细胞凋亡,其机制可能与依维莫司联合RA抑制mTOR信号通路激活自噬作用有关。宋兆侠等[18]发现RA 可降低异位内膜组织中 VEGF mRNA和蛋白表达从而减少病灶内血管分布,减小内异症病灶体积。本研究发现,RA与ESC一起孵育,可以刺激细胞中Beclin-1的表达,随着RA浓度增加,Beclin-1的表达亦相应升高。利用自噬抑制剂CQ或转染siRNA Beclin-1抑制EMs细胞的自噬后,发现RA可对抗自噬抑制剂CQ或基因沉默对Beclin-1的抑制作用。这些结果说明RA可以诱导自噬的发生,通过刺激ESC中Beclin-1的表达,而达到控制EMs病情进展的可能。
虽然近年国外已有研究表明PI3K/Akt/mTOR通路与EMs关系密切,但自噬在EMs异位灶形成过程中的作用是否与该通路有关,目前国内少见报道。RA可能通过激活自噬、抑制异位病灶中血管的生长而达到治疗,其中机制有待进一步探索,有可能成为EMs的一种新的治疗手段。
