Lnc-ATB通过吸附miR-433促进宫颈癌侵袭及转移
2018-09-21李柏森文敏易红梅姜鹤群
李柏森 文敏 易红梅 姜鹤群
1电子科技大学医学院附属肿瘤医院,四川省癌症防治中心,四川省肿瘤医院放疗中心(成都 610041);成都医学院第一附属医院 2胸心外科,3肿瘤科(成都 610500)
宫颈癌为女性发病率第二高的恶性肿瘤,其病原体主要为高风险性的人乳头瘤病毒(high-risk human papillomavirus,HPV)[1-2]。随着早期筛查的普及和治疗手段的丰富,宫颈癌患者的诊断和预后均得到了显著的提升。然而,宫颈癌发病机制仍不完全清楚,明确其发病机制,鉴定新的潜在治疗靶点具有重要意义。转化生长因子β(transforming growth factorβ)活化长链非编码RNA(long noncoding RNA)LncRNA-ATB(Lnc-ATB)是首个被发现可被转化生长因子活化的长链非编码RNA[3],研究发现Lnc-ATB在肾癌[4]、乳腺癌[5]和结肠癌[6]等肿瘤中异常高表达,并可通过吸附miR-200家族成员而促进肿瘤的侵袭和转移。然而,尚缺少关注Lnc-ATB在宫颈癌中细胞中的表达和作用的相关机制研究。本课题拟检测Lnc-ATB在宫颈癌细胞系中的表达,并明确Lnc-ATB在宫颈癌侵袭和转移中的作用及潜在机制。本研究结果首次证实了Lnc-ATB在宫颈癌细胞中高表达,并通过吸附结合miR-433促进宫颈癌细胞侵袭转移,为宫颈癌提供了新的分子靶点。
1 材料与方法
1.1 材料Trizol购买于美国Sigma公司;RNA反转录及QPCR试剂盒购买于日本TAKARA公司;Transwell小室购买于美国Millipore公司;细胞侵袭铺板用基质胶购买于美国BD公司;萤光素酶报告基因检测试剂盒购买于上海碧云天生物技术有限公司。
1.2 方法
1.2.1 RNA提取及反转录细胞培养过夜至汇合度80%,加入Trizol裂解。离心5 min,上清加入裂解液1/5体积的氯仿,用力振荡至充分乳化。离心15 min,加入等体积异丙醇,上下颠倒15次,静置10 min。离心15 min。弃去上清,加入75%的乙醇1 mL,离心5 min。所得沉淀加入20μL去离子水,即为所需RNA。
1.2.2 反转录采用10μL体系,RNA定量后,取1μL RNA,加入5x PrimeScript RT master 2μL,7 μL去离子水。轻柔混匀后,进行反转录反应。反应条件为:37℃ 15 min,85℃ 5 s,4℃储存。
1.2.3 实时定量PCR反应配置PCR反应液,PCR反应采用25μL体系,组分如下:SYBR premix Ex TaqⅡ 12.5μL,正义链引物1μL,反义链引物1μL,实时定量产物2μL,去离子水8.5μL。PCR反应条件为:预变性95℃ 30 s;扩增95℃ 15 s,60℃30 s,共30个循环。反应结束后样品保存于4℃。
1.2.4 Transwell细胞侵袭实验采用的小室为预先铺好基质胶的Transwell小室,其余步骤同细胞转移实验。细胞转移能力检测试验步骤如下,将无菌Tranwell小室置于24孔板中,24孔板加入700μL的含15%胎牛血清的1640培养基,Transwell小室中加入200μL总数为1×105个细胞的细胞悬液,将24孔板置于细胞孵箱中培养36 h。而后,弃去Transwell小室中的液体,取出小室,湿棉签轻拭去未穿过膜的细胞。甲醇固定10 s,结晶紫染色30 s,PBS洗涤,完整切除小室膜,封片。显微镜200倍视野下统计随机十个视野的细胞术,拍照,绘制统计图。
1.2.5 细胞划痕接种宫颈癌细胞接种室6孔板中,孵育至宫颈癌细胞融合率达到100%后,用1 mL枪头均匀地在6孔板细胞接种孔中间部位划痕,划痕后用PBS清洗细胞3次,而后加入不含血清的培养基。倒置显微镜拍照,将细胞间间隙定义为0 h。于细胞培养箱中培养24 h后,再次拍照,此时细胞间间隙定义为24 h。两次拍照间单侧的间隙距离之差,即为细胞的迁移距离。
1.2.6 荧光素酶报告基因实验细胞培养过夜至汇合度达70%后,共转染miR-433 mimics/miR-433 NC和pmiR-GLO-WT/Mut Lnc-ATB质粒。裂解细胞后,取10μL样品加入100μL荧光素酶检测试剂,上机测定荧光值。
1.3 统计学方法数据分析均采用SPSS 22.0统计软件,计量资料以均数±标准差表示,3组数据间的比较依次采用方差分析和两两比较的t检验;两组数据间的比较直接应用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 Lnc-ATB在宫颈癌细胞及正常宫颈内皮细胞中的表达差异QPCR结果显示:Lnc-ATB在正常宫颈内皮细胞(normal cervical endothelial cells,NCEC)中的相对表达量为1.000±0.050,Lnc-ATB在宫颈癌HeLa细胞中的相对表达量为4.132±0.147,在宫颈癌SiHa细胞中的相对表达量为3.717±0.064。方差分析结果显示,3组间差异有统计学意义(F=21.436,P<0.05)。进一步应用t检验分析Lnc-ATB在HeLa与NCEC,及SiHa与NCEC之间的表达水平差异,结果显示,LncATB在HeLa与NCEC及SiHa与NCEC之间的表达水平差异有统计学意义(图1A:HeLavs.NCEC:t=5.921,P=0.027;SiHavs.NCEC:t=4.817,P=0.033),HeLa及SiHa细胞中Lnc-ATB的表达水平显著高于NCEC细胞。
为了研究Lnc-ATB对宫颈癌细胞侵袭及转移的影响,本研究合成了特异性沉默Lnc-ATB表达的慢病毒shRNA,QRT-PCR结果显示:感染Lnc-ATB NC的宫颈癌HeLa细胞中LncRNA-ATB的相对表达量为1.000±0.050,感染Lnc-ATB shRNA慢病毒的宫颈癌HeLa细胞中LncRNA-ATB的相对表达量为0.315±0.017,t检验结果显示两组间Lnc-ATB表达差异有统计学意义(图1B:t=4.889,P=0.031)。感染Lnc-ATB NC的宫颈癌SiHa细胞中LncRNA-ATB的相对表达量为1.000±0.050,感染Lnc-ATB shRNA慢病毒的SiHa细胞中LncRNAATB的相对表达量为0.373±0.023,t检验结果显示两组间Lnc-ATB表达差异有统计学意义(图1B:t=4.172,P=0.037)。Lnc-ATBshRNA可特异性地沉默HeLa及SiHa细胞中Lnc-ATB的表达。
2.2 Lnc-ATB促进宫颈癌细胞转移能力Tranwell实验结果显示,感染Lnc-ATBNC的宫颈癌HeLa细胞及SiHa细胞的相对转移细胞比为1.000±0.050,感染Lnc-ATB shRNA慢病毒的宫颈癌HeLa细胞及SiHa细胞的相对转移细胞比分别为0.327±0.013和0.414±0.015。t检验结果显示两组间转移细胞比率差异有统计学意义(图2)。沉默Lnc-ATB可抑制宫颈癌细胞转移能力。
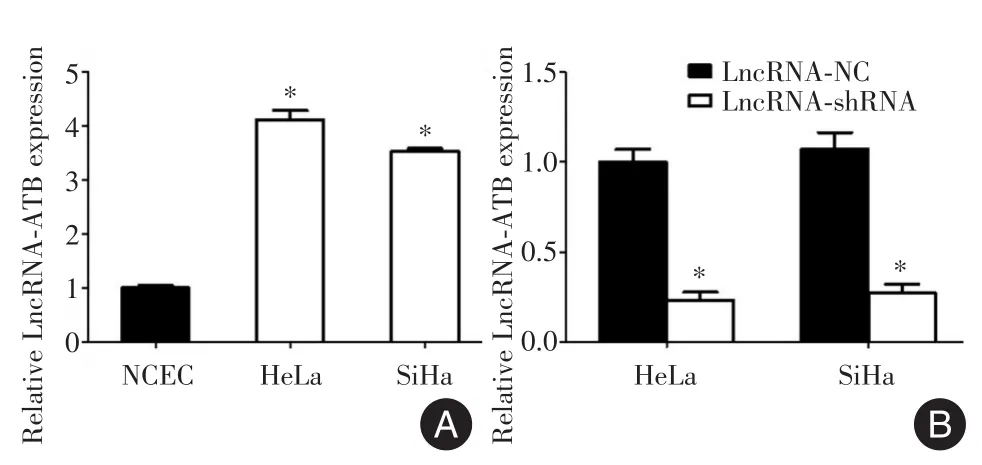
图1 LncRNA-ATB在正常宫颈内皮细胞及宫颈癌细胞系中的表达水平Fig.1 Expression of LncRNA-ATBin NCECand cervical cancer
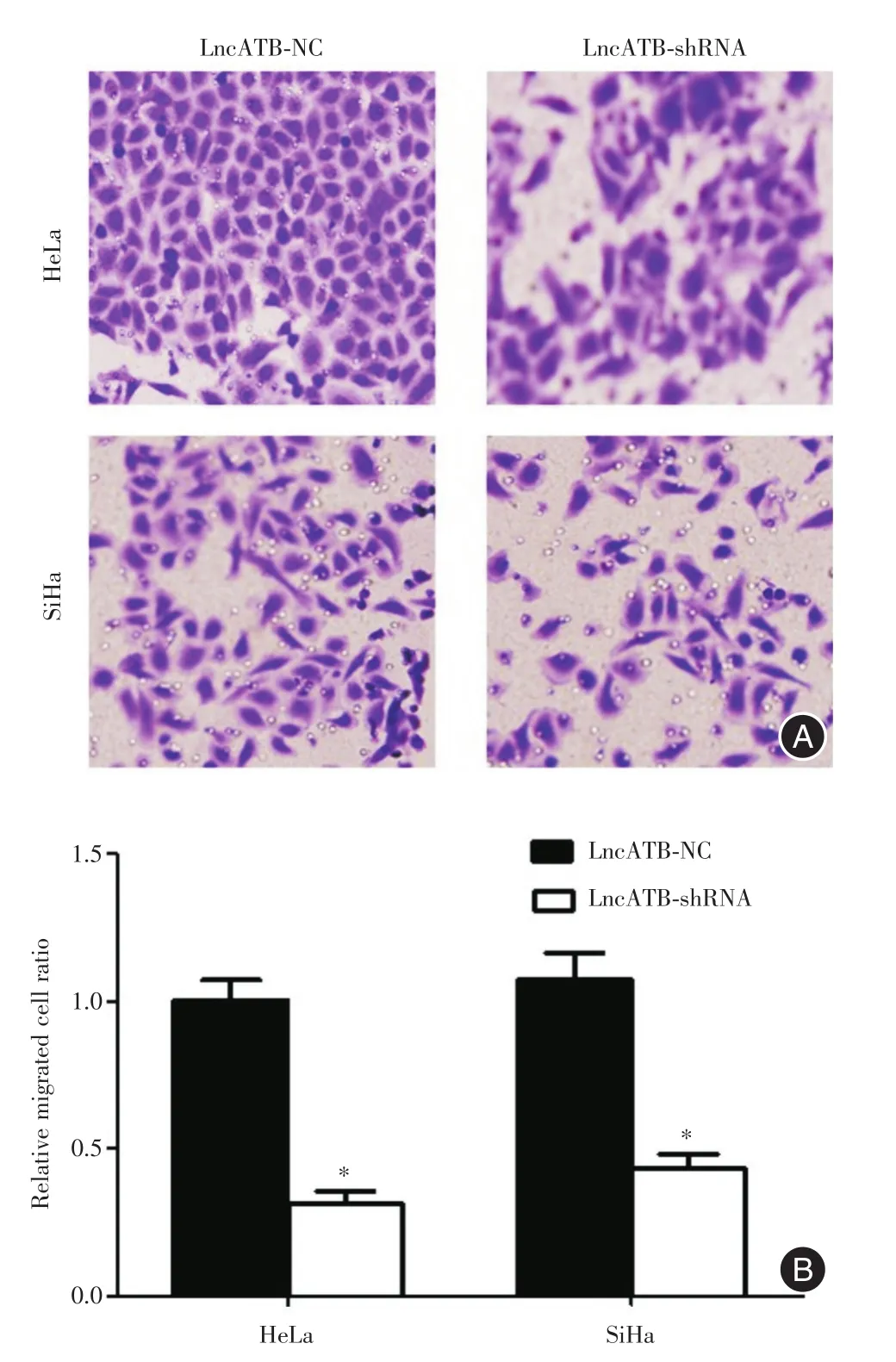
图2 Lnc-ATB促进宫颈癌细胞转移(×200)Fig.2 Lnc-ATBpromote cell migration of cervical cancer(×200)
2.3 Lnc-ATB促进宫颈癌细胞迁移能力细胞划痕实验结果显示,转染Lnc-ATBNC的HeLa细胞及SiHa细胞的相对迁移距离为1.000±0.050,转染Lnc-ATB shRNA的HeLa细胞及SiHa细胞的相对迁移距离为0.518±0.062和0.477±0.059。t检验结果显示两组间细胞迁移距离差异有统计学意义(图3:HeLa:t=3.451,P=0.041;SiHa:t=3.551,P=0.037)。沉默Lnc-ATB表达的宫颈癌细胞迁移距离短于Lnc-ATB NC组。
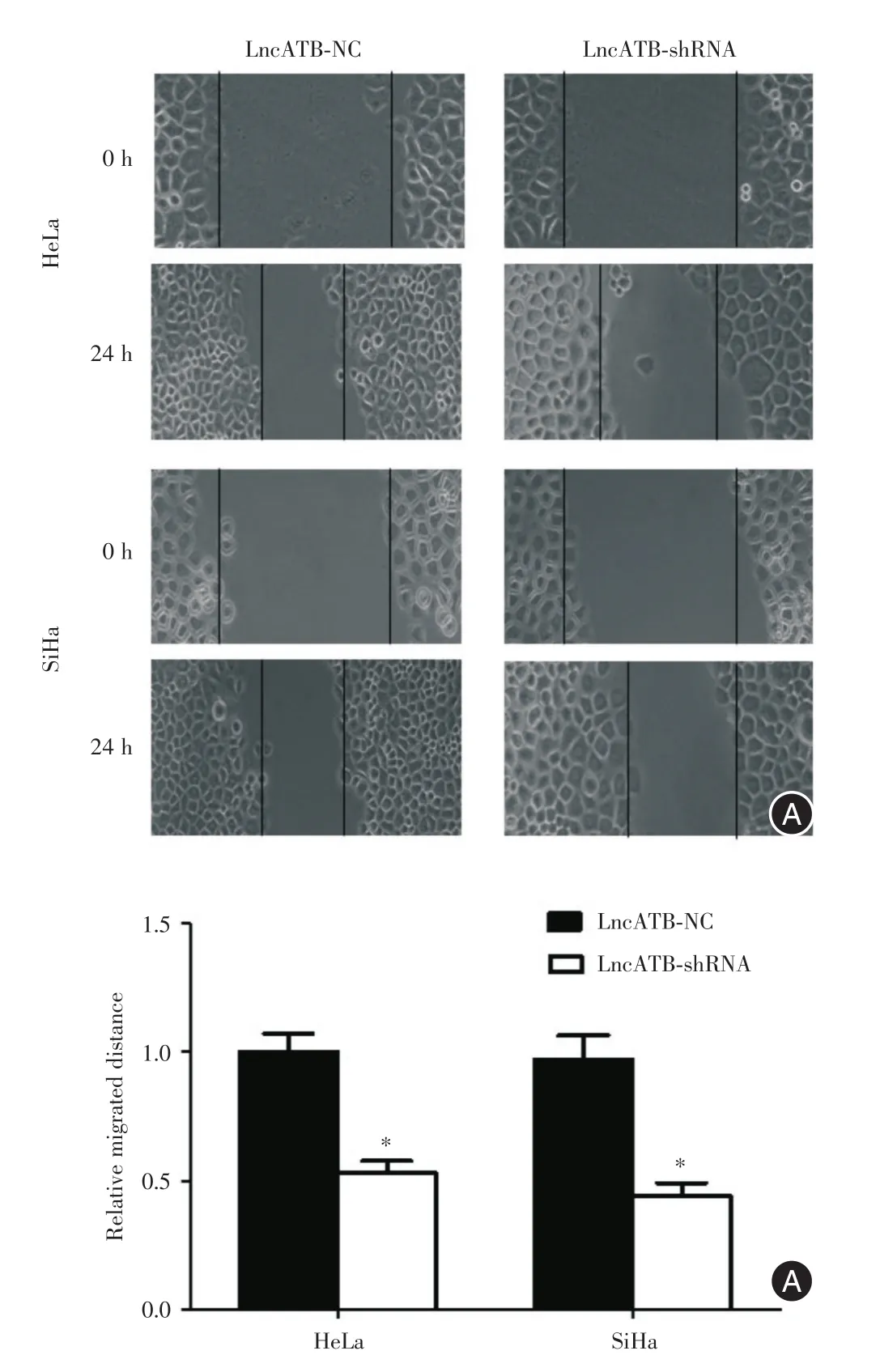
图3 Lnc-ATB促进宫颈癌细胞转移距离(×100)Fig.3 Lnc-ATBpromote migrated distance of cervical cancer(×100)
2.4 Lnc-ATB促进宫颈癌细胞侵袭能力Transwell实验结果显示:转染Lnc-ATB NC的HeLa细胞及SiHa细胞的相对侵袭细胞比率为1.000±0.050,转染Lnc-ATB shRNA的HeLa细胞及SiHa细胞的相对侵袭细胞比率为0.416±0.033和0.515±0.032。t检验结果显示两组间转移细胞比率差异有统计学意义(图4:HeLa:t=3.225,P=0.039;SiHa:t=2.882,P=0.042)。沉默Lnc-ATB可抑制宫颈癌细胞侵袭能力。

图4 Lnc-ATB促进宫颈癌细胞侵袭(×200)Fig.4 Lnc-ATB promote cell invasion of cervical cancer(× 200)
2.5 Lnc-ATB在HEK-293T细胞中可吸附miR-433如图5A,生物信息学预测结果显示Lnc-ATB存在miR-433结合位点,荧光素酶报告基因结果显示,转染miR-433 NC和pmirGLO-ATB WT组相对荧光强度为1.000±0.050,转染miR-433 mimics和pmirGLO-ATBWT组相对荧光强度为0.312±0.041,经t检验,两组差异有统计学意义(图5B,t=4.184,P=0.022),miR-433可特异性地与Lnc-ATB结合并降低其荧光强敌。
2.6 Lnc-ATB在宫颈癌细胞中下调miR-433的表达QPCR结果显示转染miR-433 NC的HeLa及SiHa细胞中Lnc-ATB的相对表达水平为1.000±0.050,转染miR-433 mimics的HeLa细胞及SiHa细胞中Lnc-ATB的相对表达水平分别为0.953±0.048和0.097 4±0.061,t检验结果显示,两组间Lnc-ATB表达差异无统计学意义(图6A:HeLa:t=0.515,P=0.368;SiHa:t=0.412,P=0.419)。转染Lnc-ATB NC组HeLa细胞及SiHa细胞中miR-433的相对表达水平为1.000±0.050,转染Lnc-ATB shRNA组的HeLa细胞及SiHa细胞中miR-433的相对表达水平为3.318±0.105和2.938±0.074。t检验结果显示,两组间miR-433差异有统计学意义(图6B:HeLa:t=4.981,P=0.018;SiHa:t=3.217,P=0.021)。沉默宫颈癌细胞中Lnc-ATB的表达可使miR-433表达水平上调。
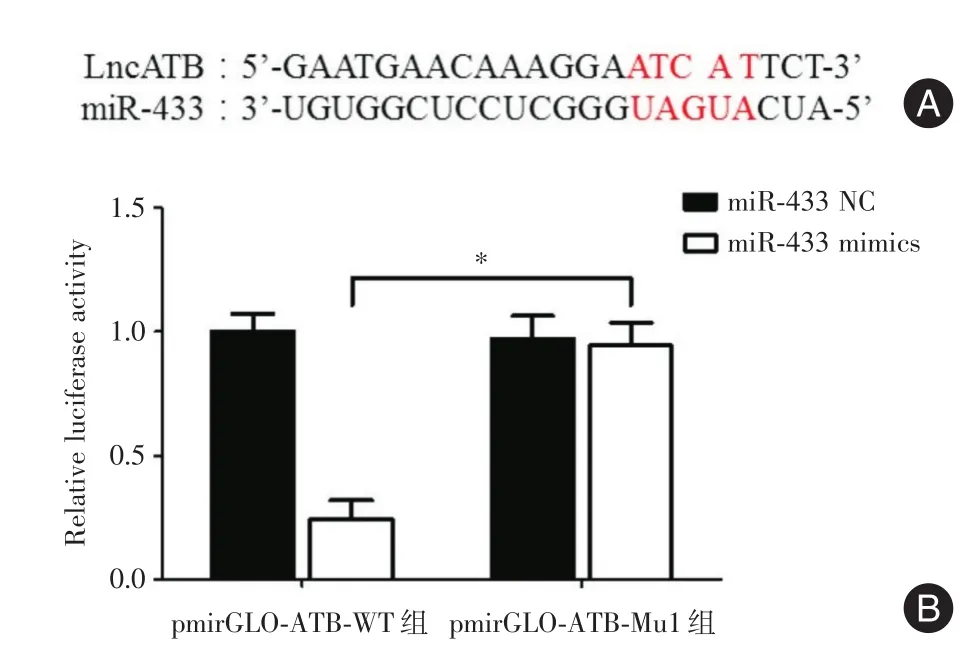
图5 Lnc-ATB在宫颈癌中吸附结合miR-433Fig.5 Lnc-ATBsponge and bind with miR-433 in cervical cancer
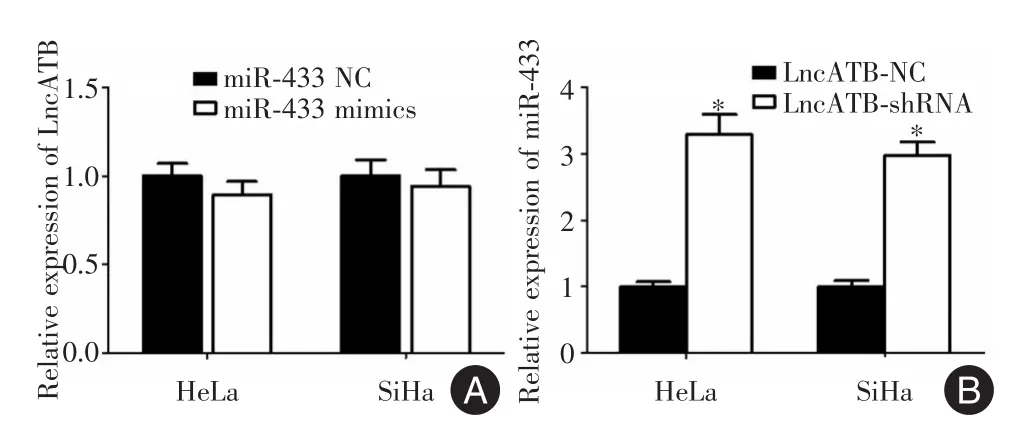
图6 Lnc-ATB在宫颈癌细胞中下调miR-433的表达Fig.6 Lnc-ATBdown-regulated miR-433 expression in cervical cancer
3 讨论
既往研究显示,多种肿瘤和疾病中均存在Lnc-ATB的异常表达,在肝细胞癌[7]、甲状腺乳头状癌[8]、肾细胞癌[4]、骨肉瘤[9]等多种肿瘤中Lnc-ATB表达异常上调,是潜在的致癌分子。在宫颈癌细胞和组织中,研究显示Lnc-ATB表达亦异常上调,并与肿瘤体积、淋巴结转移情况和FIGO分期密切相关。更为重要的是,Lnc-ATB与宫颈癌患者术后不良预后密切相关,可作为判断宫颈癌患者预后的独立预测指标[10]。与既往研究结果相符,本研究结果显示Lnc-ATB在宫颈癌HeLa细胞和SiHa细胞中的表达水平高于正常宫颈内皮细胞,进一步提示Lnc-ATB在宫颈癌发生及进展中发挥着致癌分子的作用。
Lnc-ATB是可特异性被TGF-β通路活化的长链非编码RNA。其可通过吸附miR-200家族成员而间接上调ZEB1、ZEB2等miR-200家族的靶分子,并可抑制上皮间质转化过程中的重要分子E-cadherin的表达,从而促进肿瘤的侵袭和转移能力[2,10]。本研究结果显示,沉默宫颈癌细胞中Lnc-ATB的表达后,宫颈癌细胞侵袭和迁移细胞数目减少,细胞迁移距离缩短,提示沉默Lnc-ATB的表达,可抑制宫颈癌的侵袭能力。
本研究利用生物信息学手段寻找与Lnc-ATB存在潜在结合位点的miRNA。结果显示miR-433存在Lnc-ATB结合位点,并可与其结合。进一步研究表明Lnc-ATB可在宫颈癌细胞中特异性地下调miR-433的表达。MiR-433是经典的肿瘤抑制性miRNA,在口腔鳞状上皮癌中,miR-433可通过靶向抑制FAK的表达而抑制其细胞增殖[12]。在宫颈癌中,miR-433表达异常下调,并与宫颈癌瘤体大小、FIGO分期、淋巴结转移情况和远处转移情况呈负相关,其潜在机制为miR-433通过直接抑制异粘蛋白的表达而调控AKT和β-catenin信号通路,从而抑制宫颈癌细胞的发生及进展[13]。结合既往研究结果和本研结果,提示Lnc-ATB在宫颈癌细胞中发挥竞争性内源性RNA作用,吸附并降低miR-433的表达,使其抑癌作用受到抑制,从而促进宫颈癌的侵袭和转移,需进一步的机制研究明确Lnc-ATB与miR-433之间的调控关系。
综上所述,本研究通过QCR技术检测了宫颈癌和正常宫颈细胞中Lnc-ATB的表达差异,发现Lnc-ATB在宫颈癌细胞中的表达显著高于正常宫颈细胞。沉默宫颈癌细胞中Lnc-ATB的表达后,宫颈癌细胞的侵袭和转移能力降低。机制研究结果显示,Lnc-ATB在宫颈癌细胞中可吸附并下调miR-433的表达。本研究结果进一步明确了宫颈癌侵袭和转移的分子机制,提供了潜在的宫颈癌靶向治疗靶点。
