应用环介导等温扩增技术检测江苏水稻种子携带的水稻恶苗病菌
2018-09-21袁咏天戎振洋叶文武张红生庄义庆郑小波
袁咏天 戎振洋 叶文武 张红生 庄义庆 郑小波,*
应用环介导等温扩增技术检测江苏水稻种子携带的水稻恶苗病菌
袁咏天1戎振洋1叶文武1张红生2庄义庆3郑小波1,*
(1南京农业大学 植物保护学院,南京 210095;2南京农业大学 农学院,南京 210095;3镇江市农业科学院,江苏 镇江 212400;*通讯联系人,E-mail: xbzheng@njau.edu.cn)
【目的】本研究旨在了解江苏省水稻主栽品种种子携带水稻恶苗病原菌的情况。【方法】采用环介导等温扩增技术(loop-mediated isothermal amplification,LAMP)对江苏65个水稻主栽品种种子携带藤仓镰孢、层出镰孢、拟轮枝镰孢和等4种水稻恶苗病菌进行检测。【结果】65个品种中有54个品种的种子样本携带恶苗病菌,表明江苏省稻种携带水稻恶苗病菌是一种普遍现象。其中,藤仓镰孢为优势种,检出率高达83.07%,其次是层出镰孢和,检出率分别为12.30%、6.15%,但供试的65个品种种子均未检测到携带有拟轮枝镰孢。【结论】该技术可用于水稻种子携带恶苗病菌的快速检测。
水稻恶苗病;种子带菌检测;环介导等温扩增技术;
恶苗病是水稻上重要的种传病害之一,是江苏省稻区的常见病害[1]。近年来,随着旱育秧技术和粳稻品种的推广以及恶苗病菌对浸种药剂产生抗药性,恶苗病在江苏省的发病率逐渐上升,严重影响水稻产量[2]。目前研究表明,水稻恶苗病是由藤仓镰孢菌()、拟轮枝镰孢菌()、层出镰孢菌()和导致的[3]。其中,藤仓镰孢致病力最强,分布最广,是引起水稻恶苗病的主要致病菌[4]。
种子的健康状况与水稻生产密切相关,其质量是影响水稻产量的重要因素之一[5]。有研究表明,稻种携带的恶苗病菌是该病的主要初侵染源,带菌种子调运是该病远距离传播和扩散的重要途径[6, 7]。在种子的形成、收获和储藏过程中,病原菌常以菌丝或孢子的形式寄藏于种子表面或内部,使种子变色甚至腐烂,严重影响种子质量和萌芽率[8-9]。因此,做好种子的带菌检测是保证种子质量的重要手段,有助于预防种传病害的发生与传播,对水稻生产具有积极意义。
关于水稻种子带菌检测方面已有许多研究,应用的检测技术包括传统检测法和现代的分子生物学技术。其中比较常用的有分离培养法、洗涤检验法、吸水纸保湿检验法、琼脂平皿检验法以及基于PCR的分子检测方法等[10-14]。这些检测方法虽能反映种子的带菌情况,但都存在一定缺陷,如检测所需时间长,或检测结果准确度偏低,或需要昂贵而精密的仪器。由于种子上携带的病原菌种类多而杂,依赖传统组织分离和形态学鉴定方法,很难达到快速准确的检验目的[15]。尤其是恶苗病菌中的藤仓镰孢和层出镰孢,它们不仅在形态学上极为相似,基因序列上也很接近,鉴定难度很大[3, 16]。因此,有必要探索针对水稻种子携带恶苗病菌的快速检测与鉴别的新技术。
环介导等温扩增技术(loop-mediated isothermal amplification, LAMP)[17],与传统的检测方法相比,具有检测特异性强、灵敏度高、所需时间短和检测结果可直接用肉眼判别等优点[18]。我们应用本实验室前期研发的可以分别特异性检测4种水稻恶苗病菌的4项LAMP检测技术,以江苏省65个水稻品种种子为样本开展种子携带恶苗病菌的检测,旨在了解江苏省水稻品种携带水稻恶苗病原菌的现状,同时为水稻种子携带恶苗病菌的快速检测与鉴别提供新技术。
1 材料与方法
1.1 供试水稻品种的收集
2017年5月至7月,从江苏省南部、中部、北部的8个不同地区共收集了水稻主栽品种65个,收集的每份稻种用牛皮纸袋装好并编号,记录来源地信息。
1.2 水稻种子携带恶苗病菌DNA的提取
为了保证检测结果的可靠性,本研究分别采用三种不同的方法来提取水稻种子所携带病原菌的DNA,包括水洗法、研磨法和水洗后研磨法。所提取的DNA样本作为LAMP检测的模板,于-20℃下保存。
1.2.1 水洗法
供试水稻种子在容器中混匀后,采用五点取样法,每一品种称取50 g种子,然后装入250 mL三角瓶中,加入200 mL ddH2O并滴加20%吐温3~5滴。用锡箔纸封住瓶口,置超声波清洗器的水槽内,以40 kHz的频率震荡洗涤10 min。用200目钢筛过滤震荡洗涤后的混合液,钢筛上剩下的水稻种子用少量ddH2O冲洗。将收集的滤液分装于50 mL离心管中,用冷冻离心机以6500 r/min的转速离心5 min,弃上清液后收集沉淀[18]。将沉淀物置于37℃恒温箱中晾干,沉淀物DNA的提取采用美国MOBIO公司的土壤微生物DNA强力提取试剂盒PowerSoil®DNA分离试剂盒,方法步骤参见说明书[19]。
1.2.2 研磨法
供试水稻种子在容器中混匀后,采用五点取样法,每一品种称取10g种子,置于灭菌的研钵中,加入石英砂与液氮充分研磨成粉末,将研磨好的粉末充分混匀后,每份样本称取1.2 g,分装入容积为2 mL的EP管中,每管0.4 g。DNA的提取采用中国北京天根公司的新型植物基因组DNA提取试剂盒(DNAsecure Plant Kit)进行,方法步骤参见说明书。每品种所提取的3管DNA分别进行LAMP检测,当有1管及1管以上的DNA样本检测呈阳性时,即判定该样本携带目标病原菌。
1.2.3 水洗后研磨法
即将超声波水洗处理过滤后残留在钢筛上的水稻种子用ddH2O冲洗干净,取10g用研磨法提取DNA。具体步骤参照以上两种方法。

表1 用于检测藤仓镰孢的LAMP引物
1.3 水稻种子携带病原菌的LAMP检测
采用本实验室研发的4项LAMP检测技术,可分别特异性检测水稻恶苗病的4种致病菌,即藤仓镰孢()、层出镰孢()、拟轮枝镰()和。藤仓镰孢的LAMP特异性引物见表1,其扩增条件和灵敏度分别为62℃,70 min和100 μg/L。层出镰孢、拟轮枝镰孢和的LAMP特异性检测技术体系见表2。
LAMP反应体系的总体积为26 μL,其中,10×ThermoPol 缓冲液2.5 μL,MgSO4(50 mmol/L) 4 μL,甜菜碱(5 mol/L) 4 μL,dNTPs(10 mmol/L) 3.5 μL,内引物FIP和BIP(20 μmol/L)各2 μL,外引物F3和B3(10 μmol/L)分别为0.5 μL,环引物LF和LB(10 μmol/L)分别为1 μL,羟基萘酚蓝(2.4 mmol/L) 2 μL,DNA聚合酶(8 U/μL) 1 μL,水稻种子样品提取的DNA(作为模板)2 μL。反应温度是62℃,恒温,反应时间为70 min。反应结果可用肉眼直接进行观察判断,呈天蓝色时为阳性,呈紫色则为阴性。检测过程中以特定的目标病原菌标准菌株纯培养提取的DNA为模板作为阳性对照,以ddH2O代替病菌的DNA作为阴性对照[18]。
1.4 发病稻苗病原菌的分离验证
为进一步验证水洗法LAMP检测稻种携带恶苗病菌的结果,选择-Ff-LAMP、- Fp-LAMP、-Fv-LAMP、-Fan-LAMP检测呈阳性的水稻品种,分别随机称10 g种子置于培养皿中,在常温下用ddH2O浸泡种子,每隔9 h换一次ddH2O,18 h后转移至28℃恒温培养箱中直到稻种露白。将露白稻种播在盛有灭菌蛭石的塑料盆中,置27℃温室中育苗20 d诱导幼苗自然发病。每一供试品种选取20株疑似发病幼苗(即呈现徒长、矮化、褪绿和死苗等恶苗病疑似症状的小苗),剪取其根茎部(每株取病组织200 mg)分别提取DNA作为模板供LAMP检测。同时,对上述疑似发病稻苗进行病原菌分离与鉴定。将病组织剪成0.5 cm大小的组织块,置70%酒精中表面消毒1 min,移至2% NaClO中浸泡2 min,用无菌水冲洗3次。冲洗后的组织块用灭菌的滤纸片吸干表面的自由水,置于PDA培养基平板上,在25℃黑暗条件下培养3 d后,切取菌落边缘菌丝转入新的PDA培养基上纯化。分离物纯菌丝的基因组采用中国北京天根公司的新型植物基因组DNA提取试剂盒提取。根据病原菌形态和Tef-1α碱基序列比对进行恶苗病菌种的鉴定。

表2 3种水稻恶苗病原菌的LAMP检测技术体系
2 结果与分析
2.1 水洗法LAMP检测水稻种子携带的水稻恶苗病菌
应用本实验室研发的分别特异性针对水稻恶苗病4种致病菌的4种LAMP检测技术,以水洗法(见1.2.1)提取的DNA为模板,对江苏省65个品种的水稻种子携带的恶苗病菌进行LAMP检测。以品种宁粳6号种子带菌的LAMP检测结果为例(图1),图中为以宁粳6号种子采用水洗法提取的DNA作为模板,1~4依次为可特异性检测藤仓镰孢、层出镰孢、拟轮枝镰孢和的LAMP反应结果(阳性呈天蓝色,阴性呈紫色),可通过肉眼观察直接判别其水稻种子携带有藤仓镰孢和层出镰孢2种病原菌。
以水洗法获得的稻种洗涤沉淀物所提取的DNA为模板,对江苏省不同区域来源的65个水稻品种种子携带水稻恶苗病菌的LAMP检测结果见表3。供试的65个品种的水稻种子样本中有54个样本携带恶苗病菌,即83.07%的种子样本携带该病原菌。所有样本中共检测到3种水稻恶苗病菌:藤仓镰孢的检出率最高,达83.07%,54个带菌样本均携带有该病原菌;其次是层出镰孢,检出携带该病原菌的样本有8份,检出率为12.30%;再次是,检出样本有4份,检出率为6.15%;所有供试样本均未检测到拟轮枝镰孢。65个水稻品种中,只检测到携带藤仓镰孢一种病原菌的有42份,占所检测总样本数的64.61%;有12份样本同时携带藤仓镰孢和层出镰孢或,占所检测样本的18.46%,前者有8份样本,后者为4份。
上述结果表明江苏省水稻品种携带水稻恶苗病菌是一个普遍现象,且其优势种为藤仓镰孢,层出镰孢和可能仅起辅助作用。此外,从表3还可以看出,藤仓镰孢在所采集的8个地区普遍分布,而层出镰孢和仅在部分区域被检测到。3种恶苗病菌在江苏省的南部、中部和北部均有分布。
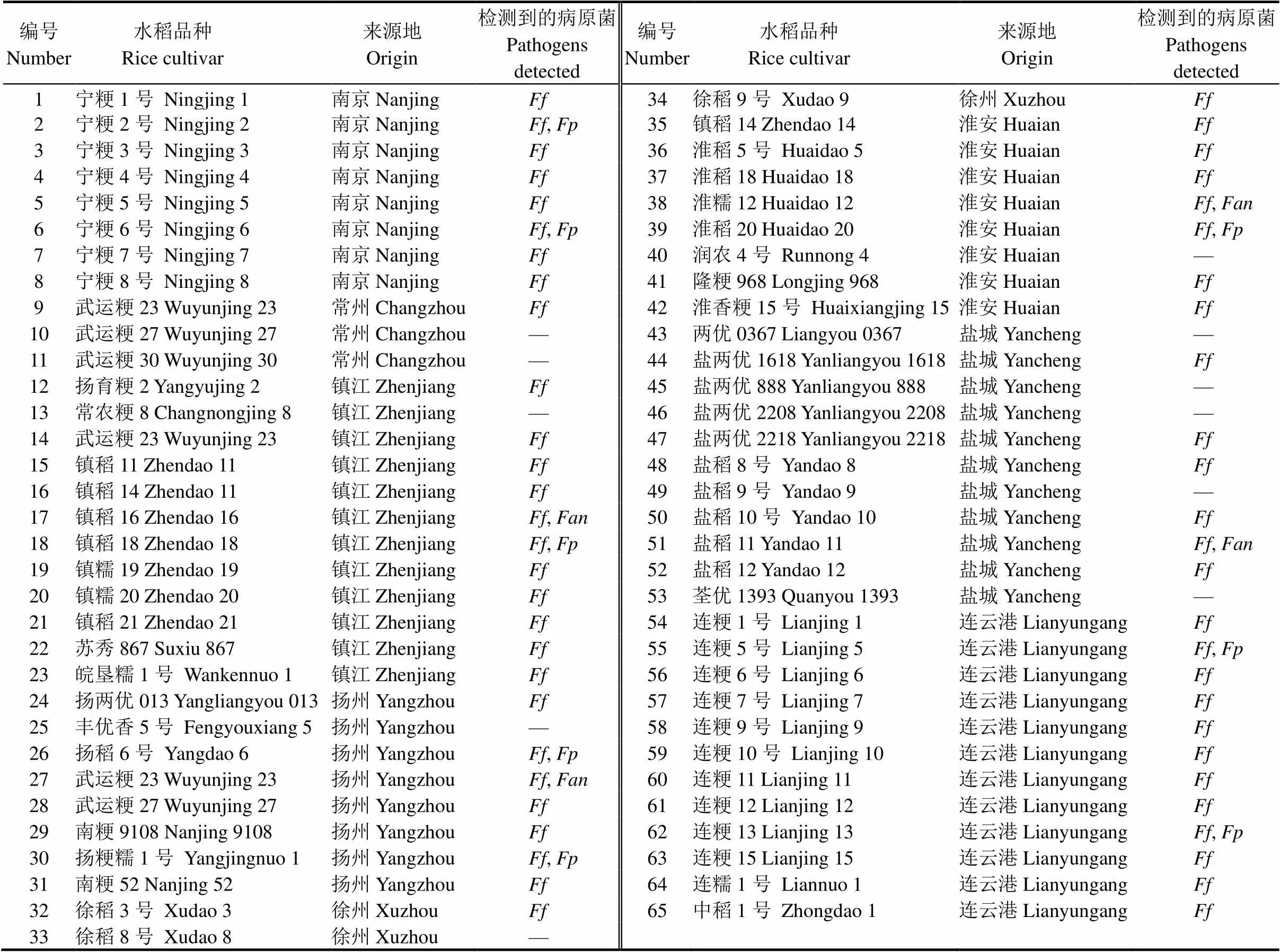
表3 江苏省65个水稻品种种子携带水稻恶苗病原菌的LAMP检测
-藤仓镰孢;-层出镰孢;-;-: 没有检测到。
,;,;,;-, Undetected.
2.2 水洗法LAMP检测水稻恶苗病菌的可靠性
为了探究水洗法LAMP检测水稻恶苗病菌是否能够反映稻种携带恶苗病菌的真实状况,本研究进一步以研磨法提取的DNA为模板进行LAMP检测,并对带菌稻种育苗后自然发病的稻苗进行病原菌分离鉴定加以验证。
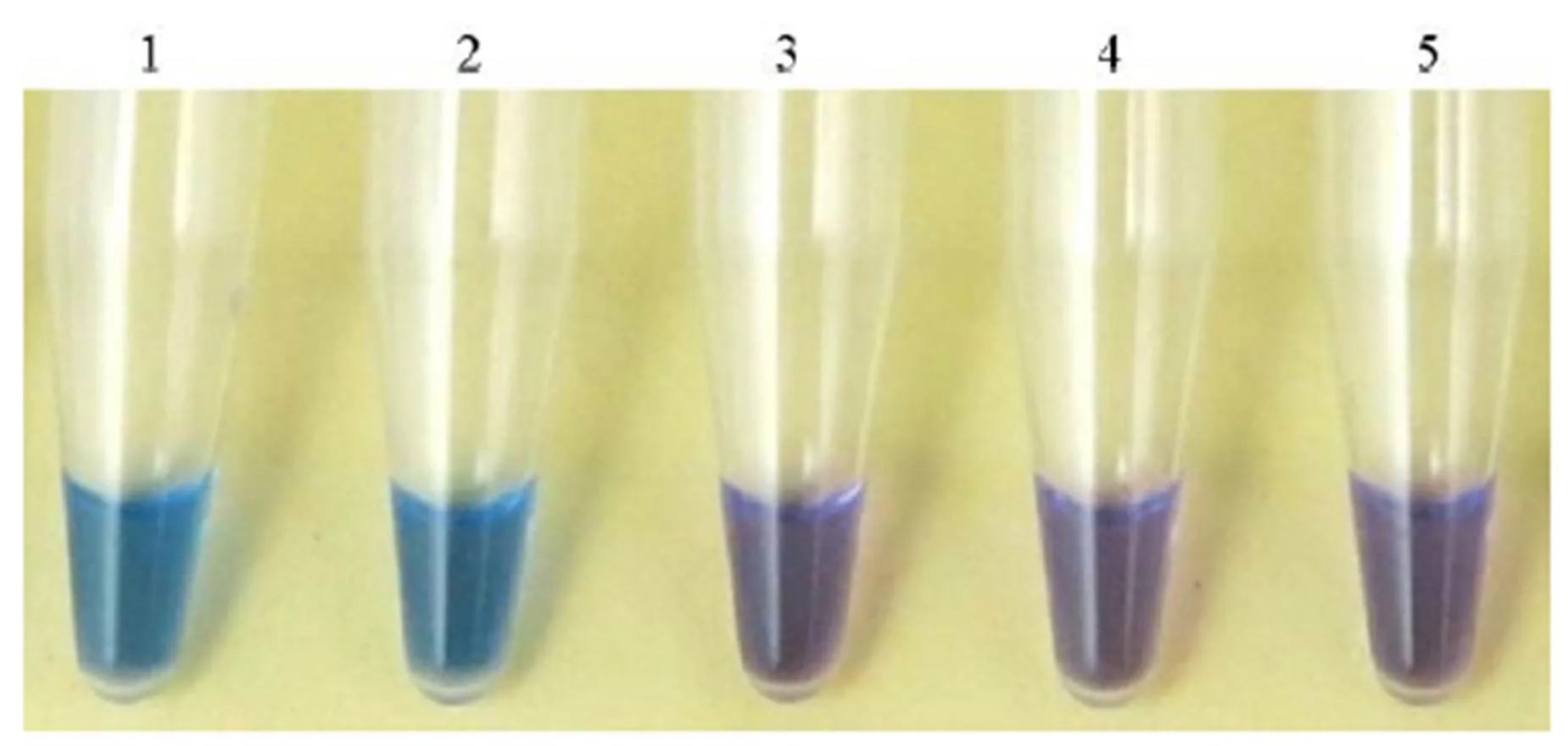
1-藤仓镰孢;2-层出镰孢;3-拟轮枝镰孢;4-Fusarium andiyazi;5-阴性对照。
Fig. 1. Results of loop-mediated isothermal(LAMP) assays for rice bakanae pathogens on rice seeds of cultivar Ningjing 6.
2.2.1 以研磨法提取的DNA为模板的LAMP检测
根据水洗法LAMP检测水稻恶苗病菌的结果,从表3中选取不同带菌类型的40个水稻品种的种子样本,包括未检测出携带恶苗病菌的品种11个,只携带藤仓镰孢一种病原菌的品种17个,同时携带藤仓镰孢和层出镰孢的品种8个,同时携带藤仓镰孢和的品种4个。所选取的40个品种的种子采用研磨法(见1.2.2)提取DNA为模板进行LAMP检测,并将检测结果与水洗法比较。结果表明,11份经水洗法检测未携带恶苗病菌的稻种采用研磨检测也均未检出该病原菌,两者检测结果一致;17个只携带藤仓镰孢的种子样本中检出携带该病菌的样本有13份;8个同时携带藤仓镰孢和层出镰孢的样本中,检出携带藤仓镰孢的样本有7份,携带层出镰孢的样本有4份;4个同时携带藤仓镰孢和的样本中,检出携带藤仓镰孢的样本有3份,携带的样本0份;所有供检测种子样本中均未检出拟轮枝镰孢。
比较两种不同的种子带菌DNA提取方法的LAMP检测结果可以看出,水洗法的结果似更能反映水稻种子携带恶苗病菌的真实状况。分析其原因,一是本研究采用的水洗法在DNA提取过程中加入了超声波处理的程序,不仅有利于洗脱附着种子表面的菌丝和孢子,病种子的组织碎片以及破损病种内部的病原菌亦可能被洗脱出来;二是水洗法比研磨法更有利于富集附着于种子表面的病原菌,有助于提高混杂于种子中或附着在种子表面的病原菌的检出率。部分采用水洗法检测出携带恶苗病菌的种子样本采用研磨法未检测到该病原菌,主要原因可能是这些种子样本所携带的病原菌混杂在种子中或附着于种子表面且带菌量偏低所致。11份经水洗法未检测到恶苗病菌的种子样本用研磨法也都未检测到病原菌,进一步为用水洗法提取的DNA作为模板进行LAMP检测结果的可靠性提供了佐证。根据上述研究结果,我们认为本研究采用的水洗法对稻种携带恶苗病菌的检测是可行的。
2.2.2 发病稻苗病原菌分离鉴定的验证结果
为进一步验证本研究的LAMP检测结果,我们选取同时携带藤仓镰孢和层出镰孢的品种宁粳6号和同时携带藤仓镰孢和的品种盐稻11分别育苗,诱导稻苗自然发病后,对疑似恶苗病发病小苗组织提取的DNA进行LAMP检测,并采用组织分离法分离病原菌。对宁粳6号育成的20株疑似发病稻苗的检测与分离的结果表明,有13株稻苗经藤仓镰孢的LAMP检测呈阴性,有2株经层出镰孢的LAMP检测呈阳性,其余5株检测均呈阴性。提示上述阳性病苗样本可能分别由藤仓镰孢或层出镰孢侵染所致。进一步对检测的所有样本进行组织分离和分离物鉴定。13株经藤仓镰孢LAMP检测呈阳性的稻苗中有12株分离出藤仓镰孢,2株经层出镰孢的LAMP检测呈阳性的稻苗中有1株分离出层出镰孢,其他阴性样本均未分离到该两种病原菌,证实上述阳性病苗的确分别由藤仓镰孢或层出镰孢侵染所致。对盐稻11的20株疑似发病稻苗的检测与分离的结果表明,有15株经藤仓镰孢的LAMP检测呈阳性,从其中12株分离出藤仓镰孢,有3株经的LAMP检测呈阳性,从其中1株分离出。其他检测呈阴性的样本均未分离到该两种病原菌,证实上述阳性病苗的确分别由藤仓镰孢或侵染所致。
经水洗法LAMP检测呈阳性的稻种育苗可自然诱发恶苗病,并从发病组织分离出所检测的恶苗病菌,进一步验证了水洗法LAMP检测的可靠性。同时,携带藤仓镰孢与层出镰孢的宁粳6号和携带藤仓镰孢与的盐稻11育出的病苗中,藤仓镰孢的发病率远高于层出镰孢和,表明藤仓镰孢对水稻具更强的致病力,提示该病原菌可能是引起江苏水稻恶苗病的优势种。此外,稻苗发病组织的LAMP检出率与病原菌组织分离的检出率存在一定差异,可能原因是LAMP检测的检出率显著高于组织分离的检出率。
2.2.3 以水洗后研磨法提取的DNA为模板的LAMP检测结果
根据表3的结果,选择同时携带藤镰仓镰孢和层出镰孢、藤仓镰孢和以及只携带藤仓镰孢的品种各2个,用水洗后研磨法提取DNA为模板供LAMP检测。将该检测结果与水洗法和研磨法检测的结果进行对比(表4),以了解恶苗病菌在种子的存在部位。供试的稻种,经水洗法去除表面携带的病原菌后,进一步采用研磨法提取DNA经LAMP检测,仍有4个品种检出藤仓镰孢,但均未检测出层出镰孢和。表明藤仓镰孢既存在种子表面,也存在种子内部,而层出镰孢和则主要附着于种子表面。未经水洗的稻种用研磨法提取的DNA检测到层出镰孢而未检测到,可能是因种子表面的携带量太少。

表4 3种提取方法的LAMP检测结果对比
-藤仓镰孢;-层出镰孢;-;-: 没有检测到。
,;,;,;-, Undetected.
3 讨论
本研究应用分别特异性针对4种水稻恶苗病菌的4项LAMP检测技术,对江苏省65个水稻主栽品种种子进行检测。结果显示,供试的65个品种的水稻种子样本中有54个样本携带恶苗病菌;共检测到3种恶苗病菌,检出率由高到低依次为藤仓镰孢、层出镰孢和;所有检测样本均未检测到携带有拟轮枝镰孢。结果表明江苏省水稻种子携带恶苗病菌是一种普遍现象,且藤仓镰孢为优势致病菌,为了解当地水稻种子携带恶苗病菌的情况提供了有价值的参考。
同时,本研究为水稻种子携带恶苗病菌的检测提供了一个操作简便、快捷且准确性高的检测技术。过去的研究表明,恶苗病菌可附着于水稻种子表面或寄藏于种子内部[7]。因此需要探寻并建立适用的种子携带病原菌基因组DNA提取方法以尽可能提升LAMP检测结果的可靠性。研磨法对检测种子内部寄藏的病原菌是可行的,但对检测种子外部携带的病原菌(混杂于种子中或附着于种子表面的病原菌)则适用性偏低,尤其是种子外部携带病原菌的量偏低时漏检的机率大。且受采用试剂盒提取DNA方法的限制,研磨法难以满足对较大种子样本进行检测的需要,因而可能影响检测结果的可靠性。本研究建立的水洗法提取种子携带恶苗病菌DNA的方法,在种子洗涤过程中增加了超声波震荡处理,有助于最大限度地洗脱附着于种子表面的病原菌、病种子组织碎片以及破损病种子内部的病原菌。而且,洗涤液经离心可进一步将目标病原菌富集于沉淀物中,有助于显著提高检出率和检测结果的准确性。此外水洗法操作简便,适用于对较大种子样本进行检测,可降低漏检的机率,符合实际应用的需求。因此,以水洗法提取的基因组DNA为模板对水稻种子携带恶苗病菌进行LAMP检测是较为可行的方法。
以往的水稻种子带菌检测,大多需要先分离获得病原菌的纯培养,然后根据其形态特征进行病原菌种类鉴定[13]。操作过程繁琐,耗时较长,且检出率偏低。近年来报道的基于PCR检测稻种携带恶苗病菌的方法[14],对种子带菌检测技术有所提升,但也存在对DNA模板要求较高、操作程序偏繁琐,检测所需时间偏长等缺点。本研究应用的LAMP检测技术具有以下优点:1)其4条引物可特异性识别目标病原菌的6个靶标区段,对识别目标病原菌的特异性更高,并可在等温条件高效快速地扩增靶标基因[17];2)操作简单,经济,不需要昂贵的仪器设备[22];3)由于在扩增反应体系中加入指示剂羟基萘酚蓝(HNB),扩增反应结果可直接用肉眼判断,阳性反应结果呈天蓝色,阴性呈紫色;4)检测所需时间短,应用本技术完成一次水稻种子带菌检测(从水洗法提取DNA到检测完成)只需4 h左右;5)对DNA模板质量要求不高,可从包含目标病原菌、稻种组织、尘土颗粒以及其他微生物的混合DNA中直接检出目标病原菌。此外,本研究运用的4个LAMP检测技术是特异性针对水稻恶苗病的4种致病菌的,因而病原菌的检测与种的鉴定可同步完成,大大提高了稻种携带恶苗菌的检测效率。
本研究还对来自浙江、安徽、广西、福建等地区的15个水稻种子携带恶苗病菌进行了LAMP检测,有10份样本检测出携带有藤仓镰孢(结果未显示),提示我国南方稻区种子携带藤仓镰孢可能较为普遍。值得注意的是,来自江苏和南方其他省份的80份水稻种子样本中均未检测到携带有拟轮枝镰孢,提示种子带菌可能不是拟轮枝镰孢引起水稻恶苗病的主要初侵染源。我们对2016-2017年从江苏不同区域稻田采集的近200份疑似恶苗病菌植株中检测出21份由拟轮枝镰孢引起的病害样本,并从病组织中分离出该病原菌,提示由拟轮枝镰孢引起的恶苗病在江苏省有一定程度的发生。我们选择未携带恶苗病菌的润农4号为供试种子样本,在每50 g稻种中人工添加0、1000、2000、4000、8000个拟轮枝镰孢(分离自水稻恶苗病组织)的分生孢子。采用水洗法提取DNA作为LAMP检测的模板,结果是添加8000个孢子的样本检测呈阳性。由于人工接种无病稻种可导致稻苗发生恶苗病的病菌孢子数量需达到1×106个/mL[14],说明本文研发的技术对稻种携带拟轮枝镰孢的检测是适用的。所有供试品种的种子样本均未检测出携带拟轮枝镰孢,可能是水稻种子不携带拟轮枝镰孢或所携带菌量太低不足以检出所致。造成上述现象的原因仍有待进一步研究。
谢辞:南京农业大学水稻研究所万建民教授为本研究提供部分供试品种,谨此致谢!
[1] 杨荣明. 水稻种传病害发生规律及防治方法. 农家致富, 2014(10): 34-35.
Yang R M. Occurrence regularity and control methods of rice seed-borne disease., 2014(10): 34-35. (in Chinese)
[2] 郑睿. 江苏省水稻恶苗病菌对咪鲜胺和氰烯菌酯的抗药性监测及其敏感性分析. 南京:南京农业大学, 2014.
Zheng R. Resisitance monitoring and sensitivity analysis ofto prochloraz and JS399-19 in Jiangsu province. Nanjing: Nanjing Agriculture University, 2014. (in Chinese with English abstract)
[3] Wulff E G, Sorensen J L, Lübeck M, Nielsen K F, Thrane U, Torp J.spp. associated with rice Bakanae: Ecology, genetic diversity, pathogenicity and toxigenicity., 2010, 12(3): 649-657.
[4] Matic S, Gullino M L, Spadaro D T. The puzzle of bakanae disease through interactions betweenand rice., 2017, 9: 333-344.
[5] 于晓岳. 江苏省稻、麦种子质量分析研究. 扬州: 扬州大学, 2015.
Yu X Y. The rice andwheat seeds’ quality analysis and research in Jiangsu Province. Yangzhou: Yangzhou University, 2015. (in Chinese with English abstract)
[6] 刘丹丹. 水稻恶苗病的发生及防治措施. 吉林农业, 2012(11): 75.
Liu D D, The occurrence and control measures of rice bakanae disease., 2012(11): 75.( in Chinese)
[7] 陈嘉孚, 刘铸德, 陆世英. 水稻恶苗病的种子带菌检验和防治研究. 种子, 1985(1): 44-47.
Chen J F, Liu Z D, Lu S Y. The examination and prevention research of rice bakanae pathogens on rice seeds., 1985(1): 44-47. (in Chinese)
[8] 马炳田, 王玲霞, 李仕贵, 李平. 四川省杂交水稻种子寄藏真菌研究. 种子, 2008(01): 1-5.
Ma B T, Wang L X, Li S G, Li P. Survey of seed-borne mycoflora on hybrid rice in Sichuan.2008(1): 1-5. ( in Chinese with English abstract)
[9] Serferbe S, Noumbo G R T, Roger K J. Seed-borne fungi associated with rice seeds varieties in Bongor, Chad Republic.2016, 5(12): 161-170.
[10] 台莲梅, 盖世武, 辛惠普. 黑龙江省垦区水稻种子病原真菌鉴定. 黑龙江农业科学, 2002(02):5-7.
Tai L M, Gai S W, Xin H P. Identification of pathogen fungi on the rice seeds from Heilongjiang reclamation area., 2002(02):5-7. (in Chinese with English abstract)
[11] 李小林, 谷安宇, 张馨宇,徐雨然, 罗来鑫, 李健强. 水稻种子寄藏真菌的3种检测方法对比研究. 中国农业大学学报, 2011, 16(06):43-51.
Li X L, Gu A Y, Zhang X Y, Xu Y R, Luo L X, Li J Q. Comparative analysis of three kinds of testing methods for rice seed-borne fungi.,2011, 16(06):43-51. ( in Chinese with English abstract)
[12] Agarwal V K, Singh O V. Relative percentage incidence of seed-borne fungi associated with different varieties of rice seeds., 1974(2): 23-25.
[13] 刘西莉, 李健强, 朱春雨, 张国珍, 张龙. 不同水稻品种种子带菌检测及药剂消毒处理效果. 中国农业大学学报, 2000(5): 42-47.
Liu X L, Li J Q, Zhu C Y, Zhang G Z, Zhang L. Testing of seed borne fungi of major rice varieties from China and disinfection effect of several fungicides to seed pathogens,, 2000(5): 42-47.(in Chinese with English abstract)
[14] Amatulli M T, Spadaro D, Gullino M L, Garibaldi A. Conventional and real-time PCR for the identification ofandfrom diseased rice tissues and seeds., 2012(134): 401-408.
[15] 梁力哲, Moller K. 中国水稻种子上常见寄生性真菌的检验识别. 植物保护, 1989(2): 42-44.
Liang L Z, Moller K. Identification of common rice seed-borne fungi in China., 1989(2): 42-44. ( in Chinese)
[16] Heng M H,Salleh B,Zakaria L.Molecular identification ofspecies inspecies complex from rice, sugarcane and maize from Peninsular Malaysia., 2011, 12(10): 6722-6732.
[17] Notomi T, Okayama H, Masubuchi H, Yonekawa T, Watanabe K, Amino N, Hase T. Loop-mediated isothermal amplification of DNA., 2000, 28(12): E63.
[18] 袁咏天, 叶文武, 曾丹丹, 王晓莉, 王源超, 郑小波. 基于环介导等温扩增技术检测东北地区大豆主要品种(系)种子携带的病原菌. 大豆科学, 2017(4): 592-598.
Yuan Y T, Ye W W, Zeng D D, Wang X L, Wang Y C, Zheng X B. Detection of soybean seed-borne pathogens in northeast China using loop-mediated isothermal amplification assays., 2017(4): 592-598. (in Chinese with English abstract)
[19] 曾丹丹, 张海峰, 田擎, 许苗, 王源超, 郑小波. 基于环介导等温扩增技术检测黄淮地区大豆主栽品种种子携带的病原菌. 南京农业大学学报, 2016, 39(6): 947-953.
Zeng D D, Zhang H F, Tian Q, Xu M, Wang Y C, Zheng X B. Detection of soybean seed-borne pathogens in Huang-Huai Area using LAMP assays., 2016, 39(6): 947-953. (in Chinese with English abstract)
[20] 曾丹丹. 拟轮枝镰孢、黄色镰孢、雪松疫霉、栗黑水疫霉及大豆种传病原菌的LAMP检测. 南京: 南京农业大学, 2017.
Zeng D D. LAMP detetion of,,,and seed-borne pathogens on soybean. Nanjing: Nanjing Agricultural University, 2017. (in Chinese with English abstract)
[21] 戎振洋, 袁咏天, 曾丹丹, 叶文武, 杨红福, 郑小波. 基于环介导等温扩增技术快速诊断由引起的水稻恶苗病. 植物病理学报, 2017, 48(2): 256-262.
Rong Z Y, Yuan Y T, Zeng D D, Ye W W, Yang H F, Zheng X B. Rapid diagnosis of rice bakanae caused byusing a loop-mediated isothermal amplification assay., 2017, 48(2): 256-262. (in Chinese with English abstract)
[22] 白宗师, 秦萌, 赵立荣, 韩玉春, 王东伟, 徐春玲, 谢辉. 水稻干尖线虫的环介导恒温扩增技术(LAMP)快速检测方法. 中国水稻科学, 2017, 31(4): 432-440.
Bai Z S, Qin M, Zhao L R, Han Y C, Wang D W, Xu C L, Xie H. Loop-mediated isothermal amplification assay for rapid diagnosis of., 2017, 31(4): 432-440. (in Chinese with English abstract)
Detection of Seed-borne Rice Bakanae Pathogens in Jiangsu Province, China Using Loop-mediated Isothermal Amplification Assays
YUAN Yongtian1, RONG Zhenyang1, YE Wenwu1, ZHANG Hongsheng2, ZHUANG Yiqing2, ZHENG Xiaobo1,*
( College of Plant Protection,,,;College of Agronomy,,,;Zhenjiang Agric-academy of Sciences,,; Corresponding author ,:)
【Objective】The research aims to reveal the situation of seed-borne rice bakanae pathogens in Jiangsu Province, China. 【Methods】The seeds of 65 major rice cultivars collected from this area were analyzed by using loop-mediated isothermal amplification (LAMP) assays for specific detection of 4 known rice bakanae pathogen species, including,,and. 【Results】There were 54 rice cultivars carrying rice bakanae pathogens, indicating it’s a common phenomenon that rice seeds carrying rice bakanae pathogens in Jiangsu Province. And the most frequent species was, representing 83.07% of the total samples tested, followed byand,representing 10% and 6% respectively. However, none of the 65 rice cultivars was tested to be carrying. 【Conclusions】The method is readily available for detecting seed-borne rice bakanae pathogens.
rice bakanae;detection of seed-borne pathogens; loop-mediated isothermal amplification
S435.111.4+4; S511.041
A
1001-7216(2018)05-0493-08
2017-09-26;
2017-12-13。
国家863计划资助项目(2012AA101501)。
10.16819/j.1001-7216.2018.7119
