芝芪菌质提取物免疫活性研究
2018-09-21阮鸣喻斌霍光明张李阳刘维周
阮鸣,喻斌,霍光明,张李阳,刘维周
(1.南京晓庄学院食品科学学院、江苏省高校“特殊生物质废弃物资源化利用”重点建设实验室,江苏 南京 211171;2.南京中医药大学江苏省中药药效与安全性评价重点实验室,江苏 南京 210023)
将灵芝菌种接种于黄芪药渣中进行固体发酵得到的灵芝菌丝体与黄芪药渣的发酵复合体谓之芝芪菌质。其中的黄芪药渣的化学成分为灵芝真菌的生长提供营养,而灵芝真菌的酶又可改变黄芪药渣的组织和成分,因这种双向性而被称为双向性固体发酵技术。双向性固体发酵技术是将药用真菌发酵菌种(例如灵芝、槐耳、姬松茸等)和发酵基质(具一定活性成分的中药材或药渣)构成发酵组合,双方相适应则在一定条件下进行固体发酵。
中药药材加工为中成药后剩留大量尚含有各种残余成分的药渣,但它大多被废弃。目前我国药渣的资源化利用可分为3类,即有效成分的富集提取利用、生态经济化利用和高附加值化利用[1]。双向固体发酵技术是目前开发药渣最有希望的途径之一,可被用来开发药渣,以产生各种有用的药性菌质(药渣与真菌菌丝发酵复合体),它作为一种新资源可继续研发成新药或保健品、功能性食品等。
本课题组的前期实验研究已证实芝芪菌质对肉鸡、日本沼虾、中华绒螯蟹、黄颡鱼具有显著的免疫促进作用[2-5]。本实验目的是为了探究芝芪菌质对人体的免疫促进作用,筛选其免疫活性部位,为黄芪药渣的二次利用提供理论依据,为将芝芪菌质继续研发成新药或保健食品、功能性食品提供实验依据。
1 材料
1.1实验动物体质量18~22 g的雄性小鼠384只,180~220 g的雄性大鼠8只,均为上海杰思捷实验动物有限公司提供(许可证号码:SCXK沪2013-0006)。本研究符合一般实验动物伦理学原则。本研究起止时间为2016年2~8月。
1.2试剂和药品灵芝菌购于中国微生物菌种保藏管理委员会普通微生物中心(菌种编号5.0616);芝芪菌质由南京晓庄学院药用菌物研究所制备; 江苏南星药业有限责任公司收集黄芪药渣;注射用环磷酰胺(江苏盛迪医药有限公司,批号15102825);匹多莫德片(赛诺菲,批号140811);印度墨汁(Solarbio LIFE SCIENCES,No.1221F021);甲醇、无水乙醇、NaH2PO4、Na2HPO4、Na2CO3(分析纯,国药集团化学试剂有限公司);0.9~1.1 mm 玻璃熔点毛细管(上海曼贤实验仪器商行);刀豆素A(Con A)(美国AMRESCO公司,批号20151217);D101大孔树脂(上海蓝季科技发展有限公司,批号121020);瑞氏染液、20%绵羊红细胞悬液、RPMI-1640 培养基和台盼蓝(均购于南京建成生物技术研究所);小鼠IgG ELISA试剂盒(欣博盛生物科技有限公司,Lot.M160809-116b);小鼠IgM ELISA试剂盒(欣博盛生物科技有限公司,Lot.M160914-129a)。
1.3仪器SynergyH1型美国BIOTEK全功能微孔板检测仪(酶标仪),IX71型奥林巴斯显微镜。MCO-5AC型三洋CO2培养箱。
2 方法
2.1芝芪菌质各样品的制备
2.1.1芝芪菌质水提液的制备 取芝芪菌质20 g,加10倍量的水加热回流提取1 h,冷却,过滤,滤液备用;滤渣再加10倍量的水加热回流提取1 h,冷却,过滤。两次滤液合并,减压浓缩至50 mL,制成芝芪菌质含量为0.4 g·mL-1的芝芪菌质水提液。
2.1.2芝芪菌质水浸液的制备[6]取芝芪菌质20 g,置研钵中研细(研钵置于冰袋中),再加适量水研磨1 h,水浸液过滤,转移置50 mL容量瓶中,加水定容,制成芝芪菌质含量为0.4 g·mL-1的芝芪菌质水浸液。
2.1.3芝芪菌质各部位的分离制备 将处理好的新购大孔树脂D101用蒸馏水装柱,将2.1.1项下的0.4 g·mL-1的芝芪菌质水提液加入大孔树脂分离柱中,分别用4BV量(4倍树脂体积量)的水、40%乙醇、95%乙醇洗脱,各洗脱部位经减压浓缩回收溶剂后,加水溶解,分别制成芝芪菌质含量为0.4 g·mL-1的水洗脱液、40%乙醇洗脱液和95%乙醇洗脱液。
2.2非特异性免疫功能实验
2.2.1小鼠碳粒廓清实验[7-9]分组方法:取昆明雄性小鼠96只(18~22 g),采用随机数字表法分成8组:对照组(正常组)、模型(环磷酰胺)组、阳性(匹多莫德,0.32 g·kg-1)组、样品组(再分5亚组:芝芪菌质水提液、水浸液、水洗液、40%乙醇洗脱液和95%乙醇洗脱液),每组12 只。除对照组外,其他各组均采用环磷酰胺复制免疫缺陷小鼠模型。
造模方法:实验d1~d3,鼠腹腔注射环磷酰胺(80 mg·kg-1),1次/天,连续3 d。d6再以相同剂量再次腹腔注射一次。
给药方法:d1灌胃给药,每天0.1 mL/10 g,400 mg·kg-1,1次/天,连续给药7 d,d6晚禁食12 h后,d7上午最后1次给药后立即检测。
检测方法: 5倍稀释的印度墨汁按0.05 mL/10 g体质量,每只鼠尾静脉注射,分别于第2、12 分钟在小鼠眼眶后静脉丛用毛细采血管取血20 μL溶于2 mL 0.1%Na2CO3溶液中,摇匀。以0.1%Na2CO3溶液作空白,测定600 nm处吸光度。
检测指标:取小鼠肝、脾脏,称量其质量。计算廓清指数K、校正廓清指数α。
K=(log OD1-log OD2)/(t2-t1)
α=K1/3×体质量/(肝重+脾重)
2.2.2鸡红细胞吞噬功能实验[10-11]分组、造模、给药方法:同2.2.1。
检测方法:最后一次给药后1 h,每只小鼠腹腔注射1%鸡红细胞悬液1 mL。间隔30 min颈椎脱臼处死,仰位固定于鼠板上,腹腔注入生理盐水1 mL,转动鼠板1 min。然后吸出腹腔液0.5 mL,平均分滴于2片玻片上,用生理盐水漂洗,自然干燥后以甲醇溶液固定,瑞氏染液染色,干燥后镜下观察计数:
吞噬百分率/%=吞噬鸡红细胞的巨噬细胞数/计数的巨噬细胞数×100%;
吞噬指数=被吞噬的鸡红细胞总数/计数的巨噬细胞数×100%
2.3特异性免疫功能实验
2.3.1对免疫缺陷小鼠血清溶血素的影响[12-14]分组、造模、给药方法:同2.2.1。检测方法:给药7 d后,每鼠腹腔注射20%绵羊红细胞(SRBC)悬液0.2 mL致敏,给药14 d后眼眶取血制备血清。将收集好的血清做系列稀释,确定最佳稀释度。吸取稀释的血清0.5 mL,依次加入20% SRBC、10稀释补体、0.9%生理盐水各0.5 mL,空白管用生理盐水代替血清,混匀,置37 ℃温箱1 h,再置冰浴中5 min,离心,取上清液于540 nm 处测定OD值,并计算:溶血素含量=样本血清的OD值×稀释倍数。
2.3.2对免疫缺陷小鼠血清IgM、IgG含量影响[15]
分组、造模、给药方法:同2.2.1。检测方法:采用ELISA法,按照说明书要求测定血清中IgG、IgM 含量。
2.3.3对小鼠脾淋巴细胞增殖的影响[16-18]含药血清的制备:实验各组大鼠连续灌胃7 d后,颈动脉取血,制备含药血清。对照组和ConA组采用的是3只空白大鼠血清(对照组2只,ConA组1只),其他5组给药组分别每组1只大鼠制备含药血清,给药剂量为400 mg·kg-1。
脾细胞原代培养:小鼠用75%乙醇浸泡5 min,无菌操作取脾脏,用完全RPMI-1640 培养基制备2.0×109·L-1的脾细胞悬液,台盼蓝染料检测细胞活力>95%以上,备用。
实验方法:将各组100 μL脾细胞悬液分别加入96孔培养板中,再分别加入Con A(终浓度为5 mg·L-1)及含药血清,总体积200 μL。设置只加200 μL RPMI-1640培养基为空白对照。每实验组设10个复孔。加液后把培养板置于微量振荡器上振荡2 min混匀,于37 ℃含5% CO2培养箱中温育72 h,变色后用MTT法于酶标仪测吸光值A(λ= 490 nm)。增殖指数SI=样品组A/ConA组A。

3 结果
3.1非特异性免疫功能实验模型组各检测指标与对照组相比差异有统计学意义(P<0.01),见表1。表明造模成功,即除对照组外其余各组都是免疫功能低下的小鼠。阳性组各检测指标与模型组相比差异有统计学意义(P<0.05或0.01),表明匹多莫德片可有效提高免疫功能低下小鼠的机体免疫力。水浸液、水提液和40%乙醇洗脱液组均可显著提高免疫缺陷小鼠K值、α值、鸡红细胞的吞噬指数和吞噬百分率(与模型组比较,P<0.05或0.01),提示它们可显著提高免疫缺陷小鼠的非特异免疫吞噬功能。但水洗脱液和95%乙醇洗脱液组的各检测指标却未见显著增强(与模型组比较,P>0.05)。
3.2特异性免疫功能实验水浸液、水提液和40%乙醇洗脱液组均可显著提高免疫缺陷小鼠血清中的溶血素水平和IgM、IgG含量(与模型组比较,P< 0.05,0.01);此外,水洗脱液组也可显著提高免疫缺陷小鼠血清中的IgG含量(与模型组比较,P< 0.05),95%乙醇洗脱液组可显著提高免疫缺陷小鼠血清中的IgM含量(与模型组比较,P< 0.05)。提示它们均可显著提高免疫缺陷小鼠的特异性体液免疫功能。见表2。

表1 小鼠碳粒廓清和鸡红细胞吞噬功能实验结果
注:与模型组比较,aP< 0.05;bP< 0.01
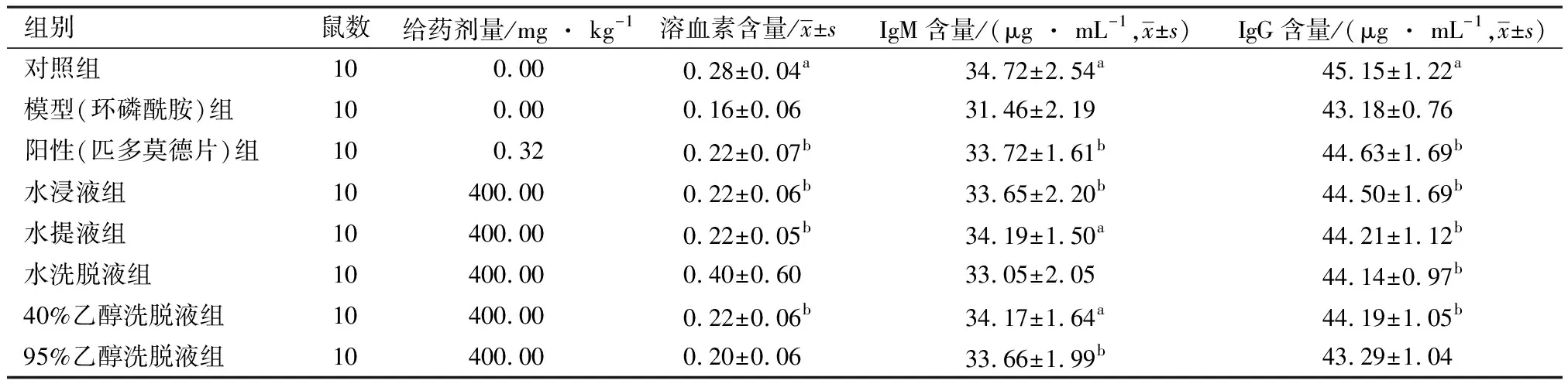
表2 小鼠血清溶血素和IgM、IgG的含量检测
注:与模型组比较,aP< 0.05;bP< 0.01
与对照组吸光值相比可见,ConA组可显著增加小鼠脾淋巴细胞增殖(P<0.05)。水浸液、水提液和40%乙醇洗脱液组的吸光值均显著增加(与模型组比较,P< 0.05),提示它们可显著促进小鼠脾淋巴细胞增殖,从而提高免疫缺陷小鼠的特异性细胞免疫功能。见表3。

表3 小鼠脾淋巴细胞增殖实验的结果
注:与ConA 组比较,aP<0.01
4 讨论
本实验结果提示:芝芪菌质与芝芪菌质40%乙醇洗脱部位均具有显著的促进特异性和非特异性免疫功效;芝芪菌质的免疫活性来自其水洗脱液、40%乙醇洗脱液和95%乙醇洗脱液三部位的效应综合,但免疫功效部位主要集中在40%乙醇洗脱液段,而另两个部位分别仅对一个指标有效(IgG,IgM),提示芝芪菌质40%乙醇洗脱部位的免疫促进作用可代表其整体功效;芝芪菌质水提液为加热回流提取,芝芪菌质水浸液则在低温下制备(防止破坏蛋白成分),但前者的免疫增强功效优于后者(多个指标P<0.01),表明加热提取并不影响芝芪菌质的免疫活性。
