麦冬多糖多囊脂质体的制备及其抗2型 糖尿病活性的研究
2018-09-20施吉祥朱菁徐希明余江南
施吉祥,朱菁,徐希明,余江南
(江苏大学药学院,江苏 镇江 212013)
麦冬多糖(Ophiopogon japonicas polysaccharide,OJP)是从植物麦冬的块根中提取的水溶性多糖,来源广泛,药理活性强,具有抗肿瘤、抗氧化、抗心肌缺血再灌注损伤等活性[1-5]。此外,麦冬多糖良好的降血糖效果且毒副反应小等优势使其得到广泛关注。然而,天然麦冬多糖由于亲水性高,半衰期短且易被体内的酸、碱或酶破坏,使其失去活性,因此口服生物利用度很低,不能在体内发挥预期的治疗效果,严重限制了OJP的临床应用。
多糖属于水溶性好的大分子类物质,多囊脂质体(multivesicular liposomes,MVLs)特别适合水溶性的小分子和生物大分子(蛋白、多肽等)的传递,是采用贮库泡沫技术的一种新型脂质体(1~100 μm),内部是由多个含水腔室以非同心圆的形式构成的,各水性腔室之间又以类脂双分子层磷脂膜相隔[6],这种独特的结构使得其在体内外都有较高的稳定性。多囊脂质体通常具有较大的粒径与更大的包封容积,其较大的内水相空间弥补了普通脂质体对亲水性药物包封率低的问题[7]。不连续的多囊泡结构使得其具有良好的稳定性与缓释效果,当某个囊泡破裂时,药物仅从该囊泡释放出来,而脂质体的结构仍然可以保持完整,因此药物释放缓慢,稳定性高[8],是一种很有前景的天然多糖药物传递系统。
本文通过Box-Behnken响应面设计法筛选出包封率最高的麦冬多糖多囊脂质体(OJP-MVLs)的处方,并对其进行体外表征和稳定性试验。通过建立2型糖尿病小鼠模型,比较麦冬多糖及其多囊脂质体抗2型糖尿病的活性。
1 材料与方法
1.1 材料
四川麦冬(河北神桥农业科技有限公司);胆固醇、三油酸甘油酯、Tween 80、葡萄糖、赖氨酸、维生素E、柠檬酸、柠檬酸三钠以及二氯甲烷、乙醚、甲醇等分析纯试剂(国药集团化学试剂有限公司);DOPC、DOPG(德国Lipoid公司);高糖高脂饲料(江苏协同生物工程有限公司);链脲佐菌素(上海源叶生物科技有限公司);盐酸二甲双胍片(北京京丰制药集团);胰岛素ELISA试剂盒(上海酶联生物科技有限公司)。
1.2 动物及饲养条件
昆明小鼠,雄性,体质量(20±2)g,江苏大学实验动物研究中心提供。每10只一笼进行饲养,环境温度(20±2)°C,自由供食供水,每12 h光暗交替。
1.3 OJP的制备
取粉碎的四川麦冬200 g,用蒸馏水提取,料液比为1∶12,提取温度为100℃,提取2次,每次4 h,离心10 min (3 000 r/min)后,弃去药渣,收集滤液。所收集的滤液经减压浓缩至100 mL以内,加5倍量的95%乙醇,醇沉过夜,离心10 min(3 000 r/min)后收集沉淀。沉淀物用水复溶后,加入20%三氯乙酸溶液使体系中三氯乙酸最终浓度为7%,离心30 min(10 000 r/min)除去蛋白沉淀,收集上清液并用氢氧化钠溶液调pH值至中性,减压浓缩后,装入透析袋中(截留分子量为3 500 Da),在蒸馏水中透析4天,勤换水。合并浓缩,冻干得四川麦冬多糖。用苯酚-浓硫酸法测得多糖含量为99.83%。
1.4 OJP-MVLs的制备与表征
1.4.1 OJP-MVLs的制备方法
采用复乳法制备麦冬多糖多囊脂质体(OJP-MVLs)。称取一定量的DOPC、DPPG、胆固醇、三油酸甘油酯和维生素E溶解于1 mL的有机溶剂中,搅拌使其完全溶解,形成油相,加入到同等体积的溶有一定质量麦冬多糖(OJP)的4.5 %(w/v)葡萄糖溶液(内水相)中,高速剪切(9 000 r/min,10 min)使之形成稳定的W/O型乳液(初乳)。再制备3 mL含有一定量Tween 80,4.0%(w/v)葡萄糖溶液,40 mmol/L赖氨酸的外水相。在磁搅拌的条件下,将初乳注入到外水相中,形成W/O/W型复乳,置于37℃的恒温水浴锅中并通氮气除去有机溶剂,直至完全去除,并将其分散到生理盐水中,得到麦冬多糖多囊脂质体。
1.4.2 OJP-MVLs包封率的测定
采用苯酚-硫酸法测定麦冬多糖多囊脂质体包封率。计算公式如下:
包封率(%)=(C药/ C总)×100%
其中C药为包封于脂质体中的药物量;C总为脂质体中包封的多糖与游离多糖之和。
1.4.3 Box-Behnken响应面设计法优化处方
在单因素实验的基础上,根据Box-Benhnken中心组合实验的设计原则[9],考察各因素间的交互作用,对处方进行优化,药脂比为1:1,即24 mg 麦冬多糖和24 mg的磷脂(其中DOPC 20 mg,DPPG 4 mg),维生素E 5 mg。选择三油酸甘油酯(TO)的质量X1(mg)、总磷脂和胆固醇的质量比X2(w/w)、吐温80的质量X3(mg)作为3因素,每个因素分为3个水平,即设计一个3因素3水平的试验表(表1),根据Design Expert 8软件设计的因素水平表进行实验。
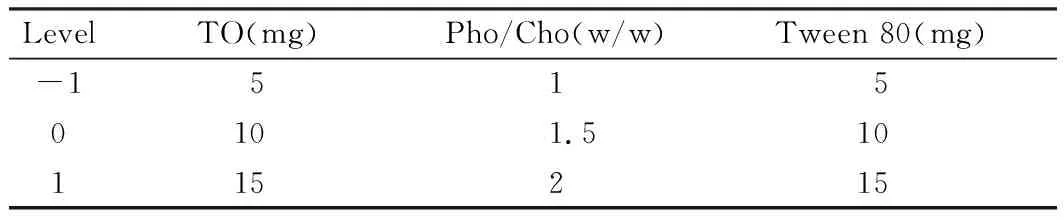
表1 Box-Benhnken因素水平编码表
1.4.4 OJP-MVLs的表征
制备浓度为4 mg/mL的麦冬多糖多囊脂质体,稀释5倍,取适量滴至载玻片上,盖上盖玻片,光学显微镜下(400×)观察多囊脂质体形态。OJP-MVLs经适当稀释后用激光粒度分析仪测定粒径分布。用Zeta电位分析仪测定Zeta电位,操作温度为25℃,平行测定3次。
1.4.5 稳定性试验
按最优处方工艺制备理论浓度为4 mg/mL的麦冬多糖多囊脂质体,于4℃下放置15天,分别于放样后的第0天、第5天、第10天和第15天观察外观性状有无变化,同时进行包封率和粒径的测定。
1.5 抗2型糖尿病活性研究
1.5.1 2型糖尿病小鼠模型的建立
在实验开始前将KM小鼠适应性饲养1周,将小鼠置于受控的环境条件下,室温(20±2)℃、12 h光照和黑暗周期,并可自由获取食物和水。用高脂高糖饲料(基础饲料加20 %的蔗糖,10%的蛋黄粉和10%的猪油)喂养4周,然后禁食12 h后,腹腔注射30 mg/kg的STZ溶液(STZ应溶解在pH值为4.2~4.5的0.1 mol/L的柠檬酸缓冲液中,且在冰浴中配制和保存,现配现用以保障其效果),观测血糖2天,再次禁食12 h后腹腔注射STZ 30 mg/kg,给建模药2周后测定小鼠的空腹血糖,空腹血糖水平≥11.1 mmol/L为造模成功,维持高脂高糖饲料喂养1周后开始给药。
1.5.2 动物分组及给药
取40只2型糖尿病小鼠,按空腹血糖水平随机分成6组,每组10只,另取正常小鼠10只,进行实验,连续给药28天。
正常对照组(Normal control group):正常小鼠口服灌胃0.3 mL的生理盐水。
模型对照组(Model control group):2型糖尿病小鼠口服灌胃0.3 mL的生理盐水。
二甲双胍组(Metformin group):2型糖尿病小鼠口服灌胃二甲双胍150 mg/kg。
麦冬多糖组(OJP group):2型糖尿病小鼠口服灌胃OJP 200 mg/kg。
麦冬多糖多囊脂质体组(OJP-MVLs group):2型糖尿病小鼠口服灌胃OJP-MVLs 200 mg/kg。
1.5.3 对小鼠空腹血糖水平的影响
将各给药组小鼠禁食过夜(不禁水), 分别于给药前(第0天)、 给药后第7、14、21、28天用三诺血糖仪测定尾静脉血糖值。各给药组与模型对照组小鼠的空腹血糖水平(Fasting blood glucose,FBG)的数据经过T检验分析,比较统计学差异。
1.5.4 对小鼠口服糖耐量的影响
在给药治疗4周后,对小鼠进行口服葡萄糖耐量试验。简言之,将小鼠禁食12 h,然后口服灌胃给予葡萄糖(2.0 g/kg)。在给予葡萄糖后0、30、60、120 min测量血糖值。比较各给药组小鼠在各个时间点的葡萄糖耐量程度,并计算曲线下葡萄糖耐量面积(Area under Curve,AUC)。各组测得数据值与模型组数据进行T检验分析,比较统计学差异。
AUC=0.5×(BG0+BG30)/2+0.5×(BG30+BG60)/2+1×(BG60+BG120)/2
1.5.5 血清胰岛素的测定及胰岛素抵抗指数的计算
小鼠禁食12 h之后,眼球取血,离心后取血清,按照胰岛素酶联免疫吸附试剂盒的操作方法,测空腹血清胰岛素(Fasting serum insulin,FINS)水平,并计算出胰岛素抵抗指数(Homeostasis model assessment-insulin resistance HOMA-IR),公式如下。对各组的胰岛素水平和胰岛素抵抗指数分别与模型组数据进行T检验分析,比较统计学差异。
胰岛素抵抗指数(HOMA-IR)=空腹血糖(FBG)×空腹血清胰岛素(FINS)/22.5
2 结果与讨论
2.1 OJP-MVLs的制备与表征
2.1.1 Box-Behnken响应面设计法优化结果
根据设计的Box-Behnken因素水平表进行实验,结果见表2。表2反映了三油酸甘油酯(TO)与麦冬多糖(OJP)的质量比X1(w/w)、总磷脂和胆固醇的质量比X2(w/w)、吐温80与麦冬多糖(OJP)的质量比X3(w/w)对包封率的影响。结果,包封率的范围为62.89~82.37%,表中最佳处方的组成为三油酸甘油酯含量10 mg,总磷脂和胆固醇的质量比为1.5∶1,吐温80的含量为10 mg。
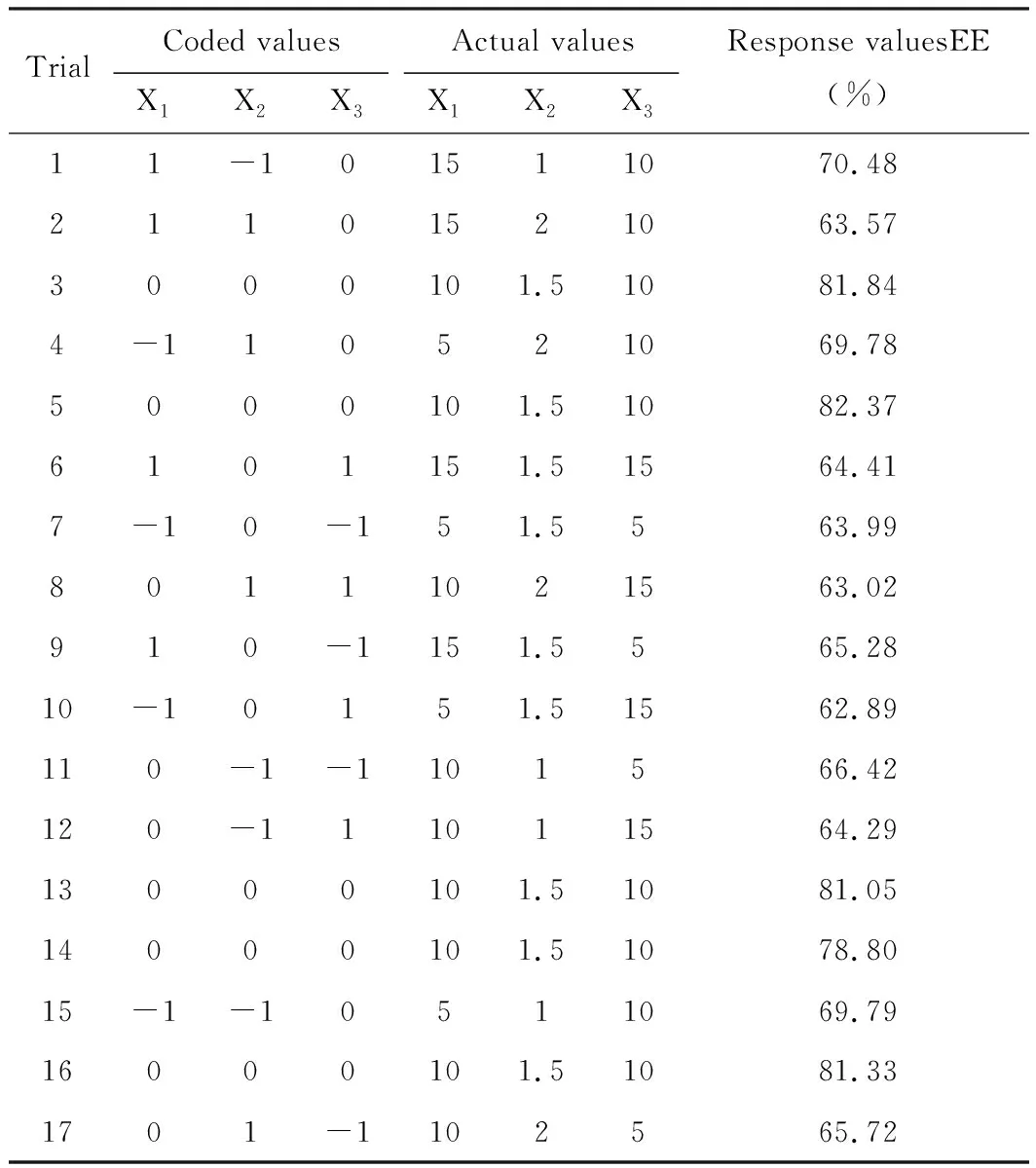
表2 Box-Behnken响应面法的设计试验结果
响应面模型拟合可反映出三个因素与包封率间的关系,其二阶多项式回归方程如下,其中X2前的系数最大,表明总磷脂和胆固醇的质量比是影响包封率的主要因素。
较高的相关系数R2=0.977 8和较低的变异系数CV=2.42%(<3%),并且表3显示失拟项(Lack of Fit)不显著,表明所拟合的模型具有很高的精密度和适用性。
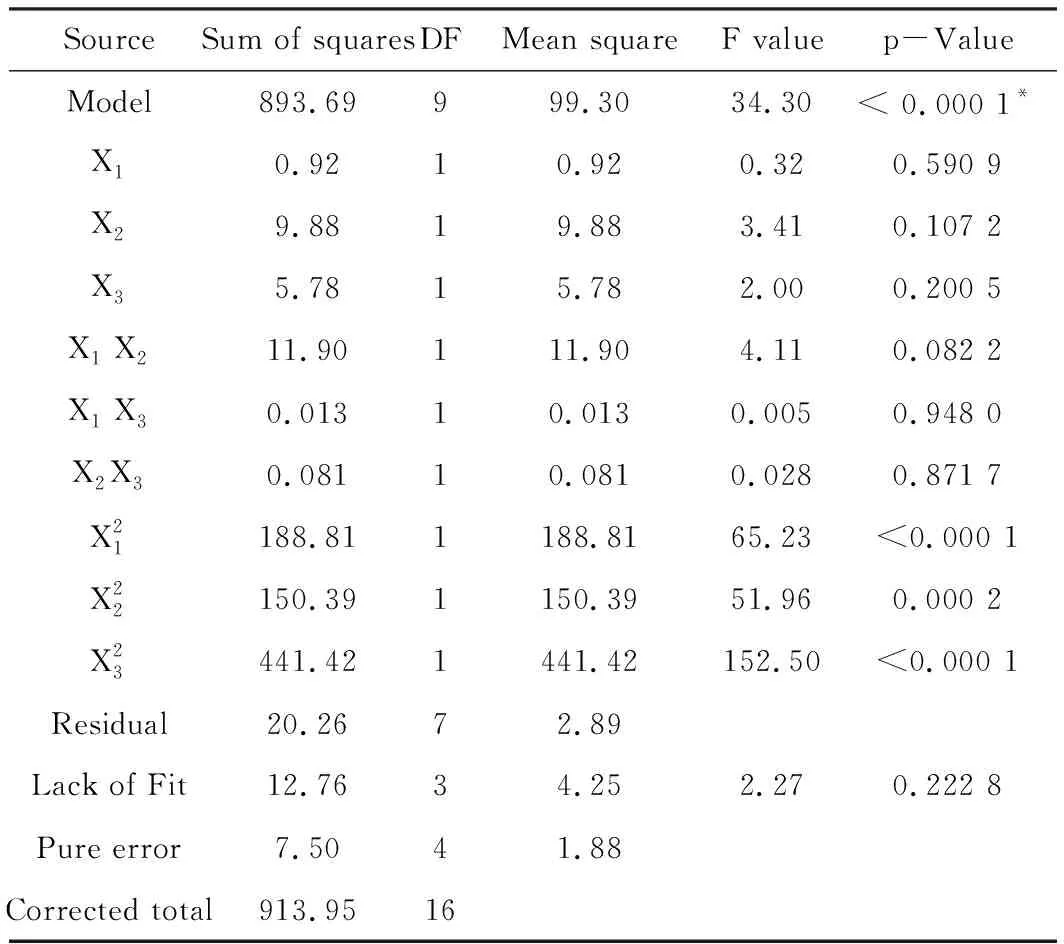
表3 响应面模型的方差分析(95%置信度)
Note: The symbol of*means the term is significant.
三维响应面曲面图可以更直观地反映出不同因素对包封率的交互作用,结果如图1所示。
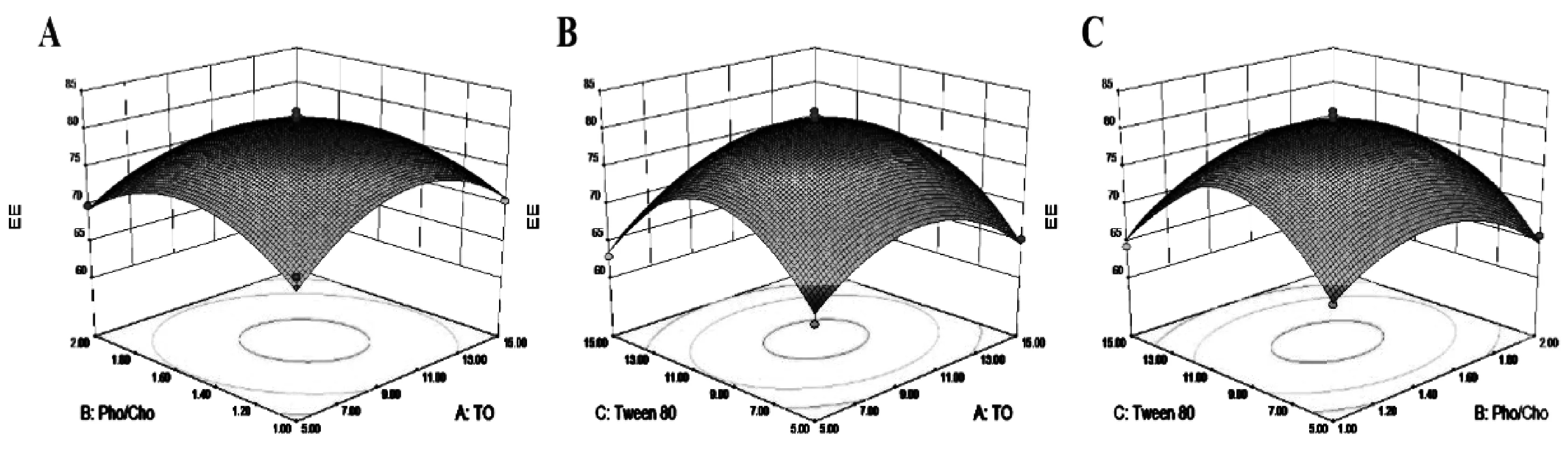
图1 不同独立因素对麦冬多糖多囊脂质体包封率的交互作用
图1中的图A、B、C分别描绘的是X1与X2、X1与X3、X2与X3对OJP-MVLs包封率的交互影响。包封率随着各变量(三油酸甘油酯含量,磷脂与胆固醇质量比,吐温80含量)的增长而增加,到达最大值后逐渐下降。软件的处方优化的结果为:三油酸甘油酯9.93 mg、磷脂与胆固醇质量比为1.46以及吐温80 9.79 mg,包封率的预测结果为81.15%。
响应面法优化后的最佳处方组成为麦冬多糖OJP 24 mg,维生素E 5 mg,DOPC 20 mg,DPPG 4 mg,胆固醇16 mg,三油酸甘油酯10 mg,吐温80 10 mg。按最佳处方制备OJP-MVLs,平行3次验证实验,包封率平均值为(81.24±2.11)%,OJP-MVLs的包封率测定结果与模型预测值之间的偏差小于3%,说明所得到拟合模型可较好地反映出三个因素与包封率间的关系,其预测结果有较高的可信度和准确性。
2.1.2 OJP-MVLs的表征
如图2所示,在光学显微镜下(400×)观察到的多囊脂质体呈圆形,粒度圆整,大小均一,每个多囊脂质体由许多小囊泡堆积而成,多室结构清晰可见。采用激光粒度测定仪测多囊脂质体粒径,粒径分布如图3所示,平均粒径为15.37 μm,粒径分布范围较窄,属正态分布。用Zeta电位分析仪测定多囊脂质体悬液的Zeta电位为(38.38±3.26)mV。结果表明,制备的OJP-MVLs分布均匀,具有较高的Zeta电位绝对值,稳定性良好。

图2 显微镜下OJP-MVLs形态(400×)
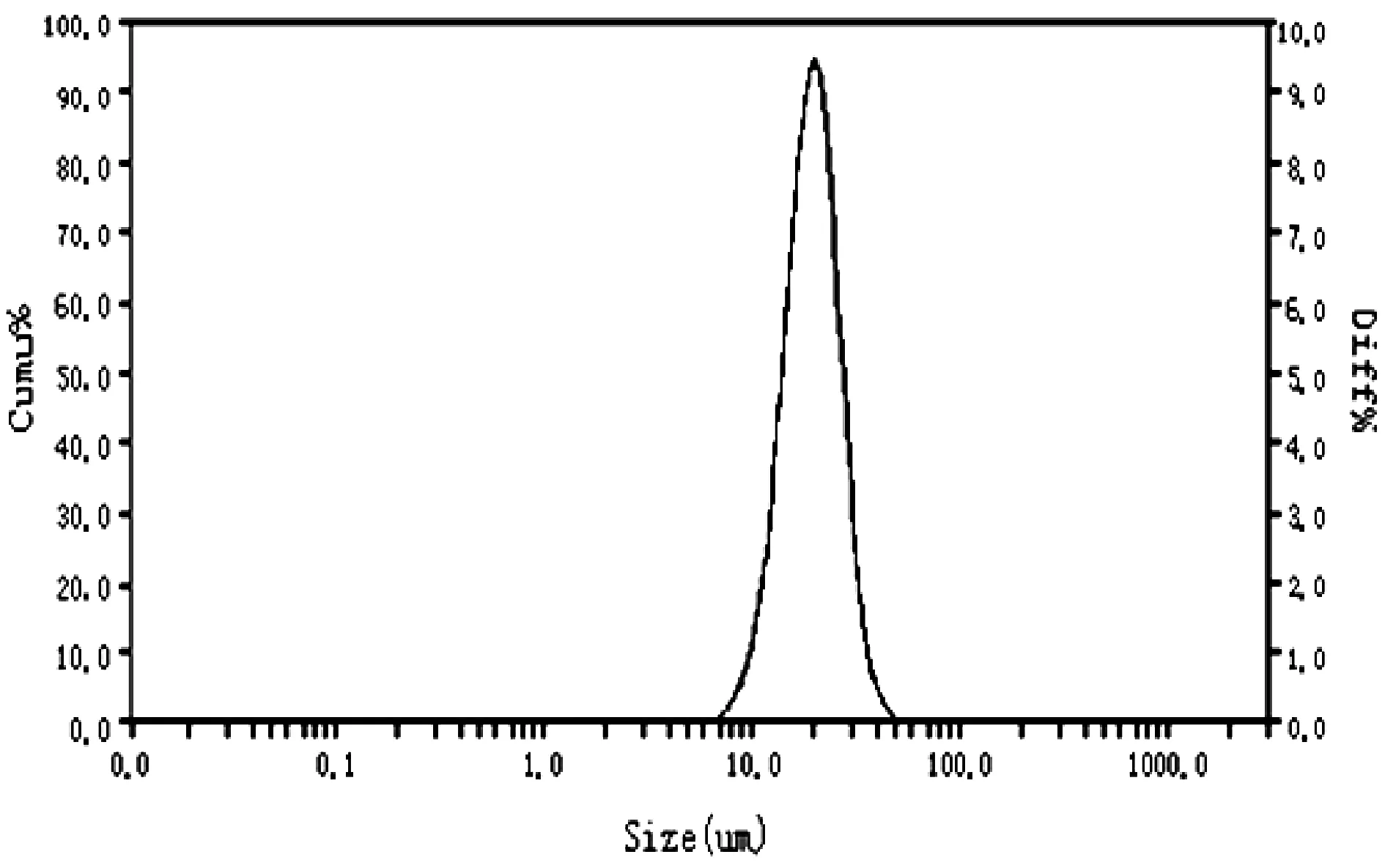
图3 OJP-MVLs粒径分布图
2.1.3 稳定性试验结果
稳定性评价结果如表4所示。结果表明,所制备的多囊脂质体是白色的混悬液,没有絮凝或沉淀产生,随着储存时间的延长,但包封率稍有降低,但不具有显著性,且粒径变化不大说明制备的麦冬多囊脂质体稳定性良好。

表4 4℃下OJP-MVLs稳定性实验结果(Mean,n=3)
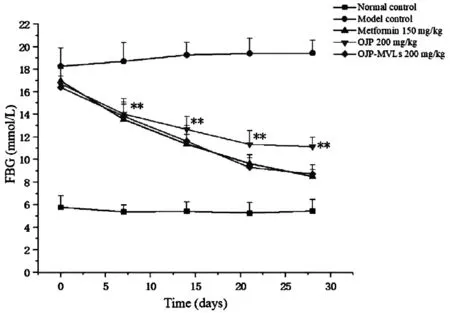
图4 OJP与OJP-MVLs对STZ诱导的 2型糖尿病小鼠空腹血糖的影响Note:**P<0.01 as compared with model control
脂质体的稳定性较差,会发生聚集、沉淀,易氧化水解成过氧化物,使得药物泄露。因此,磷脂的选择对多囊脂质体的稳定性至关重要,DOPC和DPPG的相变温度分别为-22℃和41℃,而普通卵磷脂的相变温度是-15~7℃,易发生相分离,使得膜结构被破坏,药物泄漏。并且DPPG是一种负电荷的磷脂,可提高磷脂双层间的静电斥力从而防止磷脂膜的合并和破坏,增加稳定性。含赖氨酸的外水相,使介质的pH值为偏碱性,使脂质体体系更加稳定。此外在制备过程中除了在油相中加入膜稳定剂,如维生素E,还加入了辅助乳化剂(如吐温80)来稳定复乳。
2.2 抗2型糖尿病活性研究
2.2.1 对小鼠空腹血糖水平的影响
在第0天时,STZ注射给药的小鼠与正常小鼠相比空腹血糖水平显著升高(P<0.01),说明建模成功,模型小鼠具备高血糖的特征。在给药1周后,除了模型组,各给药组2型糖尿病小鼠的FBG水平均出现了明显的降低。给药2周后,OJP-MVLs组能显著降低FBG水平(P<0.01),且与二甲双胍组无统计学差异(P>0.05)。在给药4周时,OJP-MVLs组与二甲双胍组可使2型糖尿病小鼠的FBG降到正常血糖水平,而OJP组FBG水平仍高于正常血糖水平,说明麦冬多糖多囊脂质体对于降低2型糖尿病小鼠的FBG水平比原料药有着更好的效果。
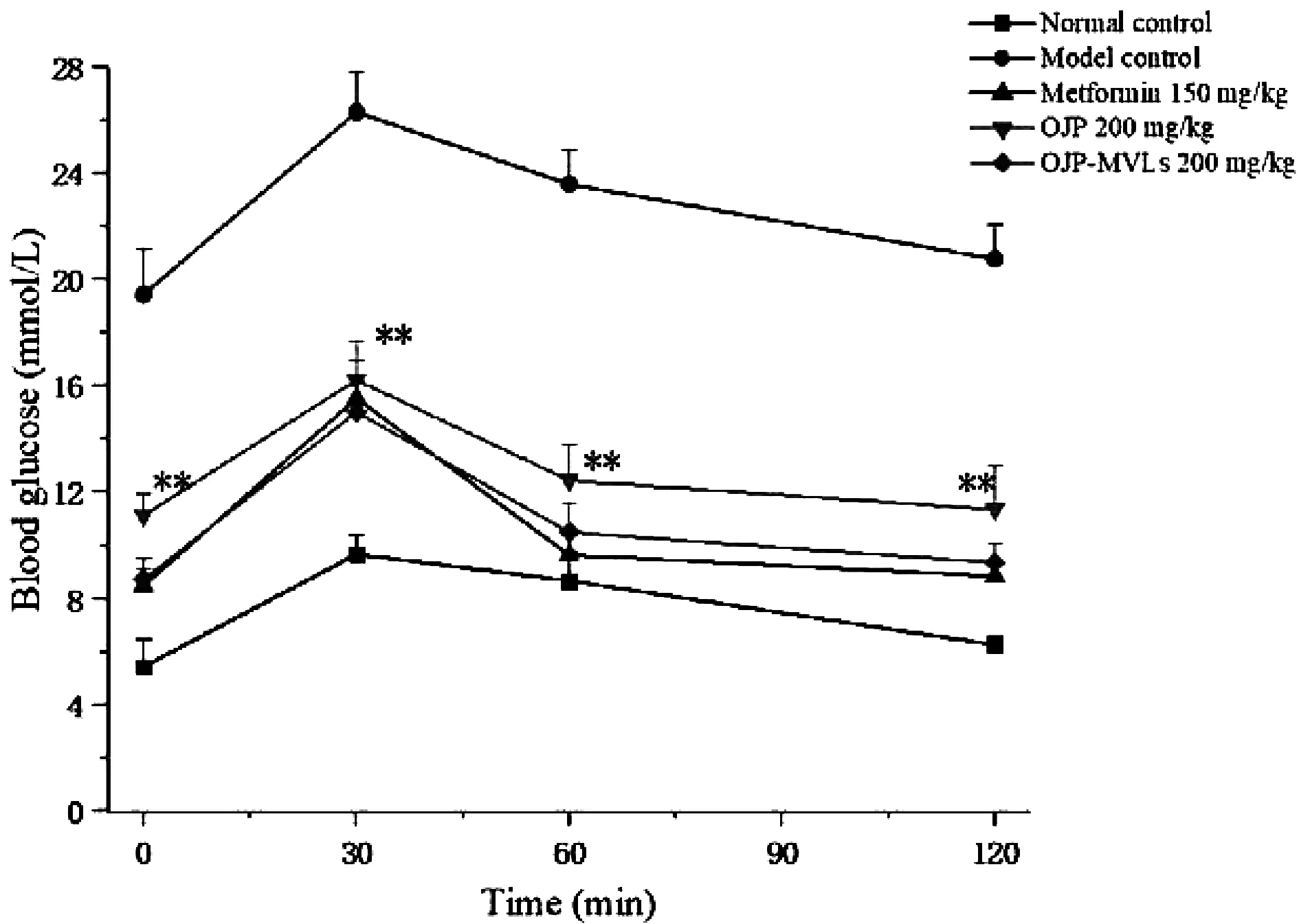
图5 OJP与OJP-MVLs对STZ诱导的2型 糖尿病小鼠糖耐量的影响Note:**P<0.01 as compared with model control
2.2.2 对小鼠口服糖耐量的影响
各给药组小鼠的OGTT实验结果见表5和图5。在给予葡萄糖后,所有小鼠的血糖呈现出上升的趋势,1 h之后,所有小鼠血糖水平都开始不同程度的下降,OJP-MVLs组与二甲双胍组血糖水平下降的程度明显高于OJP组。在给予葡萄糖120 min时,OJP-MVLs组血糖能恢复至正常血糖水平,且与二甲双胍组OGTT无统计学差异(P>0.05),其改善OGTT的效果要明显优于麦冬多糖OJP。比较血糖浓度曲线下面积(AUC),OJP-MVLs组的AUC值是最接近于二甲双胍作用效果的。通过对各时间点的血糖值和AUC值分析,OJP-MVLs对2型糖尿病小鼠的糖耐量具有更加明显的改善作用。

表5 OJP和OJP-MVLs对口服糖耐量的作用
Note:**P<0.01 versus Model control
2.2.3 血清胰岛素的测定及胰岛素抵抗指数的计算
如表6所示,模型对照组的空腹血清胰岛素(FINS)和胰岛素抵抗指数(HOMA-IR)水平均显著增高(P<0.01),说明了STZ诱导的2型糖尿病小鼠模型具备了高胰岛素血症和胰岛素抵抗的特征,证明该造模是成功的。给药4周后,与模型组相比,OJP和OJP-MVLs组都能显著的降低2型糖尿病小鼠的FINS(P<0.01)。并且各给药组小鼠的胰岛素抵抗指数HOMA-IR也显著的降低(P<0.01)。多囊脂质体组的FINS与HOMA-IR要明显优于原料药OJP组,并且OJP-MVLs组与阳性药二甲双胍的效果相当,证明麦冬多糖多囊脂质体能更好地增加2型糖尿病小鼠对胰岛素的敏感性,改善其胰岛素抵抗的症状。
表6 OJP和OJP-MVLs对2型糖尿病小鼠空腹血清胰岛素 水平(FINS)和胰岛素抵抗指数(HOMA-IR)的影响
Note:**P<0.01 versus Model control
3 结论
本研究以复乳法制备麦冬多糖多囊脂质体,Box-Behnken响应面设计法优化处方,优选的处方为麦冬多糖(OJP)24 mg,维生素E 5 mg,DOPC 20 mg,DPPG 4 mg,胆固醇16 mg,三油酸甘油酯10 mg,吐温80 10 mg,制得的麦冬多糖多囊脂质体包封率高(81.24±2.11)%。对麦冬多糖多囊脂质体进行了体外表征,结果表明,制备的多囊脂质体呈圆形,粒度圆整,大小均一,每个多囊脂质体由许多小囊泡堆积而成,多室结构清晰可见。平均粒径为15.37 μm,粒径分布范围较窄,Zeta电位为(38.38±3.26)mV。麦冬多糖多囊脂质体的稳定性良好,在15天内未出现明显的絮凝或沉淀现象,包封率与粒径均无明显变化。
对麦冬多糖及其多囊脂质体治疗2型糖尿病的效果进行研究,麦冬多囊脂质体(OJP-MVLs)能显著降低2型糖尿病小鼠的FBG水平(P<0.01),改善口服糖耐量(P<0.01)和胰岛素抵抗的症状(P<0.01),且效果优于麦冬多糖(OJP)。结果表明,多囊脂质体能增强麦冬多糖治疗2型糖尿病的效果,为抗2型糖尿病的天然多糖及其制剂的开发研究提供了新思路与新载体。
