温湿度对不同管理方式高寒草甸土壤氮 矿化的影响
2018-09-18周古月武山梅刘颖慧
杜 薇,孙 楠,周古月,武山梅,聂 成, 李 悦,刘颖慧
(1.北京师范大学 地理科学学部地表过程与资源生态国家重点实验室,北京 100875; 2.中国农业科学院农业资源与农业区划研究所/耕地培育技术国家工程实验室,北京 100081)
氮素是限制植物生长和产量形成的主要因素,进而影响草地生态系统的生产力高低[1]。有机氮只有经微生物分解转化之后,才能成为可被植物吸收利用的无机氮,从而影响植物的生长及生态系统的生产力,这一过程就称为土壤氮矿化[2]。土壤中有机氮占全氮比例一般在90%[3],因此,土壤氮矿化过程决定了土壤中可利用氮素的含量,是土壤氮循环过程的核心,矿化量与全氮含量及可矿化部分有关,通过矿化能力的测定可了解土壤供氮能力[4]。
土壤氮矿化过程受到诸多因素的影响,包括土壤理化性质、环境因素、生物因素、人为活动等[3,5]。温度和湿度是影响土壤氮矿化的两个环境因素[6],大量研究结果表明温湿度单因素均影响土壤氮矿化过程[7-9],且两者之间具有显著的交互作用[10-13],对不同地区的土壤需进行特定的研究,才能明确各地区土壤氮矿化对温度、湿度及其交互作用的响应。草地生态系统是陆地生态系统的主要类型,具有调节气候、固碳储氮等生态功能[14],放牧是草原最主要的利用方式,改变了土壤的生物和理化性质,从而影响土壤氮矿化过程[15]。由于放牧强度划分标准不一,且放牧对土壤氮矿化的作用还受到水热条件、植物群落、土壤性质等影响,各地区不同放牧强度下土壤氮矿化的研究结果差异较大[16-17]。
青藏高原被称为世界第三级,其环境对全球气候变化的响应十分敏感,该区草地面积1.6×106km2,占总土地面积的63.9%[18]。近50年,青藏高原的年均温度与降水量均呈上升趋势,温度升高幅度为0.53℃/(10 a),降水量增加幅度7.81 mm/(10 a)[19],暖湿化趋势将会影响土壤氮矿化过程。那曲地区位于青藏高原腹地,是西藏自治区的主要放牧区之一,人类过于频繁的经济活动加上自然气候的变化,令该地区的高寒草地土壤退化严重[20],土壤氮矿化过程受到一定影响。
在那曲地区高寒草甸的禁牧样地与放牧样地进行土壤取样,采用室内非原状土培养的方法,设置不同温湿度梯度,通过对土壤氮矿化量、土壤净氮矿化速率结果的分析,阐述土壤氮矿化的动态过程,探讨2种放牧方式下温度湿度对土壤氮矿化的影响,通过土壤氮矿化速率温度敏感性在不同放牧方式和湿度条件下的变化规律来揭示氮矿化对温度变化的响应趋势。其结果将提高对那曲地区高寒草甸氮素转化的认识,有利于了解人类活动对该地区土壤氮矿化产生的影响,并为预测气候变化对土壤氮矿化的影响提供参考。
1 材料和方法
1.1 研究区概况
研究区域位于西藏自治区北部那曲地区、唐古拉山和念青唐古拉山之间的那曲县(N 30°31′~31°55′,E 91°12′~93°03′)。那曲县属高原亚寒带季风半湿润气候区,海拔4 450 m,土地总面积1.62万km2,其中,草原面积1.25万km2,占那曲县土地总面积的77.2%。年温差小,昼夜温差大,气候干燥,年均气温为-1.2℃,年平均降水量432.8 mm,年内降水主要分布在6~9月,年蒸发量1 811.2 mm[21]。土壤类型主要有高山草甸土、高山草原土以及沼泽草甸土、盐土等,植被优势种有高山嵩草(Kobresiapygmaea)、紫花针茅(Stipapurpurea)、藏北嵩草(Kobresialittledalei)等[22]。
1.2 样地设置与样品采集
试验样地位于那曲县(N 31.44°,E 92.02°)自由放牧草地,属于中度退化草地,土壤质地为轻壤土[23]。将两种不同管理方式的草地作为试验样点,分别是轻度自由放牧草地(2头牦牛/hm2)和自2006年起禁牧草地。2011年样地植被调查数据中,放牧草地矮生嵩草(Kobresiahumilis)、二裂委陵菜(Potentillabifurca)、高原毛茛(Ranunculustangutica)的重要值偏高,禁牧草地早熟禾(Poaannua)、矮生嵩草、青藏苔草(Carexmoorcroftii)的重要值偏高[24]。
2014年8月,在放牧草地和禁牧草地中,各选取4个样地设置为重复,共计8个样地。在每个样地内随机选取5个点,去除地表凋落物后,用5 cm直径的土钻对0~15 cm的土壤进行取样。土壤样品在室内混匀过2 mm筛,以去除根系、杂质、石块等。取出部分土样测定土壤理化性质(表1),其余部分于-18℃下保存,以备室内培养使用。

表1 研究区土壤理化性质
注:同列不同大写字母表示差异显著(P<0.005)
1.3 室内培养方案
那曲县2014年生长季(6~8月)的5 cm土壤平均温度为12.35℃,平均土壤体积含水量为20%[25],根据未来气候的暖湿化趋势[21,26-27],试验设5℃、10℃、15℃、20℃、25℃ 5个温度梯度,2个湿度梯度:40%、60%土壤饱和含水量,简写为40%SSM,60%SSM。试验共设10个处理,每个处理3组重复,每组重复设置3个培养样品用于分次破坏性取样,共计培养180个土样。
用烘干法和浸水法测定土壤的质量含水率和饱和含水率后,称取60 g干土放入250 mL的锥形瓶中,加水将土壤样品分别调节至相应湿度后用封口膜封口,然后将土壤样品分别放入5个设定温度的恒温培养箱中进行室内培养,共计培养41 d。培养期间为保持培养箱中O2充足,每周开放培养箱通风30 min,为保持土壤湿度恒定,每隔5~15 d对土样称重以补充蒸发水分。
土样放入培养箱稳定8 d后视为室内培养第1 d,土壤样品分3次取样,分别是在室内培养第1 d,第15 d和34 d,将前7 d稳定阶段视为培养初始,1~15 d视为培养前期,15~34 d视为培养后期。把3次取出的180个土壤样品都放入-18℃条件下冷冻保存,以待后期一并测定土壤可溶性有机碳、微生物生物量碳、铵态氮、硝态氮等指标。
1.4 指标测定
采用干烧法(元素分析仪)测定土壤全碳和全氮含量[28-29],微波消解法测定土壤全磷含量[30],重铬酸钾~硫酸外加热容量法测定土壤可溶性有机碳含量[31],氯仿熏蒸法测定土壤微生物生物量碳含量[32]。土壤用40 mL 0.5 moL/L的K2SO4溶液浸提,浸提液经振荡、离心、过滤后,用连续流动分析仪测定土壤浸提液中的铵态氮与硝态氮含量[33-34]。
1.5 数据计算和分析
将土壤中铵态氮与硝态氮含量之和视为无机氮含量,土壤氨化速率、硝化速率、净氮矿化速率分别通过一定时间间隔的铵态氮、硝态氮、无机氮含量的差值来计算[35]:
A=Aamm+Anit
(1)
Namm=ΔAamm/Δt
(2)
Nnit=ΔAnit/Δt
(3)
N=ΔA/Δt
(4)
式中:A、Aamm、Anit分别为土壤氮矿化量、铵态氮含量、硝态氮含量,N、Namm、Nnit分别为土壤净氮矿化速率、氨化速率、硝化速率,ΔA、ΔAamm、ΔAnit分别为一段培养时间土壤氮矿化量、铵态氮含量、硝态氮含量的差值,Δt为培养时间间隔。
土壤净氮矿化速率与温度之间的关系用指数模型拟合[36]:
f(T)=A×eB×T
(5)
式中:A为基质质量指数,B为温度反应系数,T为培养温度(℃)
由指数模型可以得出B值,土壤氮矿化的温度敏感性Q10,表示的是温度每增加10℃土壤净氮矿化速率增加的倍数,通过公式计算:
Q10=e10×B
(6)
为了模拟分析温度和湿度对土壤氮矿化速率的影响,研究选取了4种形式的土壤氮矿化速率温湿度响应模型对试验数据进行了拟合(表2)[37-41],并通过比较选出最适模型。

表2 土壤氮矿化速率温湿度响应模型
注:N为土壤氮矿化速率,T为土壤温度,M为土壤湿度,a~f为参数
1.6 统计方法
使用SPSS 20.0对数据进行统计分析,使用Sigma Plot 12.5进行图形绘制。对土壤净氮矿化速率与温度、湿度之间的关系进行Pearson相关性分析;使用One-WayANOVA分析温度、湿度单因素对土壤净氮矿化速率的影响,土壤净氮矿化速率值方差齐性时使用LSD检验其在温度梯度之间的差异显著性,方差不齐时使用Dunnett-T3检验差异显著性,研究中检验的显著水平设置为P=0.05;使用Two-Way ANOVA分析温度和湿度对氨化、硝化、矿化速率的交互作用;使用非线性回归分析模拟土壤净氮矿化速率与温度、湿度之间的关系。
2 结果与分析
2.1 土壤养分动态变化
培养期间,禁牧样地的土壤可溶性有机碳、微生物生物量碳含量小于放牧样地。随着培养时间的变化,两种管理方式下的可溶性有机碳含量减小,微生物生物量碳含量不断增加(表3)。
研究中土壤氮矿化量是铵态氮与硝态氮之和,从整体数值来看,无机氮的主要组成部分是硝态氮,与其他研究结果相符[42-43],不同培养阶段,硝态氮在无机氮中的比例分别为80.2%,94.5%和95.9%。培养期间,禁牧样地的铵态氮含量大于放牧样地,硝态氮含量小于放牧样地。禁牧样地的土壤铵态氮含量显著减少(P<0.05),培养前期减幅更大,硝态氮含量显著增加(P<0.05)放牧样地土壤铵态氮含量总体增加(P<0.05),硝态氮含量累积增加(P<0.05)(表3)。

表3 不同管理方式土壤养分动态变化
注:1.DOC、MBC、NH4+-N、NO3--N分别代表土壤可溶性有机碳、微生物生物量碳、铵态氮、硝态氮等指标;2.不同大写字母表示相同培养阶段下2个样地之间差异显著(P<0.05),不同小写字母表示相同管理方式下不同培养阶段之间差异显著(P<0.05)
2.2 温度、湿度对土壤氮矿化量的影响
禁牧条件下,在整个培养阶段,土壤氮矿化量都与温度呈显著正相关(P<0.01),在不同温度之间差异显著(P<0.01)。放牧条件下,土壤氮矿化量的均值与温度显著正相关(P<0.01),在不同温度之间差异显著(P=0.05),不同阶段土壤初始氮矿化量和前期矿化量与温度的正相关关系不显著,总矿化量与温度显著正相关(P<0.01),且不同温度之间差异显著(P<0.01)。随着培养时间的变化,两种管理方式下的土壤氮矿化量随温度升高而增加的趋势更明显,即温度对土壤氮矿化量的影响增强(表4)。
禁牧条件下,土壤氮矿化量与湿度呈较弱正相关,只有初始矿化量与湿度显著正相关(P<0.01),且初始矿化量在2个湿度之间差异显著(P<0.01),60%SSM的初始矿化量更高,培养前期氮矿化量及总氮矿化量与湿度的正相关关系均不显著。放牧条件下,土壤氮矿化量与湿度呈显著负相关(P<0.01),整个培养阶段,土壤氮矿化量在两个湿度间差异显著(P<0.01),40%SSM的土壤氮矿化量更高,随培养时间变化,湿度对土壤氮矿化量的影响均减弱(图1)。

表4 土壤氮矿化量与温度、湿度的Pearson相关系数
注:*表示在0.05水平上显著相关,**表示在0.01水平上显著相关

图1 不同温湿度土壤净氮矿化量对比Fig.1 Soil mineral N production under different temperature and moisture conditions 注:JM、FM分别代表禁牧和放牧,40%、60%分别代表40%SSM和60%SSM
2.3 温度、湿度对土壤净氮矿化速率的影响
禁牧条件下,土壤净氮矿化速率的均值随着温度的升高而增加(图2)。在整个培养期间两者均呈显著正相关关系(P<0.01),且不同温度间差异显著(P<0.01)(表5)。培养前期土壤净氮矿化速率随温度升高呈指数型增长,相邻温度梯度间变化幅度分别为6.7%、78.1%、59.6%、95.6%,高温条件下增幅更大。培养后期呈线性增长,相邻温度梯度间变化幅度分别为83.9%、75.4%、21.5%、34.5%,与前期相反,低温条件下增幅更大。
放牧条件下,土壤净氮矿化速率在培养前期与温度呈较弱正相关(表5),40%SSM时,土壤净氮矿化速率随温度升高呈V字型变化,与温度呈显著正相关(P<0.01);60%SSM时,随温度升高呈M型变化,与温度的相关关系不显著,不同温度间差异也不显著(P>0.05)。培养后期土壤净氮矿化速率与温度呈显著正相关(P<0.01),不同温度间差异显著(P<0.01),5℃时净氮矿化速率为负值,显著低于其他温度下的净氮矿化速率(P<0.01)。40%SSM时土壤净氮矿化速率随温度升高而增加,60%SSM时随温度升高呈现N字型的变化规律,25℃的净氮矿化速率值显著高于其他温度(图2)。
在2个培养阶段,不同放牧条件下,土壤净氮矿化速率与湿度的相关关系较弱(表5),只有在禁牧前期5℃条件下2个湿度间差异显著,其余条件下2个湿度之间差异均不显著。培养前期,禁牧条件下,5~15℃ 60%SSM土壤净氮矿化速率更大,放牧条件下,5~20℃,60%SSM速率更大,温度升高时较低含水率更利于土壤氮矿化。培养后期,土壤净氮矿化速率在2个湿度间差异较小(图2)。

图2 不同温湿度土壤净氮矿化速率对比Fig.2 Soil Net N mineralization rate under different temperature and moisture conditions 注:1.A、B、C、D分别代表禁牧条件培养前期、禁牧后期、放牧前期、放牧后期; 2.不同大写字母表示湿度之间差异显著(P<0.05),不同小写字母表示温度之间差异显著(P<0.05)
温度对氨化、硝化与矿化速率均有显著影响(P<0.01),湿度只对氨化速率有显著影响(P<0.01),温度和湿度只对氨化速率有显著交互作用(P<0.05)。从不同的放牧方式与培养阶段分析,温度对禁牧条件下的氨化、硝化与矿化速率都有显著影响(P<0.01),对放牧后期的硝化与矿化速率影响显著(P<0.01),湿度对禁牧条件前期的氨化速率与硝化速率有显著影响(P<0.01),温度和湿度对禁牧条件前 期的氨化速率与矿化速率有显著的交互作用(P<0.05)(表6)。
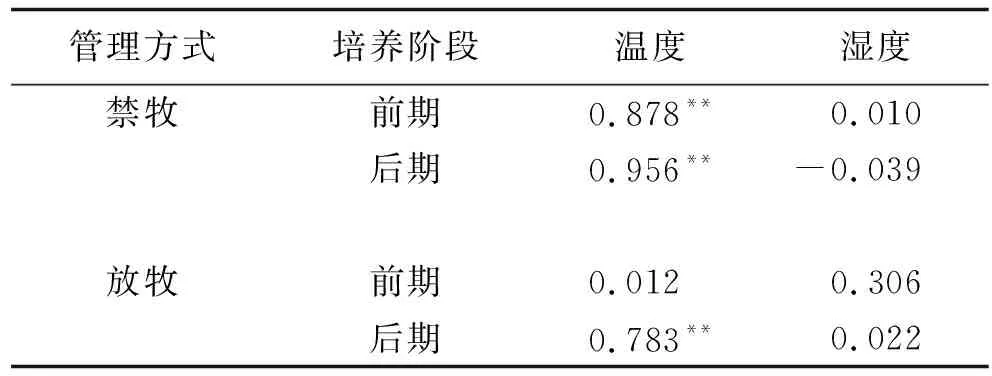
表5 土壤净氮矿化速率与温度、湿度的 Pearson相关系数
注:**表示在0.01水平上显著相关
模型拟合显示,禁牧条件培养前期的拟合优度(R2)在80.4%~94.6%,禁牧后期R2在89.0%~91.7%,放牧前期R2在9.8%~19.0%,放牧后期R2在53.5%~64.9%。说明禁牧条件下比在放牧条件下温度和湿度能更大程度的解释土壤氮矿化速率的变异,禁牧条件下2个时期R2相近,放牧条件下培养后期R2均大于培养前期。赤池信息量准则(AIC)越小,表示模型的简洁性与精确度越高,通过4种模型AIC值的比较,禁牧条件培养前期温度和湿度对土壤氮矿化速率的影响用模型2拟合更佳,培养后期用模型1拟合更佳;放牧条件下2个时期温度和湿度对土壤氮矿化速率的影响均用模型1拟合更佳(表7)。
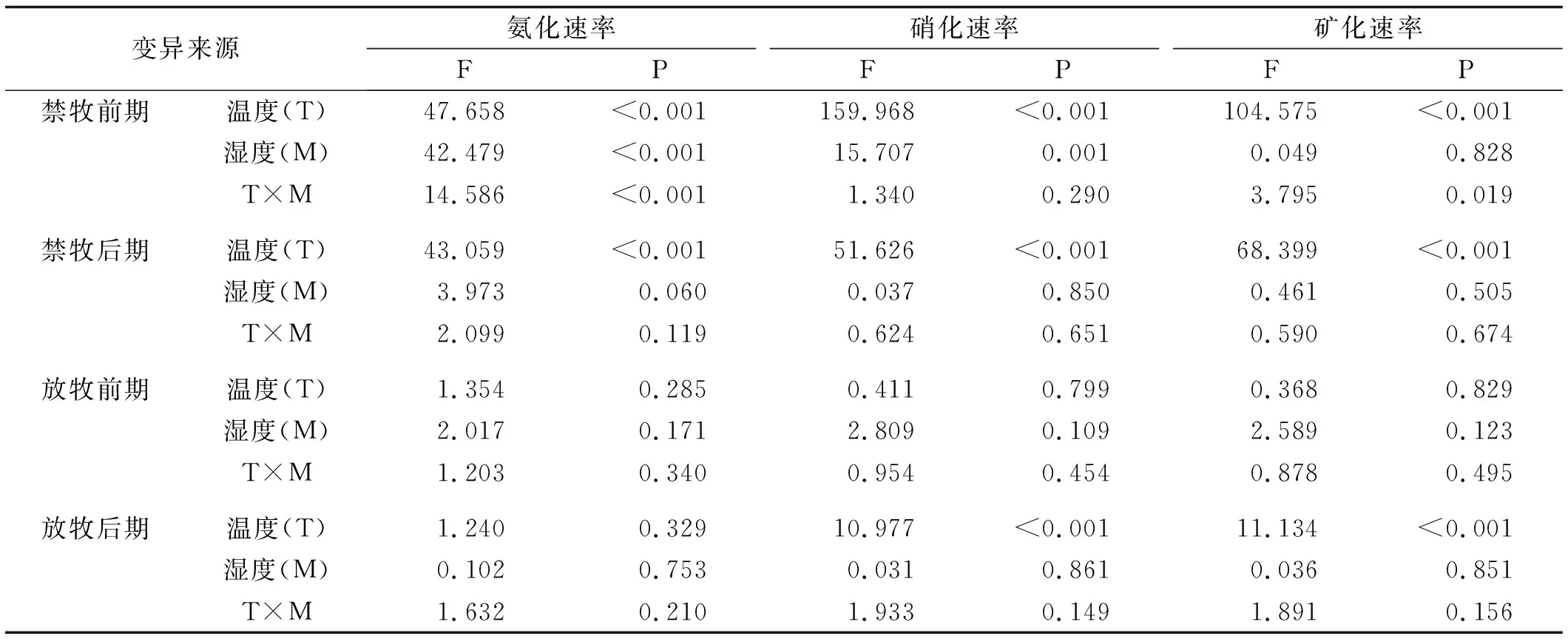
表6 氨化速率、硝化速率、净氮矿化速率的双因素方差分析
2.4 土壤氮矿化速率的温度敏感性
不同管理方式的样地以及不同湿度与培养阶段下,5~25℃的温度区间内,Q10值在0.88~3.85变化,平均值为2.12。放牧样地培养前期60%SSM的土壤氮矿化速率对温度没有较好的响应,故用此指数模型的拟合优度较低;放牧样地培养后期土壤净氮矿化速率在低温条件下出现负值,所以无法用指数模型进行拟合。在两个不同湿度条件下,土壤氮矿化温度敏感性Q10值均是放牧条件小于禁牧条件。相同管理方式下,40%SSM的Q10值在培养前期大于60%SSM,后期两者数值接近。土壤氮矿化温度敏感性(Q10)在禁牧样地培养前期40%SSM时最高(表8)。

表7 土壤氮矿化速率与温湿度的模型拟合
注:R2为模型拟合优度,AIC为赤池信息量准则

表8 土壤净氮矿化速率的指数模型参数
注:A为基质质量指数,B为温度反应系数,R2为指数模型拟合优度,Q10为土壤氮矿化温度敏感性
2.5 放牧对土壤氮矿化的影响
培养前期温度较低和培养后期温度较高时,放牧样地土壤净氮矿化速率高于禁牧样地,其余则是禁牧样地矿化速率更高,且在不同湿度间表现有差异。在整个培养阶段,只有氨化速率在两种放牧方式下有显著差异(P<0.001),禁牧样地的氨化速率小于放牧样地。培养前期,禁牧样地的硝化速率大于放牧样地,净氮矿化速率小于放牧样地,培养后期,禁牧样地的硝化速率与净氮矿化速率均大于放牧样地,硝化速率和净氮矿化速率在两个样地间差异均不显著(图3)。

图3 2种放牧方式下土壤氮矿化对比Fig.3 Soil ammonification,nitrification and net N mineralization rate under two grazing styles 注:1.A、B代表培养前期和培养后期,JM、FM代表禁牧和放牧; 2.不同小写字母表示样地之间差异显著(P<0.05)
3 讨论
3.1 温湿度对土壤氮矿化的影响
温度和湿度是影响土壤氮矿化最主要的环境因子,温度的作用强于湿度,两者具有显著交互作用[6]。试验中土壤净氮矿化速率只在放牧样地的培养前期与温度没有显著的相关关系,在其他培养方式与培养阶段下都是在5~25℃随着温度的升高而显著增加,25℃时速率最高。温度主要是通过改变土壤微生物的群落组成和数量多少来影响氮矿化过程[7],温度过低时,微生物膜的流动性降低,丧失生物学功能,温度过高超过了微生物耐受范围时,细胞内关键组分变性失活,进而导致细胞功能的破坏[44]。前人研究报道,土壤净氮矿化速率既有随温度升高不断增加[8,39,45],也有随温度升高先增加后减少[40],表明微生物的活性存在最适温度。Wang C等[46]对北方温带草原的研究表明,-10~35℃范围内,25℃是微生物活性的最适温度;石薇等[47]对华西雨屏区柳杉人工林表层土壤的研究表明,5~35℃范围内土壤氮矿化最适温度为32.9℃;王帘里等[48]对东部黑土、潮土和红壤的研究表明,在15~30℃土壤氮矿化最适温度为20~25℃。不同研究得到的土壤氮矿化最适温度不同,是由于不同地区土壤的微生物群落结构有差异[49]。在此次试验的温度设定范围内(5~25℃),土壤氮矿化最适温度为25℃。
放牧样地的土壤净氮矿化速率在培养前期与温度相关性较弱,在培养后期呈显著正相关(表3),可能是由于培养后期土壤底物减少[50],高温时微生物活性较高,在底物较少的条件下会加快矿化进程使氮矿化速率增加,温度对氮矿化的影响显著,放牧后期土壤氮矿化温湿度响应模型的拟合效果比前期好。
湿度对土壤氮矿化也有重要的影响。湿度过高时,土壤中孔隙被水充满,氧气含量较低,利于厌氧菌活动,反硝化作用增强[12],湿度过低时,土壤内部溶剂流动性不强,酶和底物的移动扩散不佳[51]。土壤净氮矿化速率与湿度的相关关系较弱,2个湿度之间差异不显著,温度与湿度没有明显的交互作用。而试验的2个湿度梯度是根据当地土壤实际含水量及未来降水增多的趋势设置的,说明在未来气候趋于暖湿化的情景下,土壤氮矿化对湿度变化的响应不显著。
3.2 放牧对土壤氮矿化的影响
不同管理方式下的土壤对温湿度的响应明显不同,如土壤氮矿化量在禁牧条件下与湿度呈较弱正相关,在放牧条件下则呈显著负相关。而禁牧样地与放牧样地的土壤净氮矿化速率只有在5℃时有显著差异,其余培养条件下差异不显著,由于放牧对氮矿化的作用机制较为复杂。如动物对植物的的啃食作用可能会刺激根系分泌增多,导致根际微生物活性变高,增强氮矿化作用[52];也可能会对植物地上部分造成损害,使植物生长不良,对土壤中无机氮吸收减少,导致铵态氮积累,硝化作用增强[53]。动物的践踏会压实土壤,减小土壤孔隙度,给反硝化细菌提供良好的厌氧环境,从而增强反硝化作用[54]。动物将粪便排泄至草地上,使土壤基质变好,可为微生物提供更多能量,与氮素循环相关微生物的数量增加、活性增强[55],从而加快氮矿化进程。
有关放牧对土壤氮矿化影响的研究结果之间差异较大,既有报道放牧对土壤氮矿化起到促进作用[16],也有报道放牧对土壤氮矿化有抑制作用[17],不同的研究得出土壤净氮矿化速率的最高值出现在各个不同的放牧强度之下[16-17,52,56-57]。可能是由于不同地区的土壤本身具有空间上的异质性,而且各结果对于放牧强弱的界定都是将各自试验设定的放牧强度进行相对比较,进行等级划分,且氮矿化测定方法与表征方式也具有多样性,无法直接进行各研究之间的横向对比。
3.3 土壤氮矿化速率温度敏感性的比较
研究中不同管理方式与湿度下的土壤氮矿化Q10值在0.88~3.85变化,平均值为2.12,与其他研究结论基本相符,如吴建国等[58]研究表明祁连山中部高寒草甸土壤氮矿化速率的Q10值在1.2~2.2,Liu Y等[59]利用多篇发表论文数据计算得出草原生态系统Q10的平均值为1.8。Q10值表示的是不同土壤氮矿化温度敏感性的高低,可反映全球变暖对氮矿化的影响[46]。中放牧样地的Q10值小于禁牧样地,基质质量指数A大于禁牧样地,Q10和A呈显著负相关。培养期间,禁牧样地的土壤可溶性有机碳、微生物生物量碳等土壤活性有机质的含量则小于放牧样地(表3)。相比于禁牧样地,放牧样地土壤基质更好,可能是动物的活动刺激植物根系分泌增加并把植物残体带到土壤中[60],还将粪便排泄至草地上,使土壤孔径分布和团粒结构等得到改善,土壤中易于利用的有机质含量增加[54]。土壤氮矿化是以微生物反应为主导、需要耗能的过程,活化能与基质质量呈显著负相关关系,即基质质量更差的土壤需要较高的活化能,而Q10随着活化能的增加而增加,因此,放牧样地基质质量好,温度敏感性低。有研究报道,土壤全氮含量与土壤氮矿化速率Q10显著正相关,可以解释其56%的变异,与土壤有机质含量共同通过调节微生物的底物供应来影响Q10[59],放牧样地的土壤全氮含量显著低于禁牧条件,与其他一些研究结果相似[61],全氮含量的差异也导致了放牧样地温度敏感性较低。
4 结论
全球气候变化及日益频繁的人类活动势必会影响土壤氮矿化这一重要的氮素循环过程,青藏高原地区的环境对气候变化的响应又十分敏感,试验选择那曲地区高寒草甸的禁牧样地与放牧样地,利用室内培养试验,探讨温度、湿度、放牧对土壤氮矿化的影响,主要结论如下:
(1)那曲地区高寒草甸土壤无机氮的主要组成部分是硝态氮。土壤氮矿化量与温度呈显著正相关,与湿度在禁牧条件下呈较弱正相关,放牧条件下呈显著负相关。土壤净氮矿化速率与温度呈显著正相关,与湿度相关性较弱。温度与湿度在禁牧培养前期对土壤净氮矿化速率有显著交互作用,此条件下的最适温湿度响应模型为N=-14.905-0.011T+62.247M+0.005T2-60.02M2-0.145TM。那曲地区的气候变化规律是渐趋于暖湿化,升温将会加快土壤氮矿化过程,短期内增加土壤中无机氮含量,湿度对土壤氮矿化的影响作用不显著。
(2)通过指数模型的拟合,放牧样地的土壤基质好于禁牧样地,温度敏感性则较低,且2种放牧方式下的样地土壤净氮矿化速率无显著差异。因此,对于那曲地区高寒草甸,适度放牧是较合理的土地利用方式,既有利于充分利用草地资源,又能较好地应对全球气候变化的影响。
