掺杂氧化物对V2O5-P2O5-Bi2O3系玻璃的性能影响
2018-09-17祁攀虎屈银虎成小乐时晶晶周宗团
祁攀虎,屈银虎,成小乐,王 翔,时晶晶,周宗团
(西安工程大学 材料工程学院,陕西 西安 710048)
0 引 言
随着电子信息行业的迅速发展,目前国内电子浆料作为基础材料发挥着越来越重要的角色,研究新型的高性能、低成本电子浆料已成为当今社会发展的必然趋势[1-2].电子浆料产品作为一种电子功能材料,主要是由三部分组成,包括粘结相、有机载体以及导电相.作为电子浆料中的粘结相,玻璃粉一直扮演着重要角色[3].其中玻璃相起着粘结剂的作用.
低熔点玻璃粉,即具有低的软化温度或者低的熔化温度的玻璃粉.玻璃熔化温度的高低跟电子或阴离子对正电荷的屏蔽程度有关,改变物质的结构及性质,或者增大阴离子与阳离子的比例等,这都能改善阴离子对阳离子的屏蔽程度,从而降低物质的熔化温度[4].传统的含铅玻璃主要是PbO-SiO2系列,具有独特的网络结构,从而有着低热膨胀系数、高的化学稳定性以及较低的软化温度[5],因此含铅玻璃具有优异的性能.目前国内外无铅玻璃的研究重点主要集中在铋酸盐系玻璃上,因为Bi拥有和Pb相类似的外层电子结构,极性高,成玻区域大;B2O3可以形成一元、二元及多元玻璃,并且B2O3可以明显提高玻璃的流动性,降低软化温度,调节玻璃的热膨胀系数;钒酸盐玻璃在低温熔融方面有较大优势,但是V2O5在气化时有毒性,成本高,制备工艺较为复杂;磷酸盐玻璃与钒酸盐玻璃一样拥有较低的软化温度,成本较钒酸盐玻璃低很多,但是其化学稳定性低,制备工艺复杂,实用性较差.Dyamant等[6]研究了Bi2O3-SiO2-B2O3-ZnO体系玻璃,由于[BO3] 转变为[BO4],结构变得致密,当加入10 mol%~30 mol%的B2O3时,玻璃的膨胀系数为53~95×10-7/℃,随着B2O3含量的增加而下降;玻璃的软化温度为453~630 ℃,随着含量的增加而上升.付明等[7]研究了ZnO、AL2O3、NaF和Li2O对玻璃体系温度特性的影响,研制出了软化温度低于500 ℃,溶化温度低于560℃的Bi2O3-SiO2-B2O3体系微晶玻璃,并以其为基础制备出满足低温电极要求的导电银浆料.综上,目前电子浆料的无铅化是国内外的研究热点,所谓无铅化是在浆料的配置中采用无铅玻璃粉代替传统的含铅玻璃粉,目前国际上仅有铋酸盐体系玻璃粉应用于电子浆料中,其余系列玻璃粉尚处于研制开发阶段[8].
石康等[9]研究了Bi2O3-SiO2-B2O3-ZnO无铅玻璃添加金属氧化物后的性能,改善了玻璃的封接性能.李胜春等[10]在ZnO-B2O3-P2O5-RnOm系玻璃中掺杂不同含量的Fe2O3研究其耐水性,结果表明掺杂 Fe2O3能生成具有良好耐水性的P-O-Fe键取代易水解的磷酸盐链接,能显著的提高磷酸盐玻璃的耐水性.掺杂单一氧化物虽然具有良好的附着力但是烧结温度高[11-12].用多种氧化物和玻璃主体掺杂来研制低熔点适用于电子浆料的玻璃相已成为当今的研究热点之一[13-14].
本文研究钒磷铋体系玻璃的制备及其氧化物掺杂对其性能影响,本体系玻璃目前国内外尚无报道,以往研究,仅侧重于对玻璃主体的含量进行探究及分析,选取多组玻璃主体的不同配比来研究玻璃的各种性能.并没有分析玻璃添加剂对玻璃性能的影响.部分研究中涉及到玻璃添加剂对玻璃体系的影响,只限于每一样本中单一氧化物对其性能影响,不能综合反映多种氧化物的影响规律.本文在以V2O5、P2O5、Bi2O3为基体的低熔点玻璃粉中,添加Na2O、Li2O、Sb2O3等多种氧化物,利用控制变量法,改变其中一种氧化物的含量,探究其含量变化分别对玻璃样品的特征温度、线膨胀系数以及化学稳定性的影响,最终确定最佳的氧化物配比,从而提高玻璃的综合性能.
1 实 验
1.1 原料与仪器
(1) 原料 所用原料均为分析纯试剂,主要有五氧化二钒V2O5,氧化铋Bi2O3,磷酸二氢铵NH4H2PO4(引入P2O5),碳酸钠Na2CO3(引入Na2O),碳酸锂Li2CO3(引入Li2O),三氧化二锑Sb2O3,氧化铜CuO,氧化硼B2O3,硝酸HNO3,氢氧化钠溶液NaOH,去离子水H2O.
(2) 仪器 AL104电子天平(梅特勒-托利多仪器(上海)有限公司),SRJX-6-13A箱式电阻炉(上海雷韵实验仪器制造有限公司),SXL-1304程控箱式电炉(上海精宏实验设备有限公司),真空管式气氛炉(西安嘉博电炉有限公司),WGL-230B电热鼓风干燥箱(上海实验仪器厂),QM-1SP2行星式球磨机(南京大学仪器厂),STA449F5同步热分析仪(德国耐驰仪器制造有限公司),PCY高温卧式膨胀仪(湘潭湘仪仪器有限公司).
1.2 玻璃样品制备
实验以V2O5-P2O5-Bi2O3系玻璃粉为研究对象,由于P2O5易在空气中吸潮,因此引入磷酸二氢铵NH4H2PO4,分别掺杂Na2O、Li2O、Sb2O3、CuO、B2O3,由于Na2O、Li2O在空气中极不稳定,会与H2O及CO2等气体发生剧烈反应,因此实验原料选择Na2CO3和Li2CO3来代替Na2O和Li2O.
按照表1中的配比称取各组原料,将混合料置于玛瑙研钵中研磨,充分混合原料,将配好的原料放入100 mL刚玉坩埚内,置于电阻炉中,升温至300 ℃,保温15 min,打开炉门,排尽炉内的氮气,随后关闭炉门,升温至1 200 ℃,升温速率设为10 ℃/min,温度升至1 200 ℃后,用不锈钢棒搅拌玻璃熔液,玻璃熔液搅拌均匀后保温30 min,熔融得到澄清的玻璃熔液.将一部分玻璃熔液倾入不锈钢模具中,得到Φ6 mm×25 mm的圆柱体玻璃试样,该试样被用于测试样品的线膨胀系数,剩余的熔液倾入装有去离子水的不锈钢容器中,得到玻璃颗粒.将Φ6 mm×25 mm的圆柱体玻璃试样置于300 ℃的电阻炉中保温3 h退火,随炉冷却,消除残余应力.将玻璃颗粒放入80 ℃干燥箱中干燥1 h,随后取出干燥的玻璃颗粒置于球磨机中球磨2 h,然后过325目不锈钢筛网,制备得到玻璃粉末.采用外加法添加氧化物,利用控制变量法保证其中四种氧化物的含量固定,研究另外一种含量的变化对低熔点钒磷铋系玻璃性能的影响.
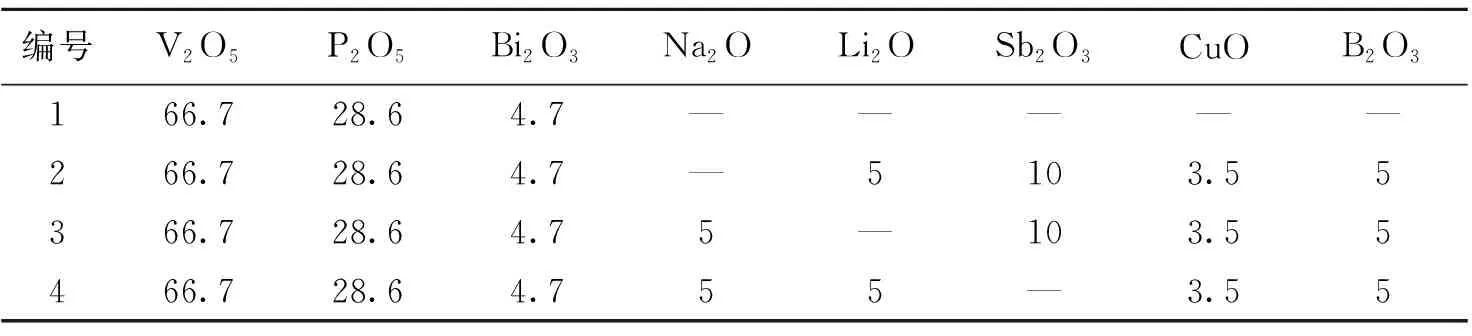
表 1 V2O5-P2O5-Bi2O3系玻璃样品的组分
初步实验表明:样品1的玻璃主成分V2O5、P2O5、Bi2O3质量百分比分别为66.7%,28.6%,4.7%,此时,该玻璃软化温度最低,为325 ℃,热膨胀系数为10.595×10-6/℃,浸水失重率为28.56%,浸酸失重率为10.36%,浸碱失重率为15.73%.下文以此为基本组分,在此基础上掺杂其他氧化物来研究钒磷铋系玻璃的性能.
1.3 测试与表征
差热分析采用STA449F5差热分析仪,用N2作为保护气氛,设置温度800 ℃,升温速率10 ℃/min,样品分析盒为刚玉坩埚,参比坩埚为刚玉坩埚,测得钒磷铋系玻璃的DSC曲线.
线膨胀系数采用PCY卧式膨胀高温卧式膨胀仪,样品尺寸为Φ6 mm×25 mm,测试范围为室温~300 ℃,升温速率5 ℃/min,记录温度间隔为5 ℃,计算样品室温~300 ℃的平均线膨胀系数.
化学稳定性采用块状法,分别采用耐水性、耐碱性、耐酸性来进行表征.将玻璃条放入去离子水中室温浸泡24 h测定耐水性;在浓度为30%的稀硝酸溶液中浸泡4h测定耐酸性;在浓度为0.1 mol/L的氢氧化钠溶液中浸泡4 h测定耐碱性.对所测样品洗涤、干燥、称重,测得各玻璃样品的质量损失,计算质量损失率.
XRD测试采用D/max2200PC型X射线衍射仪,测试起始衍射角为5°,终止角度为70°,连续扫描模式.扫描速度为4°/min.通过观察玻璃的XRD图谱对玻璃进行物相分析.
2 结果与分析
2.1 玻璃的特征温度
图1(a)为添加不同质量分数的Na2O时玻璃特征温度的变化趋势图.可知,Na2O质量分数为0~2.5%时,其转变温度和软化温度有明显的上升.转变温度从348 ℃上升到418 ℃.在2.5~10%时,其转变温度几乎不变,但其软化温度继续升高.掺杂Na2O,玻璃的转变温度和软化温度均有所上升.这主要是由于玻璃中存在易断裂的Na-O离子键,从而增加了游离氧的含量,导致网络中的[BO3]、[CuO6]夺取游离氧形成[BO4]、[CuO4]进入到玻璃网络中,提高玻璃骨架网络的稳定性,故玻璃的特征温度均升高.
图1(b)为添加不同质量分数的Li2O时玻璃特征温度的变化趋势图.可知,Li2O的含量在不断增加过程中,其玻璃的转变温度及软化温度先增大后减小.Li2O作为玻璃网络外体,具有提高玻璃热稳定性及机械强度的作用.Li+的引入增加了网络中的游离氧,使得[BO4]、[CuO4]进入到玻璃网络中,提高了玻璃网络的稳定性,而使玻璃的转变温度和软化温度升高.Li+的含量继续增加,玻璃网络主体发生了变化,此时特征温度开始下降.从文献[15]可知,在磷酸盐玻璃中添加氧化物会导致玻璃的链状结构转为脚链结构或使其层状结构的链键断裂.Li+的电场强度大,会使得钒氧结构和磷氧结构断裂,产生非桥氧,导致原来玻璃的结构按照三维架状结构→二维层状结构→一维链状结构的顺序改变,即断网作用,而使玻璃的特征温度下降.
图1(c)为添加不同质量分数Sb2O3时玻璃特征温度的变化趋势图.转变温度随着其掺杂物的增加较为稳定的增长,而软化温度在Sb2O3质量分数为0~15%时持续升高,在15%~20%时又基本保持不变.当引入Sb2O3后,玻璃中的游离氧增加,游离于网络之外的[BO3]和[CuO6]夺取游离氧,形成的[BO4]和[CuO4]参与到玻璃网络中去,增加了玻璃网络的稳定性,作为中间体或者外体的Sb2O3则填充到玻璃网络结构的空隙当中去,也使玻璃结构变得的紧密;当Sb2O3浓度继续增加时,Sb3+也会夺取网络中的游离氧[16],降低了阴离子对阳离子的屏蔽作用.综合以上分析,本体系玻璃中,Sb2O3的引入使得玻璃的特征温度呈上升趋势.
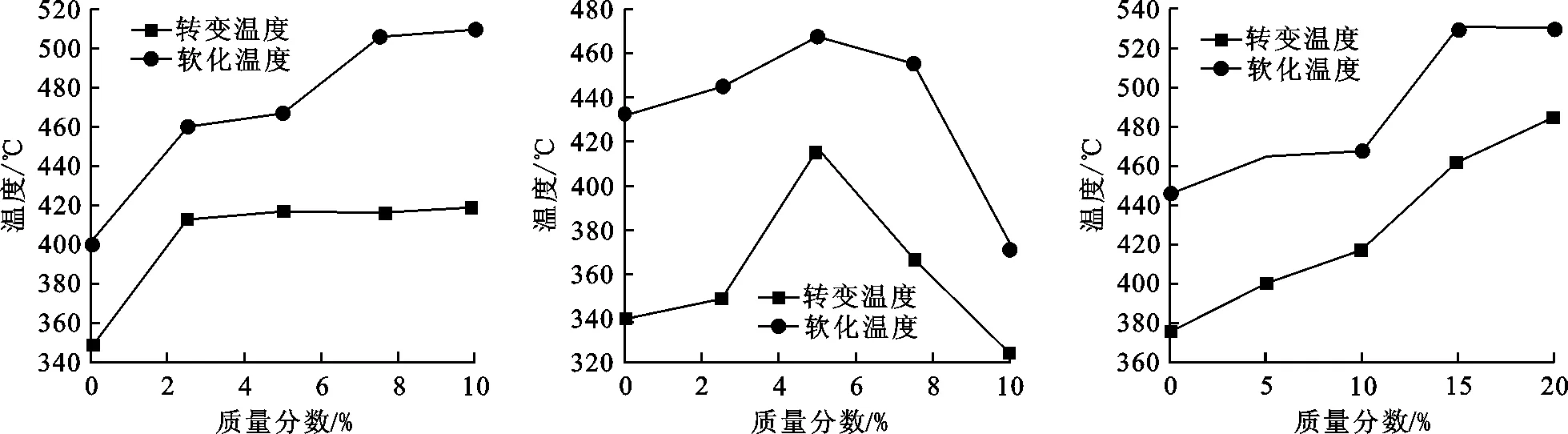
(a) Na2O对样品特征温度的影响 (b) Li2O对样品特征温度的影响 (c) Sb2O3对样品特征温度的影响图 1 氧化物的添加对玻璃特征温度的影响趋势Fig.1 The influence of the addition of oxide on the characteristic temperature of glass
2.2 玻璃的线膨胀系数
图2为掺杂氧化物后各玻璃样品的热膨胀系数曲线.从图2可知,玻璃的热膨胀系数随着Na2O质量分数的增加而降低.由于加入Na2O后,引入游离氧,该分子可以使两个硼氧三角体[BO3]转变为[BO4]四面体[17],玻璃相增加使其结构致密度提高,同时其结构中的非桥氧数量增多[18],导致钒氧、磷氧键的断裂,破坏玻璃网络的完整性,引入B-O结构会增大其键能及原子间结合力,从而导致该玻璃热膨胀系数不断降低.该玻璃样品的热膨胀系数随Li2O含量的增加而呈现先降低后升高的趋势,在Li2O含量较少时,其玻璃网络中的游离氧数量增加,其中更多的[BO3]、[CuO6]转变为[BO4]和[CuO4],参与到玻璃网络使其结构变得紧密及更加稳定,降低了其热膨胀系数.随Li2O含量增加时,此时Li2O主要起断网作用,使得玻璃网络结构发生变化,由原来的三维架状结构向二维层状结构,一维链状结构顺序改变,结构变得疏松,原子间的结合力变弱,因此,导致该玻璃热膨胀系数上升.该玻璃热膨胀系数随Sb2O3的加入呈下降趋势,Sb2O3引入使得玻璃网络中的P-O-P键断裂,形成P-O-Sb新键,P-O-Sb较P-O-P更为紧密,键能也较大,增加了玻璃网络的致密性及稳定性,加上Sb2O3可以引入较多的游离氧,由于网络中存在较多的[BO3]及[CuO6],使得更多的[BO3]、[CuO4]生成加入到玻璃网络中,使得玻璃网络更为紧密,稳定性增加,导致玻璃的热膨胀系数降低.
2.3 玻璃的化学稳定性
图3~5分别为添加不同质量分数氧化物的玻璃的失重率曲线.由图3可知,随着Na2O的增加,玻璃耐碱性迅速变强,后期缓慢增强及趋于稳定;Na2O质量分数在0~2.5%时,耐水性缓慢增强,但随着Na2O继续增加耐水开始缓慢变差,但变化较小并基本趋于平衡;其耐酸性在Na2O质量分数为0~2.5%时快速变差,继续增加Na2O,由于其耐酸性反而缓慢增强.在该玻璃中,H+攻击P=O双键和P—O—P单键,形成新的P—OH键,从而破坏网络结构[19-20].随着浸泡时间的增加,H+使[PO4]四面体网络破坏,生成PO43-,PO43-进入水中使水逐渐变为酸性.Na+的引入,打开了玻璃中的P=O双键,形成了[Na3PO4],其结构与[SiO4]类似,增强了玻璃网络的交联,加强了玻璃结构的稳定性.因此,引入Na2O后玻璃的化学稳定性均会有所提升,尤其是耐碱性,其耐酸性在Na2O量较少时反而会减弱,原因是当Na2O引入量较少时,游离氧不足,玻璃中游离的[BO3]结合H+生成H3BO3.因此,玻璃的耐酸性减弱.进一步增加Na2O含量,会引入众多游离氧,使得玻璃中的硼氧三角体[BO4]含量增多,玻璃中[BO3]减少,玻璃相减少,玻璃的耐酸性增强.

图 2 玻璃样品热膨胀系数的变化趋势图 图 3 添加不同质量分数Na2O后玻璃的失重率趋势图 Fig.2 Diagram of thermal expansion coefficient of glass sample Fig.3 Diagram of weight loss rate of glass after adding different mass fraction Na2O
由图4可知,随着Li2O含量的提高,玻璃的耐水性、耐酸性、耐碱性均变差,其耐水性降低幅度较小,其耐酸性则较为明显地变差;其耐碱性在0~5%变化降低较为缓慢,但当Li2O质量分数在5%~7.5%时,其耐碱性急剧降低,Li2O质量分数在7.5%~10%时,耐碱性变化较小并趋于平衡.在本体系玻璃中,随着Li2O的含量变化,玻璃的化学稳定性与之前添加Na2O的含量变化所呈现的变化趋势相反.主要是由于Li+比Na+的离子半径小,场强大,绝大多数Li2O是作为网络外体游离在玻璃网络之外,Li+的极性强,它会引导其周围的氧按照其本身的配位数排列,破坏了玻璃网络的结构,使得玻璃的稳定性降低,由于其夺取了较多的游离氧,使得玻璃中的硼氧三角体[BO3]含量增多,[BO4]减少,玻璃相减少,从而导致玻璃的化学稳定性下降.
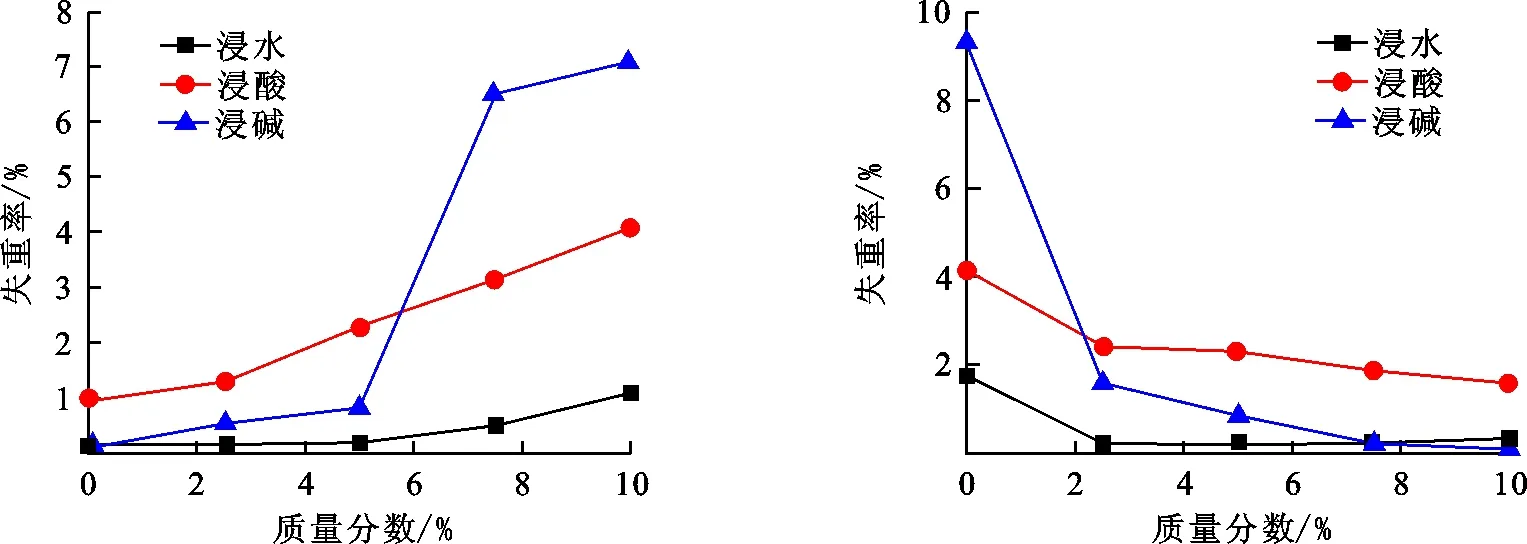
图 4 添加不同质量分数Li2O后玻璃的失重率趋势图 图 5 添加不同质量分数Sb2O3后玻璃的失重率趋势图Fig.4 Diagram of weight loss rate of glass after dding different mass fraction Li2Fig.5 Diagram of weight loss rate of glass after aO adding different mass fraction Sb2O3
由图5知,在添加Sb2O3后,玻璃的耐水性、耐酸性及耐碱性均有较为明显的提升,尤其是耐碱性,当Sb2O3质量分数大于5%时,其耐碱性提升较耐水性及耐酸性提升更大,但较之前明显变缓慢,其耐水性和耐酸性则趋于稳定,基本不随Sb2O3的增加变化.玻璃中添加Sb2O3后,在Bi2O3的作用下,P-O-V和P-O-P断裂,形成V-O-Sb以及P-O-Sb,形成的P-O-Sb键和V-O-Sb键较P-O-V键和P-O-P键键能更大,原子间结合力更大,增加了玻璃网络的紧密性和稳定性,同时,Sb3+可以使扩散通道受阻[21],从而压制了H+和OH-的扩散,并且Sb2O3引入能够带来更多的游离氧,不仅增加了对阳离子的屏蔽作用,还增加了玻璃相,以上的综合作用使得玻璃的化学稳定性提升.
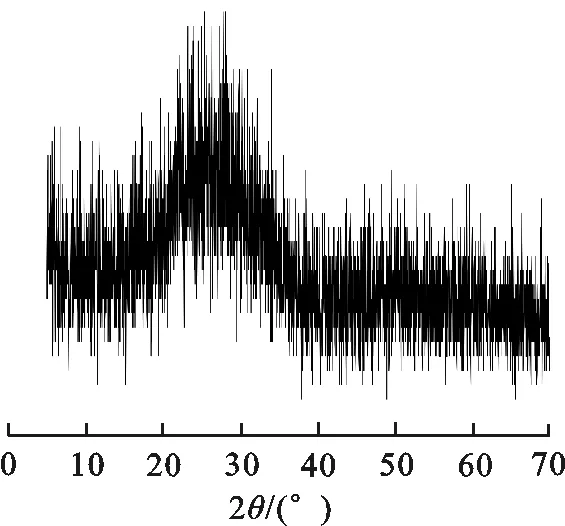
图 6 玻璃样品的XRD图Fig.6 XRD diagram of glass samples
2.4 玻璃的射线洐射(XRD)分析
现对一组玻璃样品进行XRD分析.图6为氧化物组分为5%Na2O,5%Li2O,3.5%CuO,10%Sb2O3,5%B2O3的玻璃样品的XRD谱.可见,其有一个较宽的、平滑的衍射峰,不存在其他尖锐的、强烈的衍射峰,说明玻璃中无晶态物质,即玻璃为非晶态物质,玻璃的成玻性能较为优良,该体系玻璃性能较为稳定.
3 结束语
在以V2O5-P2O5-Bi2O3为基体的低熔点玻璃粉中,添加Na2O、Li2O、
Sb2O3、CuO、B2O3为辅助原料,探究Na2O、Li2O、Sb2O33种氧化物掺杂对玻璃性能的影响.该三种氧化物的适量掺杂均能提升玻璃的特征温度,网络结构稳定性得到较大改善.随着掺杂Na2O和Sb2O3含量的增加,能够导致其玻璃样品的热膨胀系数一直呈下降趋势,提高玻璃的化学稳定性;随着Li2O含量的增加,玻璃样品的热膨胀系数呈现先下降后上升的趋势,在Li2O含量为5%时,其玻璃的热膨胀系数为较小值.
随着Li2O的掺杂,破坏了玻璃的网络结构,从而导致玻璃的化学稳定性下降.当样品的组成成分为5%Na2O,5%Li2O,3.5%CuO,10%Sb2O3,5%B2O3时,该体系玻璃化学性能更趋稳定,并且增大了玻璃的热膨胀系数,拓展了钒磷铋系玻璃的适用范围.
