激素受体阳性、人表皮生长因子受体阴性、腋窝淋巴结阴性、Oncotype DX21基因评分中等风险的早期乳腺癌患者单纯内分泌治疗与化疗联合内分泌治疗的比较
——TAILORx研究解读
2018-09-15莫淼,王靖雯,张剑
本期分享的是2018年6月发表在《新英格兰医学杂志》上的TAILORx研究[1],旨在比较激素受体(hormone receptor,HR)阳性(+)、人表皮生长因子受体-2(human epidermal growth factor receptor-2,HER-2)阴性(-)、腋窝淋巴结(axillary lymph node,ALN)阴性(-)、Oncotype DX21基因复发风险评分(recurrence score,RS)中等的早期浸润性乳腺癌患者接受单纯内分泌治疗是否非劣于化疗联合内分泌治疗,以探讨基于Oncotype DX21基因评分个性化指导早期乳腺癌患者辅助治疗决策的应用价值。部分内容参考2018年美国临床肿瘤学会(American Society of Clinical Oncology,ASCO)会议中关于本研究的报道。
1 背景
乳腺癌是全球女性最常见的恶性肿瘤。在美国,HR+、ALN-的患者约占乳腺癌总数的50%,指南建议大部分患者进行辅助化疗以降低复发风险(30%),而个体获益可能仅有1%~5%,因此大部分患者可能存在过度治疗。
对于T1-3、N0-1、M0的早期乳腺癌患者,根据美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)指南,一般先接受根治性手术和外科腋窝分期。若腋窝淋巴结为阴性,再行放疗。然后考虑激素受体状态等因素,若符合HR+、HER-2-、T1-3、N0及原发肿瘤>0.5 cm等条件,则建议考虑Oncotype DX21基因检测。若RS显示低风险(<18分),推荐单纯辅助内分泌治疗;若RS显示高风险(≥31分),建议接受辅助内分泌治疗联合化疗;若RS显示中等风险(18~30分),是否需要接受辅助化疗,指南尚无定论。
TAILORx研究的目的在于解答该问题。为什么选择Oncotype DX21基因评分?先来回顾两项非常重要的研究:探讨RS预后价值的NSABP B14研究和探讨RS预测价值的B20研究。
N S A B P B 1 4研究确立了他莫昔芬(tamoxifen,TAM)在HR+、ALN-乳腺癌患者中的作用。研究者将标本重新检测,选出21个重要基因,根据基因表达水平计算复发评分(图1),从而将患者分为低、中和高风险3层,比例分别为51%、22%和27%,10年远处转移率分别为6.8%、14.3%和30.5%,多因素分析显示RS的预后价值独立于年龄和肿瘤的大小。
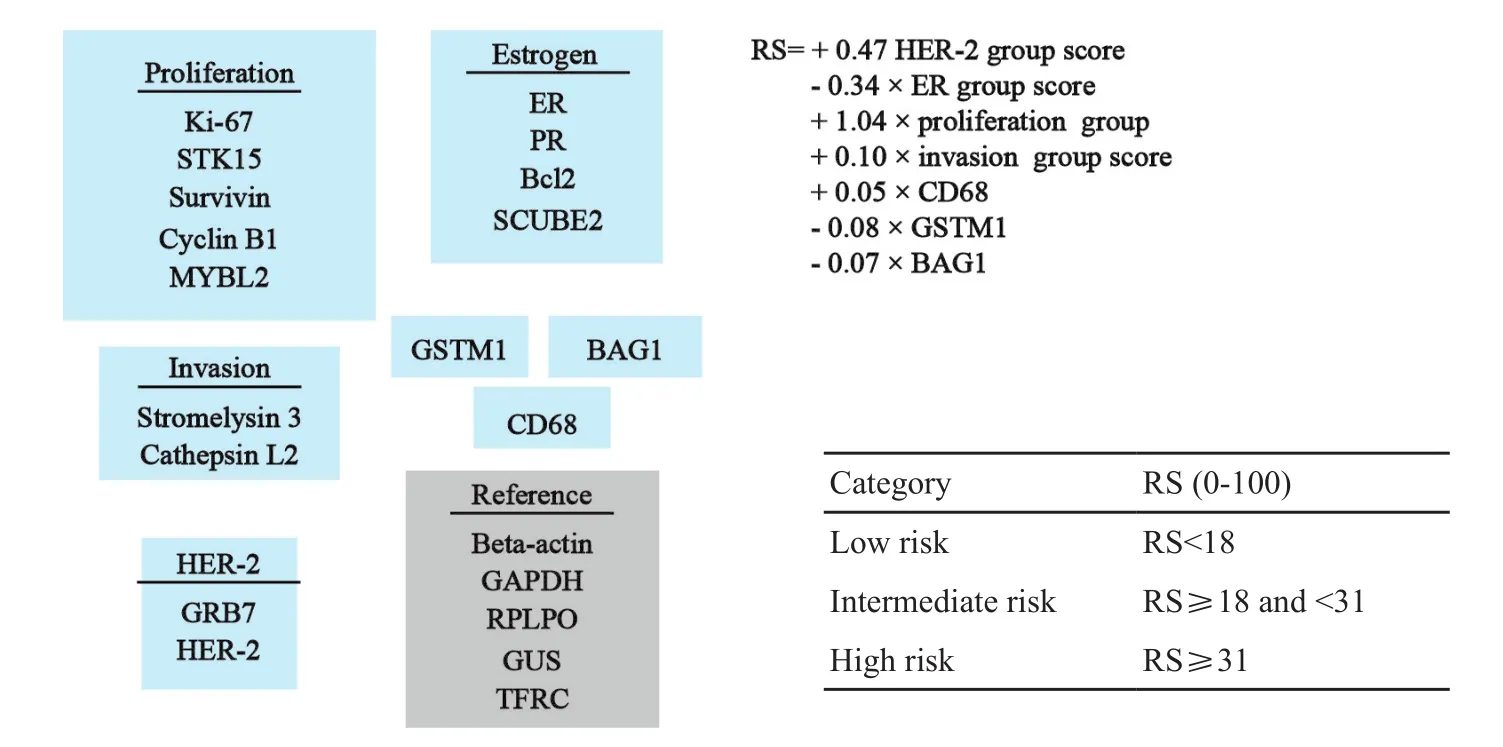
图 1 NSABP B14研究中21基因评分的算法及危险程度分类Fig. 1 The algorithm and risk category of 21-gene recurrence-score
NSABP B20研究也是在HR+、ALN-的乳腺癌患者中进行,探索患者术后是否需要辅助化疗。结果显示,所有患者接受辅助化疗后明显获益。事后的21基因RS分析发现,低风险患者从化疗获益有限,高风险患者可从化疗明显获益;而中等风险患者化疗获益不明确。TAILORx研究正是针对这些RS中等风险患者是否需要辅助化疗进行探讨。
2 研究概况
主要入组标准:NCCN指南推荐或考虑接受辅助化疗的浸润性乳腺癌患者;年龄18~75岁;ALN-;HR+,HER-2-;肿瘤大小1.1~5.0 cm(或0.6~1.0 cm组织学中高分级);同意接受化疗或愿意根据RS随机接受化疗或不化疗。
2006年4月—2010年10月,本研究基于RS结果,最终入组10 273例患者,并分配至4个治疗组(图2):RS≤10分的患者只接受内分泌治疗(A组);RS≥26分的患者接受化疗联合内分泌治疗(D组);RS为11~25分的中等风险患者随机分配接受单独内分泌治疗(B组)或化疗联合内分泌治疗(C组)。
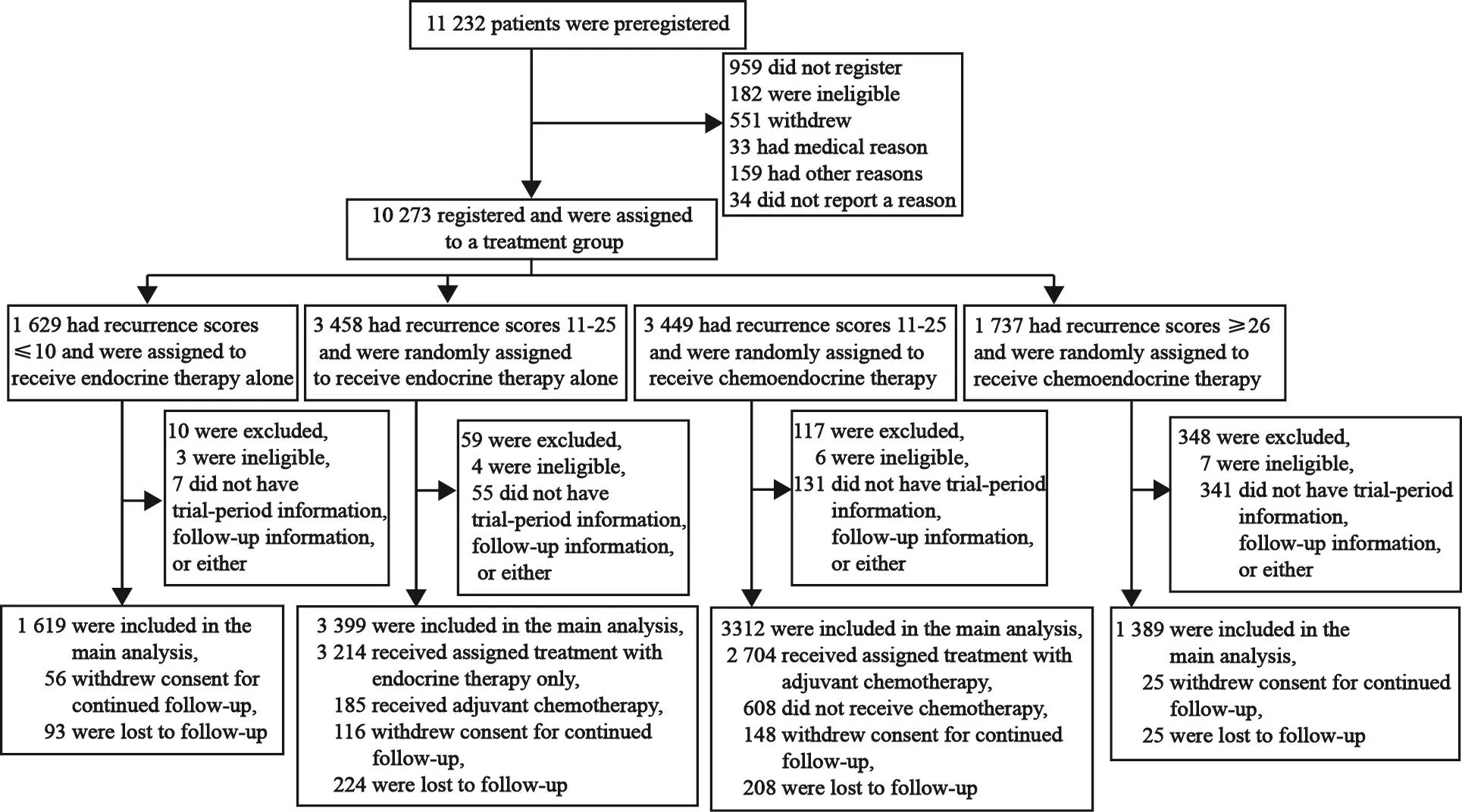
图 2 患者入组、治疗分配及随访流程图Fig. 2 Registration, randomization, and follow-up
主要研究终点在中等风险人群中为无浸润性疾病生存率(invasive disease-free survival,iDFS),在低风险人群中为无远处转移间期(distant recurrence-free interval,DRFI)。前者的事件包括远处转移、局部复发、对侧乳腺癌、其他浸润性第二原发肿瘤及无复发死亡等情况;后者仅包括远处转移。为何有此区别设置?因为DRFI是21基因工具开发最初使用的研究终点,所以低风险人群中仍采用该指标进行验证;而无病生存期(disease-free survival,DFS)是目前乳腺癌辅助治疗效果评估的推荐指标,所以作为研究主体部分的中等风险人群采用iDFS作为主要终点,以DRFI、无复发间期(relapse-free interval,RFI,包括远处转移与局部复发)以及总生存率(overall survival,OS)为次要研究终点。
3 非劣效设计要点
本研究采用非劣效设计,统计分析集以意向性分析(intention-to-treat,ITT)集为主,即所有参与随机的对象纳入随机组分析,无论实际接受何种治疗。另设实际接受治疗的as-treated集,包括按随机组接受治疗的患者[相当于符合方案(per-protocol,PP)集]和crossover后实际接受治疗的患者。
针对主要研究终点iDFS的非劣效界值设为1.322,该界值是如何确定的呢?根据既往研究,估计两组患者5年iDFS分别为87%(B组)、90%(C组)。无效假设为no difference,与优效性(或差异性)检验一样,根据HR的95%CI判断是否达到非劣效。设Ⅰ类错误(α)为单侧10%,Ⅱ类错误(β)=5%,不同于常见非劣效检验设α=0.050或0.025、β=0.1或0.2,研究者是为了最大程度地拒绝假非劣效。样本量在研究过程中考虑治疗依从性进行了调整,调整后要求随机6 517例,对应835例iDFS事件。P值通过分层log-rank检验计算,HR值由分层COX回归计算。探索性分析包括基于ITT集的基线特征与化疗获益的交互作用检验、RS作为连续性变量的分析等。期中分析第1次在至少达到总事件数25%(209)时进行,之后每年1次,共6次。在达到提前终止的条件(单侧0.002)或总事件数时结束,最终分析检验水准为单侧0.074(总α<0.100)。
4 ITT集与PP集的选择
当两组之间存在crossover或脱落时,ITT集结果该如何解读?根据图3,假设两组实际差异为Δ,由于各种因素影响,实际观察到的差异可能被缩小到Δ’。优效性设计中,如果Δ’被检验出差异有统计学意义,那么实际差异Δ阳性结论无疑。非劣效设计中,由于组间差异缩小后更有利于支持非劣效,相比实际差异Δ,缩小的Δ’被检验出差异无统计学意义或非劣效成立时存在假非劣效(即假阳性)的可能性。因此,优效性研究在ITT集更保守,仅看ITT集结果即可;而非劣效研究中ITT集不如PP集保守,仅看ITT可能存在假阳性,应当同时看ITT集和PP集结果,若一致则更可靠,若不一致则需进一步分析原因,谨慎下结论。
ITT集到PP集之间患者脱落原因各异,可分为两类(图4)。若是无偏脱落,两数据集的分析结果应该一致;若是有偏脱落,且有偏变量对于研究终点有影响,则可能导致PP集与ITT集结果不一致。
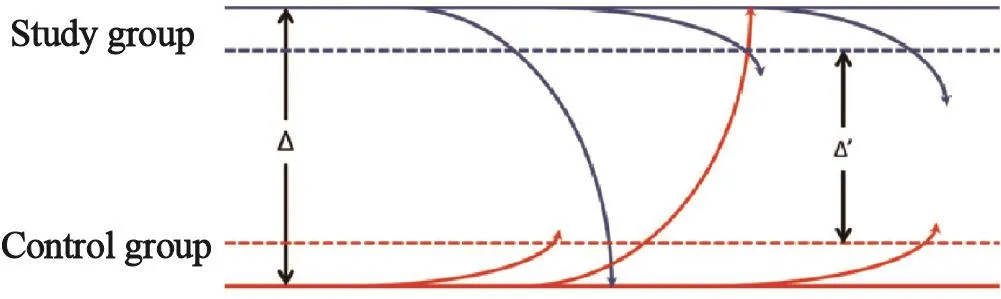
图 3 ITT与PP分析结果差异示意图Fig. 3 Diあerence between intention-to-treat (ITT) and perprotocol (PP) analysis
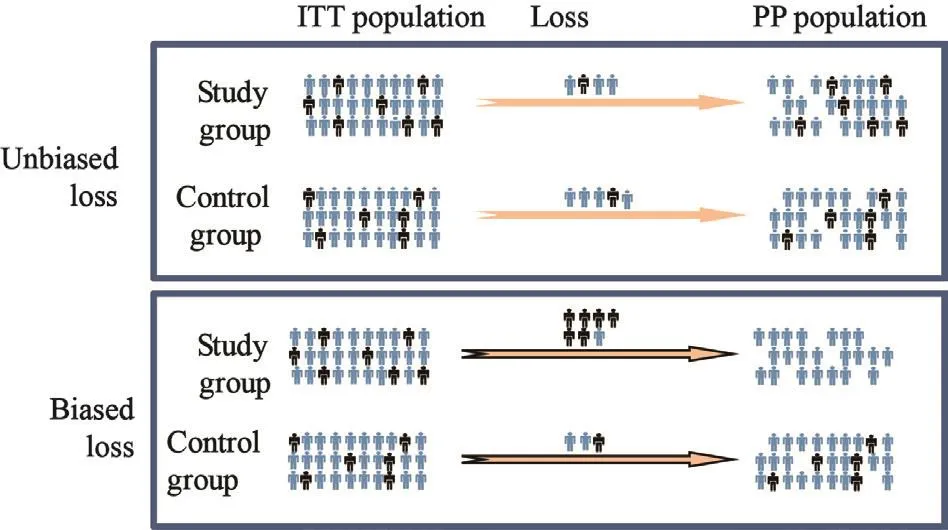
图 4 研究对象有偏脱落与无偏脱落示意图Fig. 4 Skematic diagram of unbiased loss versus biased loss of patients
5 研究结果
根据RS分组,10 273例患者中,低风险为17%,中等风险为69%,高风险为14%。各组患者基线特征见表1,其中6 711例随机患者在B、C两组的年龄、绝经状态等临床基线特征分布均衡,基于iDFS和OS的中位随访时长分别是90个月和96个月。所有随机患者中位年龄55岁,其中≤50岁的占33%;肿瘤大小1~2 cm的占63%;组织学分级中等占57%;临床风险评估低、高风险分别占74%和26%。
两组接受辅助内分泌治疗的依从性和治疗持续时间相似,绝经后91%的患者使用芳香化酶抑制剂(aromatase inhibitors,AI);绝经前78%的患者使用TAM或TAM+AI,13%的患者接受了卵巢功能抑制。化疗联合组中,56%采用TC方案,36%采用蒽环类为基础的方案。
ITT人群在中位随访7.5年后的最终分析中,共发生836例iDFS事件,其中338例(40.3%)为局部复发,199 例(23.8%)为远处转移。两组之间iDFS差异无统计学意义,HR=1.08(95%CI:0.94~1.24,P=0.26,图5),可信区间上限小于非劣效界值,符合非劣效结论。次要研究终点DRFI、RFI及OS等结果均支持非劣效。在as-treated集中,两组iDFS差异无统计学意义,HR=1.14(95%CI:0.99~1.31,P=0.06),可信区间上限临界小于非劣效界值,符合非劣效结论。次要研究终点DRFI、RFI及OS结果相似。
四组患者的9年事件发生情况:A组远处转移率为3%;D组在接受化疗联合内分泌治疗的情况下,远处转移率仍有13%;B、C两组合计远处转移率为5%,且各终点事件发生率的组间差异均≤1%。
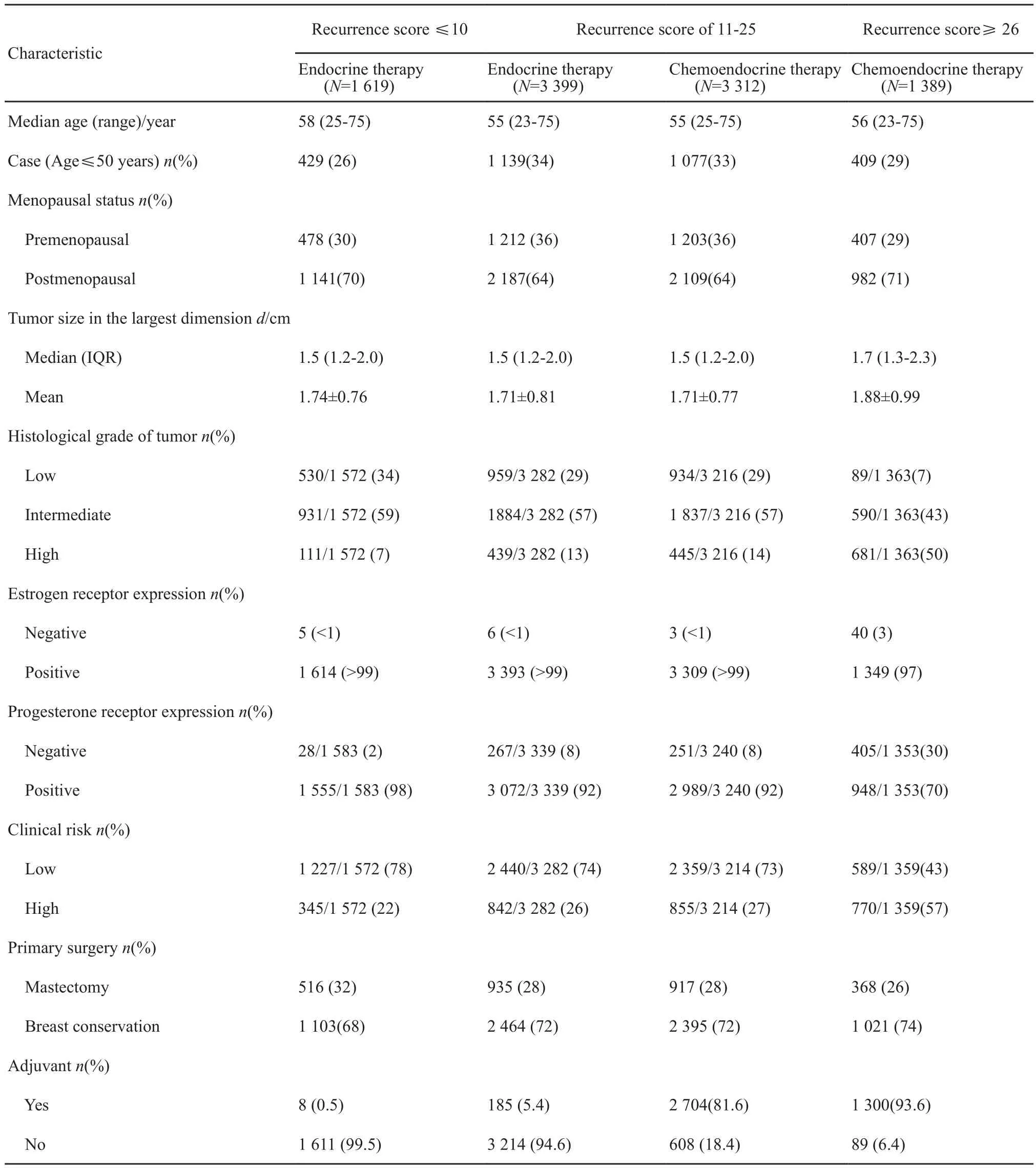
表 1 研究对象基线特征Tab. 1 Characteristics of the patients in the intention-to-treat population at baseline
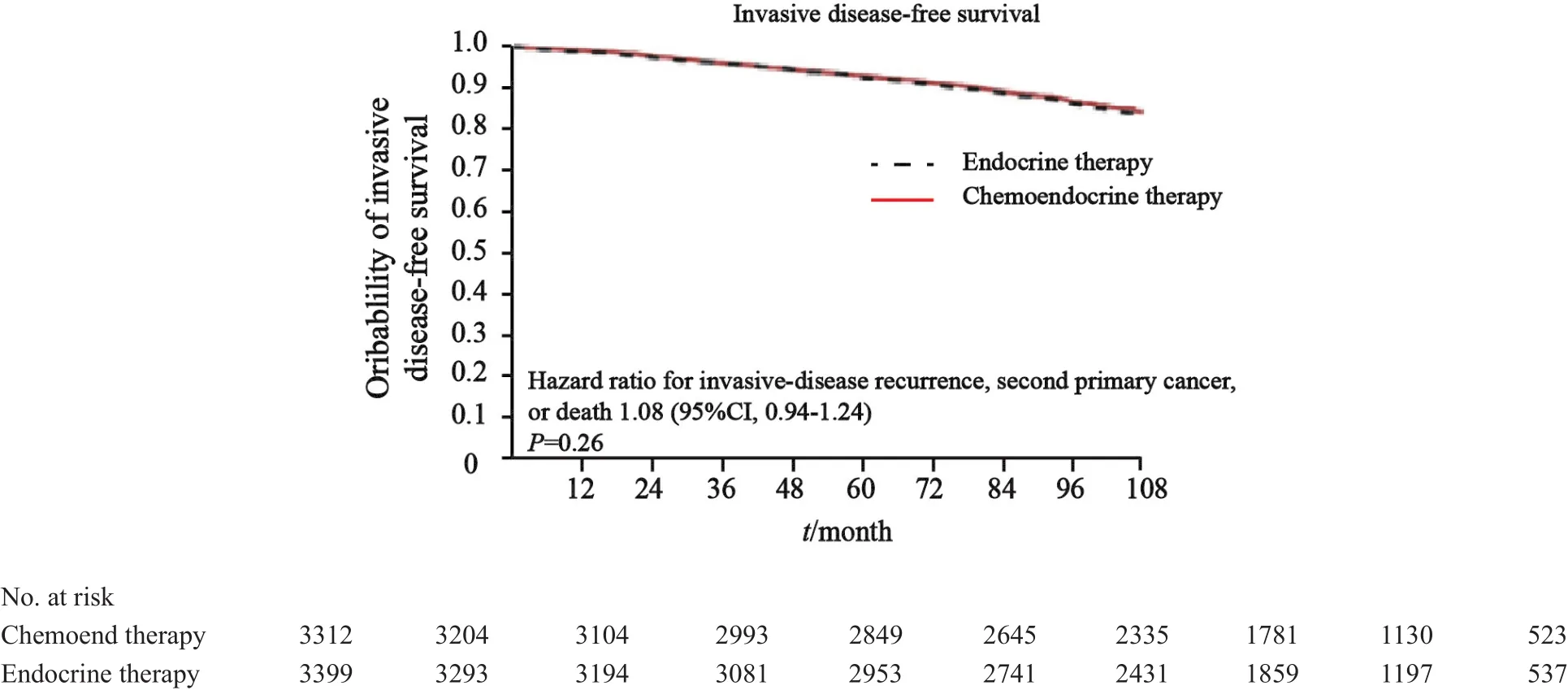
图 5 基于ITT集的患者iDFS结果(RS为11~25)Fig. 5 Invasive disease-free survival of patients according to ITT population (RS: 11-25)
探索性亚组分析提示,化疗获益与21基因RS分层、肿瘤大小、组织学分级、绝经状态及临床风险分层等因素不存在显著的交互作用,而与年龄组存在显著的交互作用(iDFS,P=0.03;RFI,P=0.02),还与年龄组或绝经状态结合RS分层时存在显著的交互作用(iDFS-年龄-RS,P=0.004;iDFS-绝经-RS,P=0.02)。研究者对≤50岁的患者进一步分析发现:RS为0~15分的低风险患者,单纯内分泌治疗就可以,远处转移率仅2%;而RS为16~25分的患者有一定程度的化疗获益。RS为16~20分时,化疗可减少9%的iDFS事件,包括1.6%的远处转移;RS为21~25分时,化疗可减少6.3%的iDFS事件,几乎全是远处转移。
若RS以连续性变量的形式作为横坐标,比较B、C两组间9年远处转移率随RS变化的差异,结果提示,≤50岁患者中,RS>16分时两条曲线逐渐分开,再次验证这部分患者可能从化疗中获益。而>50岁患者中,两条曲线在不同RS始终非常接近,也验证了这部分患者可免除化疗。
综上所述,本研究发现Oncotype DX21基因检测RS为11~25分的中等风险患者中,单纯内分泌治疗非劣于化疗联合内分泌治疗。RS为0~10分的低风险患者,单纯内分泌治疗即可;对于RS为26~100分的高风险患者,即使接受化疗联合内分泌治疗仍有较高的远处转移率(约13%)。探索性分析提示,年龄及RS与化疗获益存在显著相关性,50岁以下RS为16~25分的女性,可在一定程度上从化疗中获益。
6 讨论与思考
TAILORx研究结果一出,媒体普遍报道“70%的早期乳腺癌可避免化疗。”值得注意的是,70%是基于美国临床实践中HR+、HER-2-、ALN-的乳腺癌患者分布特征进行的估计,具体包括:>50岁且RS为11~25分(45%)、RS为0~10分任何年龄(16%)及≤50岁且RS为11~15分(8%)。中国临床实践中该比例是否达到70%?该结论需谨慎。首先,国内21基因检测方法与国外存在差别,RS分布是否一致尚未得到认证。其次,国内患者年龄构成与美国不同,故国内乳腺癌患者参考该研究可免除化疗的比例尚不明确。
该研究虽得出了非劣效结论,但仍有些问题值得思考。
首先,该非劣效研究仅报道ITT和as-treated集结果,未提供真正的PP集结果,不能排除crossover对结果的干扰。由于B、C组间存在不同程度的crossover(5.4% vs 18.4%),且C组拒绝化疗的情况在较低RS患者中更多见,因此as-treated集中患者基线特征不均衡(表2)。As-treated集中C组患者相比B组患者RS高风险比例更高(P<0.001),≤50岁年轻患者比例更高(P=0.003),意味着C组患者本身预后较差。假设两组基线平衡,则组间实际预后差异会更大,更倾向于拒绝非劣效。考虑到as-treated集结果本身为临界非劣效,则真实的差异有可能突破非劣效界值1.322,从而拒绝非劣效结论。
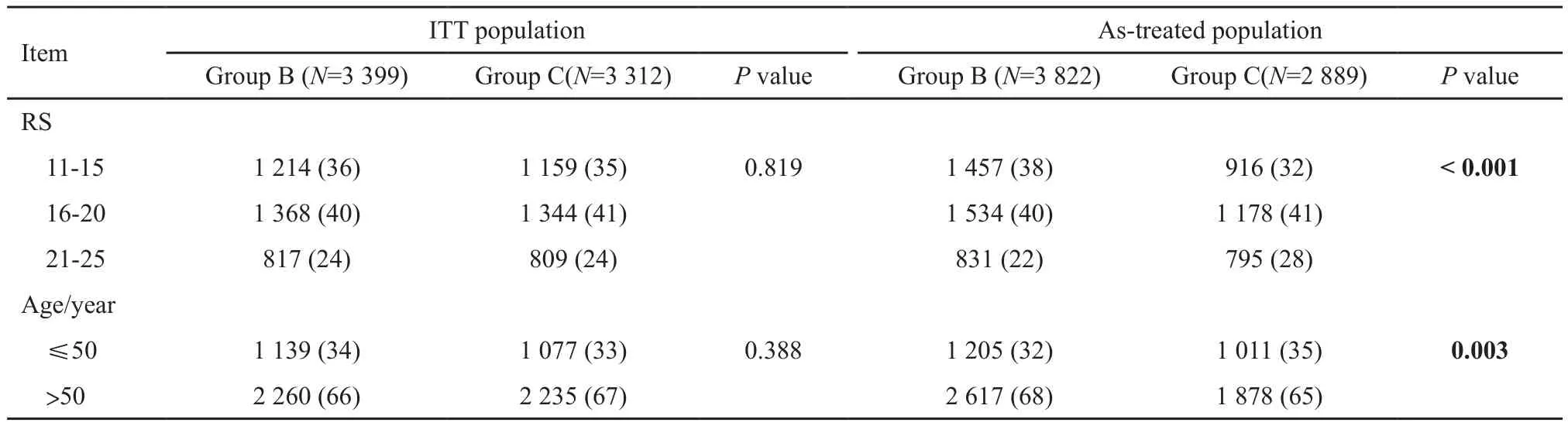
表 2 不同分析集两研究组间基线RS和年龄分布的比较Tab. 2 Diあerence in baseline distribution of recurrence score and age group between ITT population and as-treated population[n(%)]
其次,本研究RS分层未采用NSABP B14和B20研究中的界值(低风险<18;中等风险18~30;高风险≥31),而对每层界值调整至更低(低风险<11;中等风险11~25;高风险≥26),目的是最小化高风险组和随机组出现治疗不足的可能性。实际上,这样做也减小了纳入随机化的中等风险患者的总体风险程度,更有利于得到非劣效结论。因此,该研究结论的推广限于调整后的RS中等风险范围。此外,对于RS为11~17分的患者,根据NCCN指南本就可免于化疗,该研究中仍可能随机分配至接受化疗,这种情况是否存在伦理学问题值得考虑。
关于基因检测的个体化治疗指导,目前除了常用的21基因复发风险评分,还有70基因复发风险评分(MammaPrint)和50基因复发风险评分(PAM50)等,相关研究正在进行中。此外,TAILORx研究的后续RxPONDER研究也在进行中,将探讨HR阳性、HER-2阴性、1~3枚淋巴结阳性及RS≤25分的乳腺癌患者,在内分泌治疗基础上是否需要联合化疗,其结果值得期待。
