肝门部胆管癌不同术前胆道引流方式的选择
2018-09-12刘中张登勇马翔孙万亮鲁正
刘中 张登勇 马翔 孙万亮 鲁正
【摘要】目的:对比经皮肝内胆管引流术(percutaneous transhepatic biliary drainage,PTBD)与经内镜胆道引流(endoscopic biliary drainage,EBD)两种减黄方式在肝门部胆管癌术前的安全性及有效性。方法:对2004年1月至2017年6月蚌埠医学院第一附属医院106例肝门部胆管癌术前胆道引流的114i床资料进行回顾性分析,其中PTBD组62例,EBD组44例。结果:两组患者间术前基本资料无显著差异,PTBD组首次操作成功率58.1%,EBD组首次操作成功率56.8%,两组间术前引流时长无明显差异,操作引起的胆管炎及胰腺炎EBD组明显高于PTBD组(54.5%比22.6%,P<0.001),PTBD组中2位患者在肝门部胆管癌根治术后发生肿瘤细胞管道种植。结论:肝门部胆管癌术前行EBD较PTBD有较高的胆管炎及胰腺炎发生率,但PTBD可引起沿肿瘤种植。
【关键词】肝门部胆管癌;经皮肝内胆管引流术;经内镜胆道引流;并发症
肝门部胆管癌患者常伴有梗阻性黄疽及肝功能损害,术前减黄对手术效果的影响仍存在争议,恶性梗阻性黄疽引起的肝功能衰竭,是患者术后死亡的常见原因[1][2]。肝门胆管癌根治术中扩大肝切除的患者,术后为维持残肝功能,术前应积极减黄。对于合并胆管炎、营养状况差、行选择性门静脉栓塞的患者,也应考虑给予术前减黄[3][4]。关于术前胆道引流方式存在争议,目前主要治疗方式为PTBD和EBD,而EBD包括内镜下胆道支架植入术(endoscopic biliary stenting,EBS)和经内镜胆管内引流术(endoscopic retrograde biliarydrainage ,ERBD)[5]。尽管对这两种主要方法存在争议,但很少有研究将EBD和PTBD的临床结果进行比较,对于选择哪种方法还没有达成共识。因此,本研究的目的是对比EBD与PTBD两种减黄方式在肝门部胆管癌中的有效性和安全性。
1 资料与方法
1.1 一般资料
收集我院肝胆外科2004年至2017年肝门部胆管癌术前行胆道引流106例患者的临床资料,并进行回顾性分析,根据减黄方式不同分为两组:首次行PTBD患者62例,男38例,女24例,年龄4689岁,平均年龄62岁;首次行EBD患者44例,男30例,女30例,年龄4279岁,平均年龄63岁;其中,EBD组44例患者中35例行ENBD,9例行ERBD。
1.2 研究方法
1.2.1 术前减黄方式
1.2.1.1 PTBD
由经验丰富超声科医生B超下定位后确定穿刺位置,利多卡因局部麻醉,B超引导下放置7Fr或8Fr胆道引流管,确定胆汁流通后,固定引流管。首选肝脏预留侧引流,对于Bismuth Ⅳ患者,若引流不畅,可行双侧引流。
1.2.1.2 EBD
行全身麻醉后内镜下经十二指肠乳头插管,根据情况确定是否切开胆总管,插管成功后行胆管造影,根据肿瘤位置,将鼻胆管植入左或右肝内胆管,管道从鼻腔引出并固定。
1.2.2 效果评价
所有患者术前均结合CT、磁共振成像(MRI)、超声和胆道造影检查,确定肝门周围胆管的可切除性。术前收集的患者医疗数据包括人口特征、实验室检查、影像学研究、PTBD和ENBD的结果以及手术结果。记录所有操作引起的并发症,包括胆管炎、胰腺炎、管道脱位、管道闭塞、出血、穿孔等并发症。胆管炎被定义为无其他明显原因导致温度>38.5℃超过24小时,以及胆汁淤积和感染的生化常规数据(。反应蛋白和白细胞增加);胰腺炎被定义为出现持续的胰腺炎症状如腹痛、恶心、呕吐等并伴有术后24小时血清淀粉酶超过正常上限的3倍[6]。术前减黄时间定义为从最初胆道引流到血清总胆红素降至1.5mg/dL或胆道引流到手术日期的天数。改变胆道引流方式被定义为若引流治疗失败,需从EBD改为行PTBD或EBD改为行PTBD。手术时间定义从皮肤切开至缝皮,术后死亡率定义为术后院内死亡。
2 统计学处理
采用SPSS22.0软件对数据进行统计学分析。计量资料以均数±标准差(x±s)形式表示,两组间计量资料比较采用成组t检验,计数资料采用X2检验。分析了患者减黄情况、手术并发症情况及预后,P<0.05为差异有统计学意义。
3 结果
3.1 患者一般特征
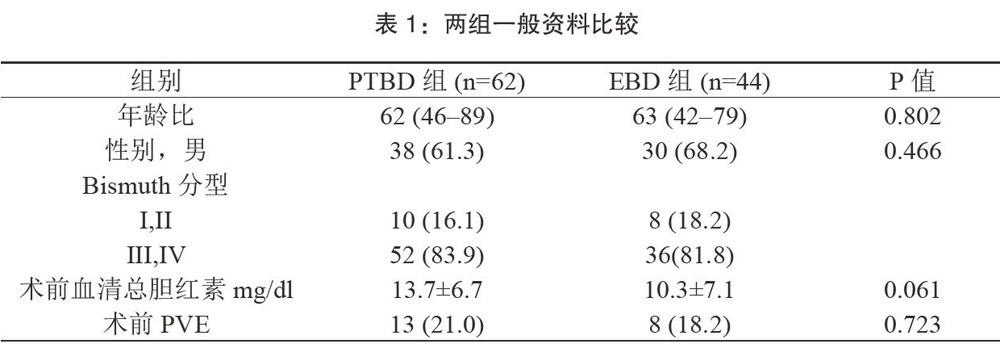
本研究中106例患者一般資料见表1,肝门部胆管癌分型按Bismuth-Corlette分型分类:约80%为Ⅲ型(n=67/106,63.2%)和Ⅳ型(n=21/106,19.8%),其次为Ⅱ型(n=16/106,15.1%),两组之间Ⅲ型和Ⅳ型病例总数的比率无明显差异(83.9%(52/62)比81.8%(36/44),p=0.798)。为提高了术后残肝功能,术前PTBD组中门静脉栓塞术占21.0%(13/62),EBD中比例占18.2%(8/44)0两组引流前血清总胆红素水平无显着性差异(PTBD vs EBD:13.716.7mg/dl vs 10.3±7.1mg/dl,p=0.061)。
3.2 操作及治疗情况
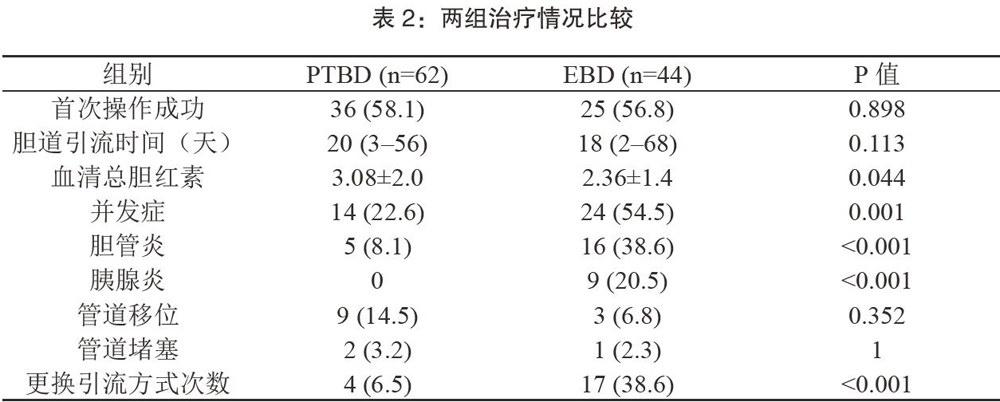
两组间治疗结果及并发症分析间见表2,两组术前胆道引流后血清胆红素水平显著下降(分别为PTBD组13.7±6.7~3.0812.0mg/dl),P<0.001,EBD组为10.3±7.1~2.36±1.4mg/dl,P<0.001)。术前血清胆红素水平PTBD组明显高于EBD组(3.08±2.0mg/dl比2.36±1.4mg/dl,p=0.044),胆道引流前后两组间血清胆红素下降水平差异无显著意义(10.40±6.3mg/dl比7.9±6.8mg/dl,p=0.145)。PTBD组首次操作成功比例(36/62,58.1%,)与EBD组首次尝试的成功比例(25/44,56.8%)无明显差异,但因治疗失败需更换引流方式的EBD组显著高于PTBD组((17/44)38.6%比(4/62)6.5%,P<0.001)0胆道引流时间PTBD为20(356)天与EBD组18(268)天,无明显差异(p=0.113)。
3.3 并发症
PTBD组中62例(22.6%)出现操作相关并发症,EBD组为24例(54.5%例),其中PTBD组并发症发生率明显高于EBD组(22.6%比54.5%,P<0.001)。PTBD组中管道移位发生率最高占14.5%,其次为胆管炎(8.1%)和管道闭塞(3.2%)。相反,在EBD组中,胆管炎最常见占38.6%,其次是胰腺炎占20.5%。在PTBD组中,胆管炎9.1%,无胰腺炎患者,两组结果存在显著差异(胆管炎P<0.001和胰腺炎P<0.001)。在EBD组中,所有急性胰腺炎患者均采用保守方法治疗,无其他干预措施,16例胆管炎患者中2例(12.5%)经再次干预后好转。
3.4 手术结果
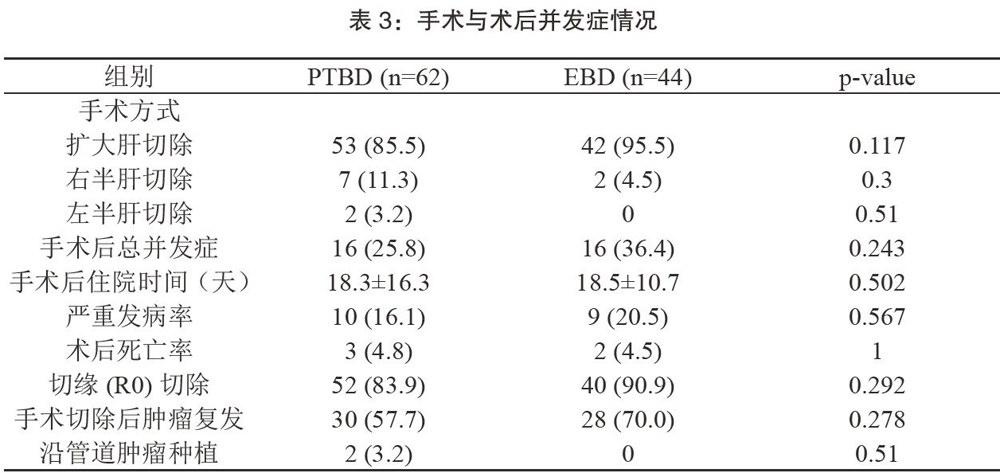
手术结果包括肝门部胆管癌根治术后并发症、死亡率及肿瘤复发情况见表3。两组患者大部分行扩大肝切除,包括半肝联合尾状叶切除及淋巴结清扫术(53(85.5%)比42(95.5%),p=0.117),PTBD组9例(8.5%例)和EBD组2例(1.9%例)患者分别接受半肝切除术。92例(86.8%例)均行治疗(R0)切除。PTBD组术后总并发症发生率为16/62(25.8%),与EBD组16/44(36.4%)无显著差异(p=0.243)0两组术后平均住院天数分别为18.3±16.3天、18.5±10.7天(p=0.502),无显著意义。两组术后死亡率分别为4.8%,4.5%,无明显差异。术后随访期间,PTBD组30例(57.7%)肿瘤复发,与EBD组28(70.0%)组无显著性差异(p=0.278)。仅PTBD组有2例患者出现管道肿瘤种植。
4 讨论
手术根治是肝门部胆管癌长期生存的唯一机会[7]。为达到切缘阴性RO切除,常需行扩大肝切除[8][9]。目前,术前胆道引流及同侧门静脉栓塞术可作为提高未来残肝功能的有效方法。术前胆道引流包括缓解胆汁淤积、改善营养状况及肝脏再生功能·提高免疫功能等潜在优势[10][11]。虽然PTBD被常规用作治疗肝门部胆管癌的术前引流方法,但一些研究也表明了EBD的实用性。研究表明单侧EBD可有效引流未来残肝从而促进了其生长[12]。然而,EBD操作复杂,在复杂胆道梗阻常出现引流不足,所以PTBD在肝门部胆管癌患者中仍是较好的选择。PTBD可通过多个导管提供广泛的肝脏引流,通过注射造影剂可以更精确地了解肿瘤解剖位置。此外,还可以发现,PTBD组再次干预率明显低于EBD组[13]。通常,EBD转化为PTBD是由于感染性并发症(如胆管炎)及未能充分引流残留肝脏。胆管炎是术前胆道引流后常发生的并发症之一,EBD组患者胆管炎发生率明显
高于PTBD组(38.6%比8.1%,P<0.001),所以,EBD组改变引流方式较PTBD组常见。事实上,胆管炎是肝门部胆管癌患者ERCP术后的主要并发症,尤其在造影剂注入胆道树后不能再排出时。
尽管PTBD作为术前胆道引流方法有许多优点,但研究表明PTBD较EBD更容易导致经管道肿瘤种植。Takahashi等人[14]的研究中,445例术前行PTBD的肝内胆管癌及远端胆管癌中出现23例管道肿瘤种植。Hwang等人[15]报告231例手术治疗肝门部胆管癌患者中4例(1.7%)患者出现管道肿瘤种植。据报道[16]PTBD可致肿瘤种植至腹膜、胸膜、皮肤,也可导致末端胆管癌和胰腺癌。本研究中,52例经手术切除的患者,其中2例(3.8%例)在随访期内出现导管肿瘤种植。有人认为多个导管引流以及术前减黄时间过长是潜在的危险因素,而且多次放置导管也可增加胆汁溢出的几率,从而导致癌症传播[14]。
我们的研究涉及9例ERBD和35例ENBD。其中,ERBD在最近较少使用,由于十二指肠液逆行流入胆道,导致胆管炎的发病率明显增高,而且ERBD不可以定期冲洗以防止阻塞,更加导致胆管炎的发生。本研究发现,尽管与ENBD相比,ERBD与胆管炎发生率较高(44.4%vs34.3%),但差异无统计学意义(p=0.702)。ENBD较ERBD因胆管炎减少、低侵袭性、避免肝脏穿刺而逐渐获得广泛接受。
本研究的仍存在局限:①本研究为回顾性分析,而且各治疗组人数不同,对首选EBD或PTBD患者而言,易存在選择偏倚的影响。②不同操作者在操作经验不同,影响并发症的发生率及操作的成功率,经验丰富的医师可能会提高早期胆道引流成功率。我们认识到需要进行前瞻性研究来定量比较术前两种引流方法。本研究对于临床治疗胆管癌术前胆道引流的临床疗效、安全性、远期预后等方面进行研究,是目前少有的研究成果之一。
总之,我们的结果表明,与PTBD相比,EBD胆管炎、胰腺炎等相关并发症的发病率较高,导致EBD患者更换引流方式的发生率更高,但这些并发症在大多数情况下都可以得到及时控制及治疗。在肝门部胆管癌患者术前胆道引流时,使用ENBD较ERBD治疗有明显的优越性。尽管PTBD沿管道肿瘤种植的危险性低,因其导致后果严重,PTBD应作为ENBD不可用或引流不畅时的替代选择。
参考文献
[1]Xiang S,Wan Y L,Chen X P.Hilar cholangiocarcinoma:Controversies onthe extent of surgical resectionaiming at cure[J].InternationalJournal of ColorectalDisease,2015,30(02):159-171.
[2]Tsao JI,Nimura Y,KamiyaJ,et al.Management ofhilarcholangiocarcinoma:comparison of an American anda lapaneseexperience[J].AnnSurg,2000,232(02):166-174.
[3]Sano T,Shimada K,Sakamoto Y,etal.One hundred two consecutivehepatobiliary resections forperihilar cholangiocarcinomawith zero mortality.AnnSurg2006;244:240-7.
[4] Paik WH,10ganathan N,Hwang JH.Preoperative biliary drainage inhilar cholangiocarcinoma:When
and how?[J].World J GastrointestEndosc, 2014, 6 (03): 68-73.
[5]Maguchi H, Takahashi K,Katanuma A, et al. Preoperativebiliary drainage for hilarcholangiocarcinoma.[J].Journalof Hepato-Biliary-PancreaticSciences, 2007, 14 (05): 441-446.
[6]Cotton P B, Lehman G, Vennes J,et al. Endoscopic sphincterotomycomplications and theirmanagement: an attempt atconsensus.[J].GastrointestinalEndoscopy, 1991, 37 (03): 383-393.hilar cholangiocarcinoma.AnnSurg. 2005; 241: 693-702.
[7]黃志强.肝门部胆管癌外科治疗——效果有待提高[J].临床外科杂志.2006.14(02):65-66.
[8]Jarnagin W.R.,FongY., DcMa t teo R.P., GonenM., Burke E.C., BodniewiczB.S.I.Staging, resectability, andoutcome in 225 patients withhilar cholangiocarcinoma.AnnSurg.2001; 234: 507-519.
[9] Hemming A.W., Reed A.I., FujitaS., Foley D.P.,Howard R.J.Surgical management of
[10]Na V D G, Kloek J J, de CastroS M, et al. Preoperative biliarydrainage in patients withobstructive jaundice: historyand current status.[J].Journalof Gastrointestinal SurgeryOfficial Journal of the Societyfor Surgery of the AlimentaryTract, 2009, 13 (04) : 814.
[11] Sano T, Shimada K, Sakamoto Y,et a1. One hundred two consecutivehepatobiliary resections forperihilar cholangiocarcinomawith zero mortality. AnnSurg2006; 244: 240-7.
[12] Arakura N, Takayama M,Ozaki Y, et al. Efficacyof preoperative endoscopicnasobiliary drainage for hilarcholangiocarcinoma[J]. Journal ofHepato-Biliary-Pancreatic Surgery,2009,16(04):473-477.
[13]Kloek JJ; van der Gaag NA; Aziz Y;Rauws EA; van Delden OM; LamerisJS; Busch OR; Gouma DJ; van GulikTM. Endoscopic and PercutaneousPreoperative Biliary Drainagein Patients with SuspectedHilar Cholangiocarcinoma[J].Journal of GastrointestinalSurgery,2010,14(O1):119-125.
[14]Takahashi Y, Nishio M N,Ebata T, et al. Percutaneoustranshepatic biliary drainagecatheter tract recurrencein cholangiocarcinoma[J].British Journal ofSurgery,2010,97(12):1860-1866.
[15] Hwang S, Song G W, Ha T Y, etal. Reappraisal of percutaneoustranshepatic biliary drainagetract recurrence after resectionof perihilar bile ductcancer[J]. World Journal ofSurgery, 2012, 36 (02) :379-385.
[16] Higuchi R, Yazawa T, Uemura S,et al. ENBD is Associated withDecreased Tumor DisseminationCompared to PTBD in PerihilarCholangiocarcinoma.[J].Journalof Gastrointestinal Surgery,2017 (Suppl 3) : 1-9.
