雷公藤多苷对雄性SD大鼠生殖系统损伤的动态变化及其可能机制
2018-09-12郭健敏黄远铿雷夏凌
郭健敏,黄远铿,雷夏凌,韩 重,梁 纯,杨 威
(1.广东省生物资源应用研究所,广东省动物保护与资源利用重点实验室,广东省野生动物保护与利用公共实验室,广东广州 510260;2.广东莱恩医药研究院有限公司,广东广州 510990;3.香港科技大学,香港 999077)
雷公藤多苷(multi-glycosides from Tripterygium wilfordii Hook.f.,GTW)亦称雷公藤总苷,GTW片是目前应用最广泛的口服雷公藤制剂之一[1],主要用于治疗风湿性和类风湿性关节炎、肾小球肾炎、肾病综合征、红斑狼疮和自身免疫性肝炎等免疫性疾病,疗效显著[2-3],但不良反应也十分明显。临床服用GTW常见的不良反应主要有恶心、食欲减退、谷丙转氨酶和谷草转氨酶升高、白细胞及血小板减少、月经紊乱及精子减少等[4-6]。其中,在生殖系统方面的毒性十分突出,对男性生殖系统影响尤为明显,可引起精子数量减少、活动力下降、畸形率增加、睾丸萎缩和性欲减退等症状。目前,对GTW雄性生殖毒性的研究主要集中在睾丸的生精功能、组织标志酶、对精原细胞的杀伤与诱变等方面,但未见其对生殖系统毒性动态过程的研究。为此,本研究选择处于性器官发育阶段的雄性SD大鼠,通过精子检查、生殖脏器系数和组织病理等指标,动态观察GTW生殖毒性的发展过程及可逆性,同时针对下丘脑-垂体-性腺轴(hypothalamus-pituitarygonadal axis,HPG轴)激素分泌和激素受体表达探讨其毒性机制,为临床合理用药以及配伍减毒提供依据。
1 材料与方法
1.1 动物、药物、主要试剂和仪器
5周龄雄性SD大鼠180只,体质量110~150 g,购自湖南斯莱克景达实验动物有限公司,生产许可证号:SCXK(湘)2011-0006,饲养温度21~25℃,相对湿度40%~70%,12 h/12 h明暗交替,级压差>10 Pa;GTW片,江苏美通制药有限公司生产,多苷含量为每片10 mg,包装规格为每瓶100片,批号101224;异氟烷,深圳市瑞沃德生命科技有限公司,批号204110201;促性腺激素释放激素(gonadotropinreleasing hormone,GnRH)、卵泡刺激素(follicle stimulating hormone,FSH)、黄体生成素(luteinizing hormone,LH)和睾酮(testosterone,T)测定试剂盒,均购自大连泛邦化工技术开发有限公司(R&D公司分装);雄激素受体(androgen receptor,AR)免疫组化试剂盒,购自美国Santa cruz公司。3-18K高速冷冻离心机,德国Sigma公司;ASP 300全密封自动脱水机、EG1160石蜡包埋机和RM2235轮转式切片机,德国Leica公司;Olympus BX 41生物荧光显微镜和DP71图像采集头,日本Olympus公司;IPP 6.0病理图像分析软件,美国Mediacybernetics公司;ELx800型酶标仪,美国BioTek公司。
1.2 动物分组、给药和动态观察
大鼠适应性观察7 d后,根据体质量随机均衡分组。本实验室前期急性毒性预实验结果显示,GTW小鼠半数致死量(LD50)为185.3 mg·kg-1,据此将大鼠分为正常对照组、GTW 37.8和94.5 mg·kg-1组(按公斤体质量折算约为临床剂量24和60倍,按体表面积折算为4和10倍),每组60只,各组ig给药,正常对照组给予等体积纯水,给药容积10 mL·kg-1,每天1次,连续90 d。每组于开始给药后第7天(d7),d15,d30,d60,d90和d120(恢复30 d)检测相关指标。
1.3 伊红染色观察精子形态
大鼠安乐死后,取出单侧附睾尾剔除脂肪,剪断球状部位后,将断面涂于滴有生理盐水的洁净载玻片,干燥后伊红染1 min,95%乙醇漂洗,干燥后封片镜检。每只大鼠400倍下采图5张,随机计数并观察200个精子,计算未成熟精子率(immature sperm rate,ISR)和畸形精子率(abnormal sperm rate,ASR)[7-8]。ISR(%)=未成熟精子数/精子总数×100%。ASR(%)=畸形精子数/精子总数×100%。
1.4 脏器系数
大鼠禁食16~20 h,麻醉后腹主动脉取血安乐死,取出脑、垂体、睾丸和附睾,剔除脂肪后称重,计算脏器系数。脏体系数=脏器质量(g)/体质量(g)×100。脏脑系数=脏器质量(g)/脑质量(g)。
1.5 HE染色检查组织病理变化
脏器用4%甲醛固定后,常规脱水、包埋,切片4 μm,HE染色,镜下观察睾丸和附睾组织病理变化。病理变化使用半定量方式进行统计,分级标准见表1。
1.6 ELISA法检测生殖激素水平
大鼠麻醉后腹主动脉取血,2000×g离心15 min取血清,双夹心ELISA试剂盒检测d60血清GnRH,LH,FSH和T激素水平[9],具体步骤参见试剂盒说明书。
1.7 免疫组化法检测HPG轴和脏器组织中AR表达水平
SABC免疫组化法检测正常对照组和GTW 94.5 mg·kg-1组d60,d90和d120(恢复30 d)大鼠下丘脑、垂体、睾丸和附睾AR表达水平,具体步骤参见试剂盒说明书。阳性颗粒或阳性区域呈棕黄色[10]。结果采用IPP6.0软件进行分析,计算阳性颗粒或阳性区域的积分吸光度(integrated absor⁃bance,IA),判断阳性反应的强度。

Tab.1 Grading standard of pathological changes in testis and epididymis tissues(HE staining)
1.8 统计学分析
实验结果数据以x±s表示,采用SPSS 17.0软件分析组间差异,检验方差齐时采用t检验,方差不齐时采用t′检验。以P<0.05认为差异具有统计学意义。
2 结果
2.1 GTW对雄性大鼠精子形态的影响
与正常对照组相比,GTW 37.8和94.5 mg·kg-1组d60,d90和d120(恢复30 d)ISR显著升高(P<0.01);d30,d60和 d90 ASR 明显升高(P<0.05,0.01)。大鼠开始给药时约为5周龄,未达到性成熟,d30后正常对照组雄性大鼠ISR<5%,ASR<30%,精子发育良好;GTW 37.8和94.5 mg·kg-1组d30后ISR持续升高,表现出精子发育障碍(表2)。主要畸形有断头、圆头、折叠和头部不定型4种。
2.3 GTW对大鼠生殖脏器系数的影响
与正常对照组相比,GTW 37.8 mg·kg-1组自d60、GTW 94.5 mg·kg-1组自 d15起,睾丸和附睾脏器质量、脏体系数和脏脑系数明显下降(P<0.05,P<0.01),d120(恢复30 d)未见改善(P<0.01)。表明GTW长期给药可使睾丸和附睾萎缩及脏器减轻,恢复30 d后未恢复(图1)。
2.4 GTW对大鼠睾丸和附睾组织病理变化的影响

Fig.1 Effect of GTW on reproductive organ mass(A),organ-body coefficient(B)and organ-brain coeffi⁃cient(C)of male SD rats.See Tab.2 for the rat treatment.1:testis;2:epididymis.Organ-body coefficient=organ mass(g)/body mass(g)×100.Organ-brain coefficient=organ mass(g)/brain mass(g).±s,n=10.*P<0.05,**P<0.01,compared with normal control group.
GTW 94.5 mg·kg-1组大鼠自d7起,即出现睾丸曲细精管内各级生精细胞数量明显减少甚至消失,管腔缩小、管壁变薄,形态不规则,部分曲细精管内可见多核巨细胞;随给药时间的延长,病变越明显,病变严重者可见睾丸内所有曲细精管均萎缩,曲细精管内各级生精细胞消失,睾丸体积明显缩小。上述病变在d120(恢复30 d)未见明显恢复(图2和表3)。

Tab.2 Effect of multi-glycosides from Tripterygium wilfordii Hook.f.(GTW)on immature sperm rate(ISR)and abnormal sperm rate(ASR)in male SD rats
GTW 94.5 mg·kg-1组d7时,附睾管内精子未成熟现象,与正常对照组比较无明显差异;d15和d30时附睾管内精子发育障碍,出现短小、断头或断尾或形态异常精子;d60和d90多出现附睾管内空虚,管腔缩小,仅见未成熟精子或细胞成分;d120(恢复30 d)未见恢复(图2和表3)。
2.5 GTW对大鼠生殖激素分泌的影响
与正常对照组相比,d60时 GTW 37.8和94.5 mg·kg-1组血清FSH,LH和T水平明显降低(P<0.01),GnRH分泌未见异常(表4)。

Fig.2 Effect of GTW 94.5 mg·kg-1on pathological changes of testis and epididymis in male rats(HE staining,×100).See Tab.2 for the rat treatment.↑(in testis tissue):seminiferous tubular atrophy and/or sperm production disorders;↑(in epididymis tissue):emptiness of epididymal lumine and/or no mature sperm.

Tab.3 Effect of GTW on pathological changes of testis and epididymis in male rats
2.6 GTW对大鼠雄激素受体表达水平的影响
免疫组化结果显示(图3,表5),d60和d90时GTW 94.5 mg·kg-1组下丘脑中AR表达水平低于正常对照组(P<0.05,P<0.01),d120(恢复30 d)恢复。睾丸和附睾中AR表达水平在给d60,d90和d120均低于正常对照组(P<0.01)。
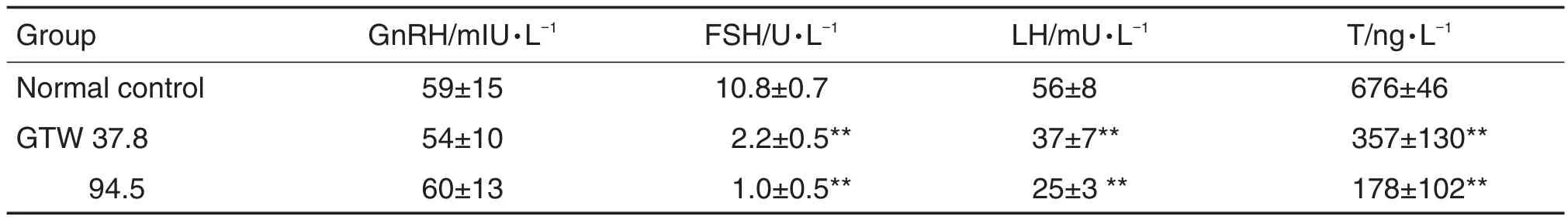
Tab.4 Effect of GTW on reproductive hormone levels of male SD rats

Fig.3 Effect of GTW 94.5 mg·kg-1on androgen receptor(AR)expression in SD male rats(Immunohistochemical staining,×400).See Tab.2 for the rat treatment.Positive particles or positive areas are brownish yellow.↑:positive reaction particle.

Tab.5 Effect of GTW on AR expression in male rats
3 讨论
生殖系统功能在机体内各种因素共同调控下运行,药物对生殖系统造成的损伤可能是通过多种途径,例如直接损伤生殖器官、组织或细胞[9],或通过影响各种酶类,生殖激素和细胞因子等间接损伤生殖系统。临床上GTW对生殖系统的不良反应多发,对于男性患者,短期服用可造成精子活力下降,畸形精子增多;服用2个月后,精液几乎无可见精子[11-12]。青少年应用雷公藤制剂对第二性征发育及性激素水平无明显影响,但可影响部分患儿青春期的生精过程[13]。目前大部分研究已证实,GTW的毒性与用药剂量和时程有关,但是对雷公藤所致的生殖系统功能损伤的发生时点、具体损伤的部位和程度是否可逆等,由于临床研究的局限性,尚缺乏系统的研究[14]。本研究选用的雄性大鼠在给药开始时为5周龄、出生后35 d(postnatal 35 day,PND 35),性器官发育处于关键阶段,给药期大鼠从5周龄(PND 35)至18周龄(PND 125)基本覆盖了青春期至青壮年时期,同时根据临床用药特点设计了给药后d7,d15,d30,d60和d90为观察时间点,以对应临床短期用药和长期用药的情况,用于动态观察GTW对雄性大鼠生殖系统的影响。本研究结果显示,GTW在d7起即对雄性大鼠生殖器官造成损伤,造成精子形成障碍,畸变精子增多,病变发生起始时间有剂量相关性。值得关注的是,经过90 d长期给药后恢复30 d,ASR趋于正常,ISR继续升高,睾丸和附睾的病变未见改善。雄性SD大鼠精子发育成熟约12 d,精子发生整个时程约48 d,可见GTW的毒性可能作用于精子发生的整个过程[15],并随着给药时间延长损伤进行性加重。据临床报道,男性服药1~2个月后停药一段时间生殖功能可恢复,但缺乏长期用药的临床报道[16]。本研究结果提示,有生育需求的男性在长期应用GTW时需要慎重权衡。
为了探讨GTW生殖毒性机制,考察GTW是否影响HPG轴,且由于d30后大鼠才达到性成熟,因此选择在d60检测性激素。结果显示,d60大鼠激素水平已经很低,因此选择GTW 94.5 mg·kg-1组继续检测AR表达,进一步观察GTW对生殖系统的损伤是否与HPG轴有关,期望为临床上患者应用GTW出现明显生殖系统毒性时的防治提供思路。本研究结果表明,GTW组雄性大鼠血清FSH,LH和T水平降低,但GnRH分泌正常。LH降低使睾丸间充质细胞得不到足够的刺激,造成T分泌减少(T降低负反馈调节减弱,因此GnRH分泌正常),影响精子形成的过程。FSH的降低阻碍了精子发生的启动,影响到精子生成的全过程,两者相互作用。HPG轴是一个既有层次又相互作用的系统内分泌架构,形成调控性激素分泌稳态的调节环路,调节生殖器官的成熟发育和生殖的全过程[17],提示GTW可通过抑制激素分泌影响精子生成,导致精子生成障碍并且随着给药时间延长进行性加重。本研究结果还表明,GTW能显著下调雄性大鼠下丘脑、睾丸和附睾中AR表达。AR是介导雄激素发挥作用的必须物质,雄性大鼠AR的基因突变或缺失会造成生殖器官发育畸形甚至不育[18-19],提示GTW可能会引起生殖器官发育损伤。经过本研究动态观察,GTW给药后精子发育、睾丸和附睾脏器损伤进行性加重,提示GTW对生殖系统的毒性机制与下调AR表达有关。
