Fe3O4@SiO2-CS的制备及其对水体中Pb(II)的吸附性能
2018-09-10钟艳辉苏小东
黄 峩 成 祝 钟艳辉 邓 星 苏小东
(重庆科技学院化学化工学院, 重庆 401331)
铅是人体不需要的一种微量元素,铅离子在水体中富集会严重危害到生态环境和人体健康。水体中铅离子的处理技术有多种,其中吸附技术具有高效经济、方便快捷的优点,是一种有效的水体重金属处理技术[1-2]。Fe3O4磁性纳米粒子是一种优良的吸附材料,具有磁分离性、低毒性以及表面效应、小尺寸效应,且表面含有丰富的活性位点,吸附能力较强[3-7]。研究人员利用SiO2、氨基化二氧化硅、壳聚糖、聚丙烯酸、巯基化合物,使纳米Fe3O4复合材料的稳定性和吸附能力得到提高。他们成功地利用壳聚糖的多官能团和多孔性,使吸附材料获得了吸附多种重金属离子的性能;其不足之处是,在此过程中壳聚糖通过交联后物理包裹于Fe3O4磁性纳米材料上,在使用过程中会脱落,造成二次污染。
本次研究中,以Fe3O4和壳聚糖为原料,制备稳定性和吸附能力均较强的吸附材料 —— Fe3O4@SiO2-CS,并通过实验观察Fe3O4@SiO2-CS对Pb(II)的吸附性能。
1 实验部分
1.1 实验仪器和试剂
实验试剂包括:Fe3O4,粒径20 nm,纯度99.5%,麦克林公司制;壳聚糖,BR,上海展云化工有限公司制;TEOS、APTES、冰乙酸、戊二醛、无水乙醇、HCl、NaOH、Pb(NO3)2,均为分析纯;重金属离子贮备液,由Pb(NO3)2加蒸馏水配置,Pb(II)的质量浓度为1 000 mg/L,实验中按需稀释成不同浓度。
实验仪器包括:KS 4000 I control恒温摇床,德IKA公司制;JJ-1精密电动搅拌器,金坛市正基仪器有限公司制;NICOLET iS 10傅里叶变换红外光谱仪,Thermo Fisher Scientific公司制; XRD-7000X射线衍射仪,日本岛津公司制;TEM,FEI Tecnai F 20;TAS-986F原子吸收分光光度计,北京普析通用仪器有限责任公司制;PHS-3E pH计,上海仪电科学仪器股份有限公司制。
1.2 Fe3O4@SiO2-CS的制备
(1) 合成Fe3O4@SiO2-NH2纳米粒子。准备体积分数为85%的乙醇100 mL,并称取2g Fe3O4加于其中,超声振荡20 min;然后,机械搅拌该溶液并依次向其中加入TEOS 3 mL、氨水4 mL,于恒温(40 ℃)水浴中搅拌2.5 h;接着,加入APTES 8 mL,继续搅拌4 h,即成功制备Fe3O4@SiO2-NH2纳米粒子[8]。对制备的Fe3O4@SiO2-NH2纳米粒子进行磁力分离,并用乙醇与超纯水分别清洗3次,以除去未反应的APTES,于60 ℃真空中干燥4 h。
(2) 采用戊二醛交联的方法合成Fe3O4@SiO2-CS。步骤如下:将制备好的Fe3O4@SiO2-NH2分散于40 mL的NaOH溶液(pH = 9.0),超声振荡20 min;准备体积分数为30%的乙醇 150 mL,将200 mg壳聚糖溶于其中;机械搅拌,将Fe3O4@SiO2-NH2溶液加入壳聚糖溶液中,搅拌均匀后向混合溶液中加入体积分数为25%的戊二醛溶液200 μL;在室温下继续搅拌4 h后,将0.5 g NaBH4加入溶液中搅拌12 h,得到Fe3O4@SiO2-CS磁性纳米粒子;将合成的Fe3O4@SiO2-CS混合溶液用0.1 mol/L的HCl中和后,进行磁力分离,并分别用乙醇和超纯水清洗3次,于60 ℃真空干燥4 h。
1.3 Fe3O4@SiO2-CS的Pb(II)吸附实验
量取25 mL的Pb(II)溶液于50 mL锥形瓶中,用0.1 mol/L的HCl,或0.1 mol/L的NaOH溶液调节Pb(II)溶液的pH,加入一定量的Fe3O4@SiO2-CS;超声振荡1 min,混合均匀后放入恒温摇床;再将锥形瓶置于一定温度的恒温振荡箱中,以450 r/min的速率振荡,通过磁力分离取出上清液,采用原子吸收光谱仪测定所含金属离子的质量浓度。用吸附率和单位吸附量表征Fe3O4@SiO2-CS对Pb(II)的吸附性能:
(1)
(2)
式中:η—— Fe3O4@SiO2-CS对Pb(II)的吸附率,%;
qe—— Fe3O4@SiO2-CS对每克Pb(II)的吸附量,mg;
C0—— 溶液中金属离子的初始质量浓度,mg/L;
Ce—— 溶液中金属离子的平衡质量浓度,mg/L;
V—— 溶液的体积,L;
M—— 吸附材料Fe3O4@SiO2-CS的质量,g。
1.4 分析方法
釆用X射线衍射仪对Fe3O4@SiO2-CS的晶形结构进行表征,扫描速度为5(°)/min,扫描范围是25°~100°;采用KBr固体压片法制备样品,利用红外光谱仪对Fe3O4@SiO2-CS进行红外光谱分析表征;通过TEM观察材料的形貌和尺寸大小。
2 实验结果讨论
2.1 材料的表征
由XRD谱分析可看出:Fe3O4、Fe3O4@SiO2-NH2、Fe3O4@SiO2-CS均有标准Fe3O4磁性纳米粒子的典型衍射峰特征,30.060 0°(d=2.970 41)、35.221 3°(d=2.546 05)、42.878 5°(d=2.107 44)、53.265 0°(d=1.718 40)、57.020 0(d=1.613 83)、62.680 0°(d=1.481 02)分别对应于Fe3O4磁性纳米粒子220、200、311、222、400、511、440等晶面的衍射,说明壳聚糖包裹的Fe3O4磁性纳米粒子均为反相尖晶石结构。图1所示为 Fe3O4、Fe3O4@SiO2-NH2和Fe3O4@SiO2-CS材料的XRD图谱。

图1 Fe3O4、Fe3O4@SiO2-NH2和Fe3O4@SiO2-CS 材料的XRD图谱
由红外光谱分析可以看出:3 385.98 cm-1处为—OH和 —NH2的伸缩振动峰,1 654.29 cm-1处为—NH2中N—H的振动峰;1 100.78 cm-1处强而宽的吸收峰为Si—O—Si键反对称伸缩振动吸收峰;796.32 cm-1处的吸收峰则为Si—O—Si的对称伸缩振动峰和弯曲振动峰;577.11 cm-1处为Fe—O键的振动峰。这些现象均表明,—NH2已经成功接入SiO2包覆的磁性离子表面。同时,在Fe3O4@SiO2-CS谱线上,1 554.52 cm-1处应归属于CS的NH3+吸收峰,1 437.55 cm-1处为N—H的变形振动,1 383.10 cm-1处的特征峰对应CS中的C3—OH键,表明Fe3O4@SiO2-NH2上已成功包覆了壳聚糖。图2所示为Fe3O4@SiO2-NH2和Fe3O4@SiO2-CS的红外光谱图。
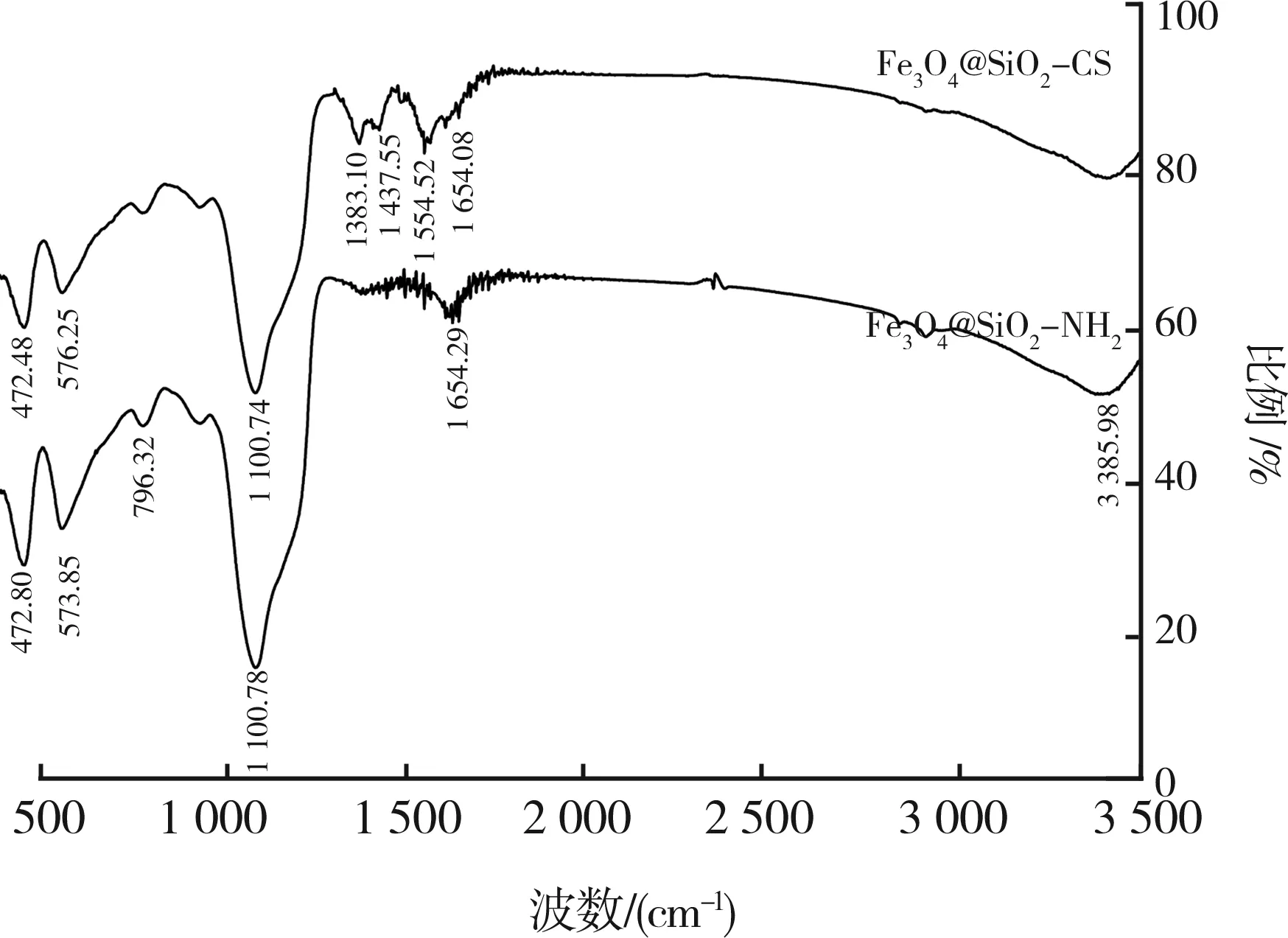
图2 Fe3O4@SiO2-NH2和Fe3O4@SiO2-CS的 红外光谱图
TEM分析表明, Fe3O4@SiO2-NH2材料颗粒呈椭球形,粒径为150~200 nm,颗粒均匀完整,形貌较好,颗粒部分团聚现象可能是由于制样时未分散均匀所致。由颗粒密度和颜色深浅可看出,材料呈现明显的“核 - 壳”结构,中间颜色较深部分为Fe3O4磁性纳米粒子,结合红外图谱出现的Si — O — Si键分析边缘颜色较浅部分为SiO2外壳,厚度为60~70 nm。同时,在Fe3O4@SiO2-NH2表面不均匀地包覆了一层厚10 nm的浅灰色薄膜,且有明显分界线。根据红外分析可知,该薄膜是键合的CS,表明已经形成了Fe3O4@SiO2-CS纳米材料。图3所示为Fe3O4@SiO2-NH2和Fe3O4@SiO2-CS的TEM表征图。
2.2 溶液初始pH对Pb(II)吸附反应的影响
在Fe3O4@SiO2-CS投入量为0.2 g/L、溶液Pb(II)初始质量浓度为10 mg/L、吸附时间为2 h、恒温303 K的条件下,分析溶液pH对Pb(II)吸附率及吸附量的影响。图4所示为不同pH下的Pb(II)吸附率及吸附量。随着pH值加大,Fe3O4@SiO2-CS 对水溶液中Pb(II)的吸附率和吸附量先急剧增加,随后逐渐趋于稳定。当pH值为2时,溶液中存在H+与Pb2+、Pb(OH)+的相互竞争作用,—NH2、—OH的部分质子化反应使得Fe3O4@SiO2-CS表面呈正电性[9],静电相互排斥抑制了Pb(II)的表面络合,导致在强酸性条件下Fe3O4@SiO2-CS对Pb2+、Pb(OH)+的吸附率及吸附量较低。随着pH值加大,Fe3O4@SiO2-CS吸附材料对Pb(II)的络合作用增强,能最大程度地跟Pb(II)结合,因此吸附率和吸附量都随之增大。而当pH≥6时,部分铅离子水解并以Pb(OH)2的形式沉淀下来,影响了Pb(II)的表面络合,降低了Fe3O4@SiO2-CS的铅吸附能力[10]。因此,本次研究中的吸附实验中将pH值均设定为5。

图3 Fe3O4@SiO2-NH2和Fe3O4@SiO2-CS的 TEM表征图

图4 不同pH下的Pb(II)吸附率及吸附量
2.3 Fe3O4@SiO2-CS对Pb(II)的吸附动力学性能
在Fe3O4@SiO2-CS加入量为0.2 g/L、溶液Pb(II)初始质量浓度为10 mg/L、溶液pH为5、恒温303 K的条件下,分析不同吸附时间对吸附率的影响。图5所示为吸附时间对Pb(II)吸附量的影响。随着吸附时间的延长,吸附量逐渐增大,在120 min时基本达到吸附平衡。为了研究Fe3O4@SiO2-CS对Pb(II)的吸附速控步骤和动力学规律,利用Lagergren一级和二级动力学模型对实验数据进行拟合分析:
ln(qe-qt)=lnqe-k1t
(3)

(4)
式中:t—— 吸附时间,min;
qt—— 0~t时的每克质量Pb(II)平衡吸附量,mg;
k1—— 一级动力学模型的吸附动力学常数,min-1;
k2—— 二级动力学模型的吸附动力学常数,g/(mg·min)。
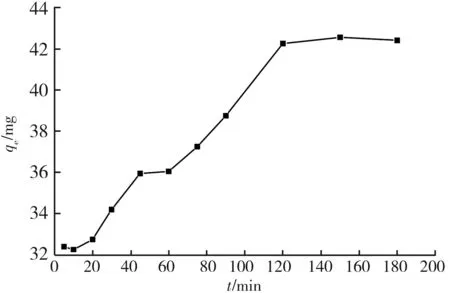
图5 吸附时间对Pb(II)吸附量的影响
根据表1拟合直线的截距和斜率,计算准一级和准二级动力学的平衡吸附量与吸附动力学常数。图6所示为Fe3O4@SiO2-CS对Pb(II)的吸附动力学性能。由实验结果可知,准二级动力学方程中R2为0.995,准一级动力学方程中R2为0.908,前者大于后者。因此,Fe3O4@SiO2-CS对Pb(II)的吸附行为符合准二级动力学方程,吸附过程属于化学吸附过程。准二级动力学方程计算得到理论平衡吸附容量与实验所得到的结果值相吻合,说明此方程能够很好地反映Fe3O4@SiO2-CS对Pb(II)的吸附过程。
2.4 Fe3O4@SiO2-CS材料对Pb(II)的吸附热力学性能
在Fe3O4@SiO2-CS加入量为0.2g/L、溶液Pb(II)的初始质量浓度为10 mg/L、溶液pH为5、吸附时间为2 h的条件下,分析不同吸附温度对吸附率的影响。通过研究吸附热力学,能直接观察吸附过程中的能量变化:
(5)
ΔG=ΔH-TΔS
(6)
式中: ΔG——吉布斯自由能变, kJ/mol;
ΔH—— 焓变,kJ/mol;
T—— 吸附温度,K;
ΔS—— 熵变,J/(mol·K)。

表1 Fe3O4@SiO2-CS对Pb(II)吸附的Lagergren准一级和准二级动力学拟合结果

图6 Fe3O4@SiO2-CS对Pb(II)的吸附动力学性能
以qeCe的自然对数对1T作图,计算出在不同温度范围内的焓变、熵变及在各个温度下的吉布斯自由能变化。图7所示为Fe3O4@SiO2-CS对Pb(II)的吸附热力学性能。随着温度的上升,材料对水溶液中金属离子的吸附量逐渐增加。在吸附温度为298~318 K时,对 Pb(II)的吸附过程焓变ΔH= 44.59 kJmol。ΔH大于0,说明该吸附过程为吸热反应,升温有利于吸附的进行。此时,吸附过程的熵变ΔS= 176.97 J(mol·K)。ΔS大于0,说明吸附过程为熵增过程,整个体系的混乱度增大,导致自由度增大。吸附温度为293~313 K时,对吸附的吉布斯自由能变化ΔG<0,表明该材料对水溶液中Pb(II)的吸附过程能自发进行;同时,吉布斯自由能变化ΔG的绝对值随着吸附过程温度的升高而变大,表明吸附的自发性与温度正相关[11],温度升高有利于Pb(II)与材料的官能团进行配位络合,这与ΔH表现出的规律一致。
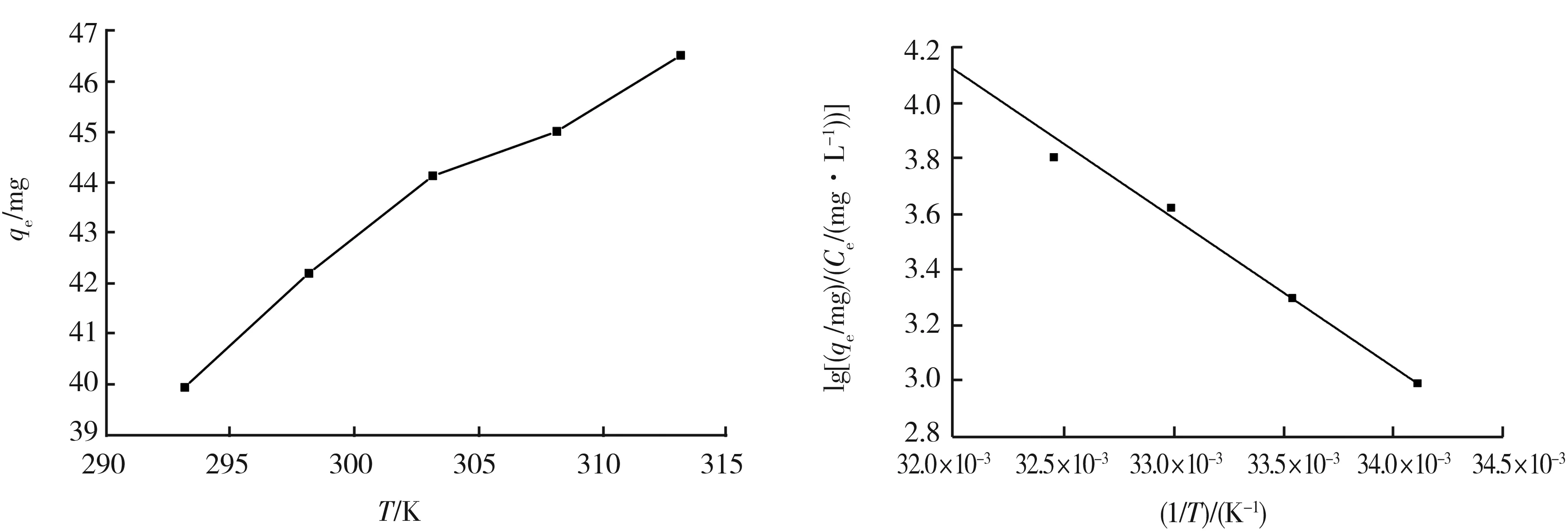
图7 Fe3O4@SiO2-CS对Pb(II)的吸附热力学性能
2.5 Fe3O4@SiO2-CS材料对Pb(II)的吸附等温曲线
随着Pb(II)初始浓度的增加,吸附量先急剧增大,随后趋势逐渐平缓。当C0≥ 200 mg/L时,单位质量Fe3O4@SiO2-CS可吸附的Pb(II)含量变化不大,平衡吸附量约为257 mg/g。其主要原因是,随着Pb(II)初始浓度的增加,溶液中的Pb(II)与吸附剂接触几率增大,导致平衡吸附量增大;而当Pb(II)初始浓度增大到一定程度后,由于吸附剂表面活性位点的数目有限,吸附量保持不变[12]。图8所示为Fe3O4@SiO2-CS在不同初始浓度下对Pb(II)的吸附等温曲线。

图8 Fe3O4@SiO2-CS在不同初始浓度下对Pb(II)的 吸附等温曲线
吸附等温线是在固定的温度和pH下,通过研究重金属离子浓度以及吸附容量来了解吸附过程的机理。在此,选用最常用的Langmuir模型和Freundlich模型,分别如式(7)、(8):
(7)
(8)
式中:qm——与吸附容量有关的Langmuir吸附常数,mgg;
KL——与吸附能有关的Langmuir吸附常数,mgL ;
KF——与吸附容量相关的Freundlich吸附常数;
n—— 与吸附强度相关的Freundlich吸附常数。
将重金属离子浓度与吸附容量按照Langmuir模型和Freundlich模型拟合。图9所示为Fe3O4@SiO2-CS对Pb(II)的吸附等温曲线。拟合后Langmuir模型的R2为0.992,Freundlich模型的R2为0.927,前者大于后者。这表明Fe3O4@SiO2-CS对Pb(II)的吸附过程符合Langmuir 模型,为单分子层吸附。在此条件下,由Langmuir模型拟合出的Pb(II)最大吸附容量为260.417 mgg,与实际平衡吸附容量基本吻合。
3 结 语
本次实验所制备的Fe3O4@SiO2-CS保持了Fe3O4尖晶石结构,FTIR及TEM表征显示壳聚糖已成功修饰于复合材料表面。材料对Pb(II)吸附过程符合Lagergren准二级动力学方程,吸附属于化学吸附过程。在298~318K的温度范围内,材料对Pb(II)的吸附过程为吸热反应,升温有利于吸附的进行,吸附为熵增过程,能自发进行。Langmuir等温吸附模型能很好地描述Fe3O4@SiO2-CS对Pb(II)的吸附行为,该吸附过程为单分子层吸附。

图9 Fe3O4@SiO2-CS对Pb(II)的吸附等温曲线
