银杏二萜内酯对心肌缺血再灌注损伤大鼠细胞凋亡的影响及其机理研究
2018-09-10李延珍李忠辉李国庆董志欢郭海平
李延珍 李忠辉 李 良 杨 建 李 锐 李国庆 董志欢 郭海平
(邯郸市第一医院,河北邯郸 056002)
银杏叶为银杏科银杏属多年生落叶乔木银杏的叶,是我国传统中药品种,《本草纲目》和《中药志》中均有记载,其性味甘苦涩平,具有益心敛肺、化湿止泻之功效。现代药学研究发现,银杏二萜内酯类化合物为银杏叶的主要有效成分,银杏二萜内酯葡胺注射液(DGMI)主要成分为银杏内酯,其中银杏内酯A占35%,银杏内酯B占60%,银杏内酯C占2%,银杏内酯K占2%。既往研究发现DGMI具有抑制氧化应激、抑制细胞凋亡等多种生物学作用[1-2],但DGMI是否对心肌缺血再灌注后细胞凋亡具有抑制作用及其作用机制报道尚不多见。本研究通过结扎冠状动脉前降支建立心肌缺血再灌注大鼠模型,造模前7d开始给予DGMI进行干预,探讨DGMI对心肌缺血再灌注后细胞凋亡的影响及其可能的机制。
1 实验材料
1.1 实验动物 健康清洁级雄性SD大鼠(8周龄,220~260g),购自河北省实验动物中心,动物合格证号:SCXK(冀)2013-1-003。饲养环境:23℃~25℃,相对湿度55%~60%,适应性饲养1周后进行实验。
1.2 药物与试剂 银杏二萜内酯葡胺注射液(DGMI)购自江苏康缘药业股份有限公司(批号:20170416);TTC购自美国Sigma公司(批号:M2128);TUNEL试剂盒购自南京建成生物工程研究所(批号:161208);Bcl-2、Bax、激活型Caspase-3多克隆抗体购自上海碧云天生物技术有限公司(批号:20170316、20170401、20170329)。
1.3 仪器 生物机能实验系统(成都泰盟科技有限公司);石蜡切片机(德国Leica公司);BI-2000医用图像分析系统(成都泰盟科技有限公司);FA25匀浆机(上海洽姆仪器科技有限公司);倒置光学显微镜(日本Olympus公司);DYCZ-24D双垂直电泳槽、DYCZ-40B转印电泳槽、DYY-11型多用电泳仪(北京六一仪器厂);低温离心机(德国eppendorf公司)。
2 实验方法
2.1 分组、给药与造模 将100只实验用大鼠按随机数字表法随机分为假手术组、模型组和DGMI低(1.5mg/kg)、中(3mg/kg)、高(6mg/kg)剂量组,每组20只。DGMI各剂量组分别腹腔注射DGMI 1.5、3、6mg/(kg·d),1次/d,连续7d,假手术组和模型组给予生理盐水。最后1次给药2h后,除假手术组外其余各组大鼠参照徐叔云等[3]报道的实验方法,通过夹闭左冠状动脉前降支的方法制备心肌缺血再灌注损伤大鼠模型,实验过程实施心电图监测,心电图示ST段抬高或T波高耸为心肌缺血,夹闭30min后恢复血流灌注,抬高的ST段降低或高耸的T波得以恢复表示心肌再灌注成功。假手术组行手术通路但不夹闭冠状动脉。
2.2 心电指标监测 全程实施心电图监测,再灌注60min后记录各组大鼠心电图PR间期、QRS间期、ST段变化。
2.3 取材及指标检测 完成心电指标监测后,各组大鼠均腹腔注射水合氯醛实施麻醉后开胸取心脏组织。各组随机取8只大鼠进行心肌梗死面积测定,再随机取4只大鼠进行心肌组织病变和心肌细胞凋亡观察,剩余8只大鼠进行Bcl-2、Bax、激活型Caspase-3蛋白表达检测,
2.3.1 TCC染色法测定心肌组织梗死面积 取心脏组织置-20℃冻存20min后切片,2%TTC溶液(恒温37℃、避光)孵育15min,灰白色为梗死区,采用医用图像分析系统分析心肌组织梗死面积。
2.3.2 心肌组织病变及心肌细胞凋亡的观察 取心脏组织并置于4%多聚甲醛溶液中72h进行固定,经常规脱水、石蜡包埋、切片和脱蜡水化处理后,通过HE染色并通过倒置光学显微镜观察心肌组织病变,通过TUNEL染色后使用倒置光学显微镜观察各组大鼠心肌细胞凋亡状况。凋亡指数(AI)计算:每张TUNEL染色切片选取不重叠的6个视野,分别计数每个视野中的细胞总数和凋亡细胞数,各组取平均值后计算AI。AI(%)=阳性细胞数/细胞总数×100%。
2.3.3 Western blotting法 检 测Bcl-2、Bax、激 活 型Caspase-3蛋白表达 取心肌组织并研磨匀浆,经12000r/min低温(4℃)离心20min处理后取沉淀,BCA法行蛋白定量后实施高温蛋白变性,电泳,待溴酚蓝接近胶底部时停止,转膜,春红溶液染色,室温下5%脱脂奶粉封闭2h,一抗Bcl-2、Bax、激 活 型Caspase-3、β-actin(1∶500)4℃过夜,洗膜,二抗(1∶100)室温摇床上孵育1h后经ECL显色。根据条带灰度值,以β-actin为内参半定量分析Bcl-2、Bax、激活型Caspase-3蛋白表达。
2.4 统计学方法 运用SPSS 15.0进行统计分析。计量资料以()表示,多组间均数比较采用单因素方差分析,进一步两两比较采用LSD-t检验;计数资料采用χ2检验。P<0.05为差异有统计学意义。
3 实验结果
3.1 各组大鼠心电图监测情况 与假手术组大鼠比较,模型组及DGMI各剂量组大鼠结扎左冠状动脉前降支后出现左心室前壁呈灰白,而后逐渐呈现紫绀的症状,心电图示ST段抬高或T波高耸,提示急性心肌梗死大鼠模型造模成功。经DGMI中、高剂量预处理7d,缺血再灌注损伤大鼠心电图波形明显改善,以DGMI高剂量组心电图波形改善情况最为显著。各组大鼠缺血再灌注60min时心电图检测结果见表1。
3.2 各组大鼠心肌组织梗死面积比较 假手术组大鼠心肌组织无梗死,模型组大鼠心肌组织梗死面积为(45.18±5.60)%,显著高于假手术组(P<0.01);DGMI低、中、高剂量组梗死面积分别为(39.43±7.27)%、(31.94±5.62)%、(22.41±4.53)%,与模型组比较,DGMI中、高剂量组心肌梗死面积显著降低(P<0.05或P<0.01)。与DGMI低剂量组比较,DGMI高剂量组梗死面积显著降低(P<0.01);DGMI中剂量组梗死面积与DGMI低、高剂量组比较,差异均无统计学意义(P>0.05)。
3.3 各组大鼠心肌组织病变观察结果比较 经HE染色后观察病理切片,假手术组心肌组织结构、细胞形态均未见明显异常;模型组心肌组织呈现肌原纤维断裂、排列紊乱,心肌细胞呈空泡变性,细胞质着色不均,胞核深染等病理性改变;与模型组比较,DGMI低、中、高剂量组大鼠心肌组织病变呈现不同程度改善,以DGMI高剂量组效果最为显著。见图1。
表1 各组大鼠心电图PR间期、QRS间期、ST段比较()

表1 各组大鼠心电图PR间期、QRS间期、ST段比较()
注: 与假手术组比较,**P<0.01;与模型组比较,△P<0.05,△△P<0.01;与DGMI低剂量组比较,#P<0.05,##P<0.01。
组别 动物数(只) PR间期(ms) QRS间期(ms) ST段(mV)假手术组 20 44.69±4.78 32.19±2.88 0.22±0.04模型组 20 31.74±4.59** 22.35±2.73** 0.51±0.06**DGMI低剂量组 20 34.00±4.96 22.52±2.60 0.49±0.07 DGMI中剂量组 20 36.51±5.25△ 25.94±2.99△ 0.41±0.08△DGMI高剂量组 20 36.85±5.28△ 27.80±3.32△△## 0.35±0.05△△#
3.4 各组大鼠心肌细胞凋亡状况比较 经TUNEL染色后观察,模型组心肌细胞凋亡数量较假手术组明显增多;与模型组比较,DGMI低、中、高剂量组心肌细胞凋亡数量明显减少,以DGMI高剂量组最为显著。见图2。假手术组心肌细胞AI为0;模型组大鼠心肌细胞AI为(56.81±10.24)%,较假手术组显著升高(P<0.01);DGMI低、中、高剂量组AI分别为(45.86±9.11)%、(39.24±7.83)%、(26.35±5.79)%,与模型组比较,DGMI中、高剂量组AI显著降低(P<0.05或P<0.01)。与DGMI低、中剂量组比较,DGMI高剂量组AI显著降低(P<0.05或P<0.01);DGMI低、中剂量组组间AI比较,差异无统计学意义(P>0.05)。
3.5 各组大鼠心肌组织Bcl-2、Bax、激活型Caspase-3蛋白表达比较 结果见图3、表2。
4 讨论
随着高血压、高血脂等基础疾病发病率的提高,冠状动脉粥样硬化性心脏病(coronary heart disease,CHD)以及由其所引发的急性心肌梗死(aeute myoeardial infaretion,AMI)发病率逐年升高,严重危害着人类的生命健康。及时通过药物或介入手术溶栓以实现血流恢复灌注是目前临床上治疗AMI的主要方案,但缺血再灌注损伤并发症的存在严重影响着AMI预后。缺血再灌注损伤病理机制非常复杂,既往研究发现心功能异常、氧化应激损伤、炎症反应以及继发性心肌细胞凋亡是缺血再灌注损伤发生发展的重要病理机制[4-8],这也为我们研发能够有效降低缺血再灌注损伤的新型药物提供了思路。

图1 各组大鼠心肌组织形态(HE,×200倍)

图2 各组大鼠心肌细胞凋亡状况(TUNEL,×400倍)

图3 各组大鼠心肌组织Bcl-2、Bax、激活型Caspase-3蛋白表达
表2 各组大鼠心肌组织Bcl-2、Bax、激活型Caspase-3蛋白表达比较()
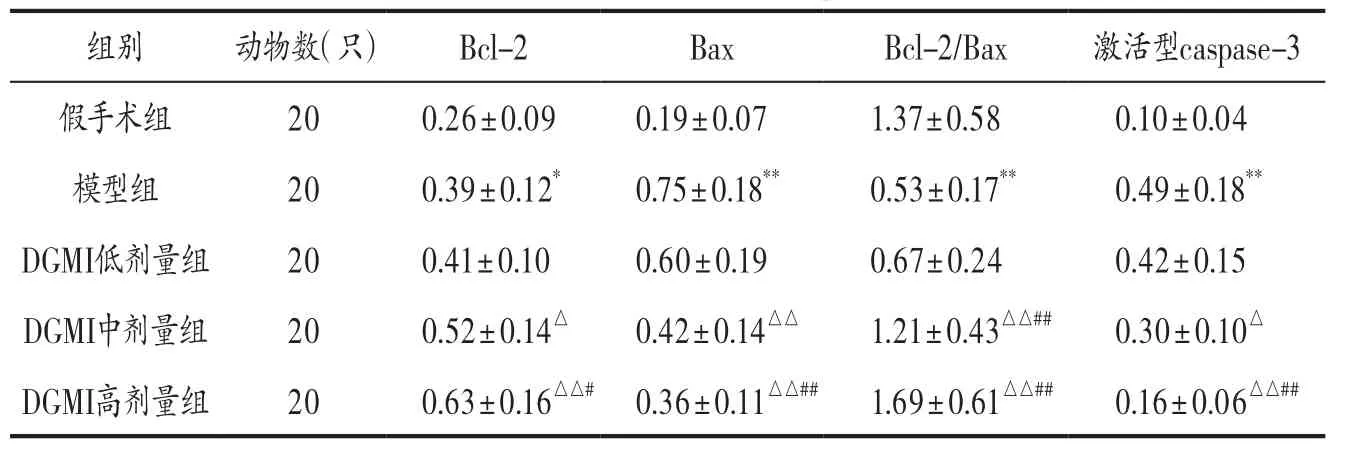
表2 各组大鼠心肌组织Bcl-2、Bax、激活型Caspase-3蛋白表达比较()
注: 与假手术组比较,*P<0.05,**P<0.01;与模型组比较,△P<0.05,△△P<0.01;与DGMI低剂量组比较,#P<0.05,##P<0.01。
组别 动物数(只) Bcl-2 Bax Bcl-2/Bax 激活型caspase-3假手术组 20 0.26±0.09 0.19±0.07 1.37±0.58 0.10±0.04模型组 20 0.39±0.12* 0.75±0.18** 0.53±0.17** 0.49±0.18**DGMI低剂量组 20 0.41±0.10 0.60±0.19 0.67±0.24 0.42±0.15 DGMI中剂量组 20 0.52±0.14△ 0.42±0.14△△ 1.21±0.43△△## 0.30±0.10△DGMI高剂量组 20 0.63±0.16△△# 0.36±0.11△△## 1.69±0.61△△## 0.16±0.06△△##
心电图ST段抬高或T波高耸是急性心肌梗死的典型表现,本研究采用结扎左冠状动脉前降支的方法制备急性心肌梗死大鼠模型,该造模方法操作简单、成功率高且与临床AMI症状接近,是目前AMI动物实验研究常用的造模方法[9]。本实验研究结果表明,经DGMI干预能够有效改善心肌缺血再灌注损伤大鼠心电图波形,改善心肌组织病变,减小心肌组织梗死面积,且高剂量组上述作用均优于低剂量组,提示DGMI对心肌缺血再灌注损伤具有保护作用并且该作用具有一定的剂量依赖性。
激活型Caspase-3和Bcl-2基因家族Bcl-2、Bax是细胞凋亡过程中重要的调控基因。激活型Caspase-3参与细胞凋亡的启动以及整个凋亡过程的调控[10-12];Bcl-2能够抑制细胞色素C释放和Caspase-3激活,调节细胞内钙浓度,而具有抑制细胞凋亡的作用[13];Bax具有破坏线粒体渗透性、激活Caspase-3而表现出促细胞凋亡作用[14];Saeedi Borujeni MJ等[15]研究发现Bax与Bcl-2能够聚合成二聚体,从而相互抑制活性,所以Bax/Bcl-2表达比值更加能够体现二者对细胞凋亡的实际调控作用。本研究发现,经DGMI干预能够显著上调心肌缺血再灌注损伤大鼠心肌组织Bcl-2蛋白表达,下调Bax和激活型Caspase-3蛋白表达,显著提高Bax/Bcl-2比值,高剂量组对Bcl-2蛋白、Bax和激活型Caspase-3蛋白的调控作用均优于低剂量组,这可能是DGMI抑制心肌细胞凋亡的重要分子机制之一。
综上所述,DGMI可能通过抑制心肌细胞凋亡而对心肌缺血再灌注损伤起到一定的保护作用,其机制可能与DGMI调节凋亡相关蛋白(上调Bcl-2蛋白表达、下调Bax和激活型Caspase-3蛋白表达,提高Bax/Bcl-2表达比值)有关。氧化应激是缺血再灌注损伤重要病理机制之一,DGMI对心肌缺血再灌注损伤后氧化应激的影响及其与心肌细胞凋亡的关系有待于进一步探讨。
